
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Стехиометрические коэффициенты в уравнениях реакций имеют относительный, а не абсолютный характер.
Например, двойка перед формулой H2 в уравнении реакции водорода с кислородом 2H2 + O2 = 2H2O сама по себе, без связи с другими коэффициентами, не означает ровным счётом ничего – ни 2 моль, ни 2 молекулы, ни 2 части водорода. Она приобретает смысл только в сравнении с другими коэффициентами, например единицей перед формулой O2. Отношение этих коэффициентов, то есть 2/1, показывает, что водорода в реакцию всегда вступает в 2 раза больше, чем кислорода. Поскольку химический смысл имеют не сами стехиометрические коэффициенты, а только их отношение, все коэффициенты можно изменить в одинаковое число раз, а суть химического уравнения при этом не изменится. Например, записи 2H2 + O2 = 2H2O H2 + 1/2 O2 = H2O 10H2 + 5O2 = 10H2O представляют собой одно и то же химическое уравнение, описывающее взаимодействие водорода и кислорода с образованием воды. Математики и физики говорят, что «химические уравнения определены с точностью до постоянного сомножителя». Выбор конкретных коэффициентов – это дело вкуса и персональных предпочтений. Известно, что многие учителя не любят дробных коэффициентов. Приведённые выше рассуждения показывают, что дробные коэффициенты имеют полное право на существование, так как они выражают не абсолютные, а относительные количества веществ. Более того, в некоторых расчётах, например термохимических (см. далее) дробные коэффициенты необходимы. Приведенное выше утверждение об относительности стехиометрических коэффициентов лишает смысла задания типа «Чему равна сумма коэффициентов в уравнении реакции меди с разбавленной азотной кислотой?». Смысл подобных заданий понятен, однако они сформулированы некорректно с точки зрения стехиометрии. Правильная формулировка в применении, например, к реакции 3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO + 4H2O может быть такой: «Чему равна сумма коэффициентов … при условии, что коэффициенты выражаются минимальными целыми числами?» Или: «Чему равен коэффициент при HNO3, если коэффициент при NO равен 2?» Для использования соотношений пропорции в химических расчётах удобным и полезным оказывается понятие «моль реакции». Это странное на первый взгляд сочетание слов обозначает количества веществ, которые равны стехиометрическим коэффициентам. Например, в моле реакции:
1/2 N2 + 3/2 H2 = NH3 участвуют 0,5 моль N2, 1,5 моль H2 и 1 моль NH3. Это понятие широко используют в термохимии. Общая схема, позволяющая соотнести между собой количества вещества, массы и объёмы реагентов и продуктов реакции выглядит следующим образом:
Для расчётов по химическим уравнениям, так же как и по химическим формулам (см. лекцию 1), можно использовать два эквивалентных способа – через количество вещества или через пропорцию. Эти два способа различаются только по форме, а по сути представляют собой одно и то же.
Пример 14. Сколько граммов хлорида натрия образуется при обработке 15 г карбоната натрия, содержащего 15% примесей, избытком соляной кислоты? Решение. Прежде всего найдем массу чистого карбоната натрия. Примесей в образце карбоната натрия содержится 15%, а чистого вещества – 85%: m (Na2CO3) = m ´ w = 15 ´ 0,85 = 12,75 г. Запишем уравнение химической реакции: Na2CO3 + 2HCl = 2NaCl + CO2 + H2O. I способ. Массу продуктов реакции можно рассчитать через количество вещества, используя следующую схему: m (исх.в-ва) ® n(исх.в-ва) ® n(продукта) ® m (продукта). Найдём количество карбоната натрия: n(Na2CO3) = m / M = 12,75 / 106 = = 0,12 моль. По основному закону химической стехиометрии, отношение количеств реагирующих веществ (в молях) равно отношению соответствующих коэффициентов в уравнении реакции. Коэффициент перед NaCl в 2 раза больше, чем коэффициент перед Na2CO3, поэтому количество хлорида натрия также в 2 раза больше: n(NaCl) = 2n(Na2CO3) = 0,24 моль. Масса хлорида натрия: m (NaCl) = n ´ M = 0,24 ´ 58,5 = 14 г. II способ. Составим пропорцию. Одну строчку запишем по уравнению для одного моля реакции, а вторую – по условию задачи. из 1 моль (106 г) Na2CO3 образуется 2 моль (2 ´ 58,5 = 117 г) NaCl из 12,75 г Na2CO3 образуется x г NaCl. x = 12,75 ´ 117 / 106 = 14 г. Ответ. 14 г NaCl.
Первый способ лучше использовать для учащихся с хорошей физико-математической подготовкой, второй – для базового уровня. Рассмотрим пример расчёта по уравнению реакции с участием газа.
Пример 15. Рассчитайте объём газа (при н.у.), который выделится при действии избытка концентрированной азотной кислоты на 16 г меди.
Решение. Запишем уравнение реакции: Cu + 4HNO3(конц) = Cu(NO3)2 + 2NO2 + 2H2O. Выделяющийся газ – оксид азота (IV), NO2. Для нахождения его объёма по уравнению реакции используем оба вышеупомянутых способа: I способ (через количество вещества). Объём продукта реакции рассчитывается по схеме: m (исх.в-ва) ® n(исх.в-ва) ® n(продукта) ® ® V (продукта) = n ´ Vm. Найдём количество меди: n(Cu) = m / M = 16 / 64 = 0,25 моль. Стехиометрический коэффициент перед NO2 в 2 раза больше, чем перед Cu, поэтому количество NO2 также в 2 раза больше: n(NO2) = 2n(Cu) = 0,5 моль. Объём оксида азота (IV): V (NO2) = n ´ Vm = 0,5 ´ 22,4 = 11,2 л. II способ (пропорция). Согласно уравнению реакции (для моля реакции), из 1 моль (64 г) Cu выделяется 2 моль (2 ´ 22,4 = 44,8 л) NO2; из 16 г Cu выделяется x л NO2. x = 16 ´ 44,8 / 64 = 11,2 л. Ответ. 11,2 л NO2.
Если в реакции участвуют только газы, то в расчётах можно обойтись без количества вещества, ограничившись только объёмами. Для этого объединяют закон Авогадро и основной закон стехиометрии – это приводит к закону объёмных отношений, который можно выразить следующим образом:
В газовых реакциях отношение объёмов реагирующих веществ равно
Для реакции вида a A + b B = c C + d D, протекающей в газовой фазе, объёмы реагирующих веществ связаны соотношением:
С помощью закона объёмных отношений впервые в химии были правильно определены формулы многих газообразных веществ, например, H2, O2, N2, H2O. Обратим внимание на то, что это т закон применим не только при нормальных условиях, когда молярный объём любого газа равен 22,4 л/моль, а при любых условиях.
Пример 16. Какой объём кислорода требуется для сжигания 2 м3 пропана? Какой объём углекислого газа при этом образуется? Решение. Запишем уравнение реакции сгорания пропана: C3H8 + 5O2 = 3CO2 + 4H2O. Газы, участвующие в реакции, находятся при одинаковых условиях, поэтому для расчёта их объёмов не надо находить количество вещества, а можно применить закон объёмных отношений. По уравнению сгорания, для сжигания 1 объёма C3H8 необходимо 5 объёмов O2; для сжигания 2 м3 C3H8 необходимо x м3 O2. x = 2 ´ 5 / 1 = 10 м3. Аналогично рассчитывается объём углекислого газа: при сжигании 1 объёма C3H8 образуется 3 объёма CO2; при сжигании 2 м3 C3H8 образуется y м3 CO2. y = 2 ´ 3 / 1 = 6 м3. Ответ. 10 м3 O2, 6 м3 CO2.
Если в условии задачи даны массы (или объёмы) нескольких реагентов, то расчёт ведут по тому из веществ, которое находится в недостатке, т.е. первым заканчивается в реакции. Количества веществ, которые точно соответствуют уравнению реакции, т.е. без избытка или недостатка, называют стехиометрическими количествами. Чтобы установить, какой из реагентов находится в недостатке, сравнивают между собой их исходные количества, делённые на стехиометрические коэффициенты:
То, из веществ, у которого это отношение – наименьшее, находится в недостатке.
Пример 17. Рассчитайте массу воды, которая образуется при реакции между 5 г водорода и 50 г кислорода. Решение. Запишем уравнение реакции: 2H2 + O2 = 2H2O. Найдём количества вещества: n(H2) = m / M = 5 / 2 = 2,5 моль, n(O2) = m / M =
т.к.
В том, что водород находится в недостатке, можно убедиться и по-другому: для того, чтобы сжечь 2,5 моль H2, необходимо взять 2,5 / 2 = 1,25 моль O2, а у нас есть 1,56 моль, поэтому кислород – в избытке, водород – в недостатке. Расчёт массы воды ведём по водороду: n(H2O) = n(H2) = 2,5 моль, m (H2O) = n ´ M = 2,5 ´ 18 = 45 г. Ответ. 45 г H2O.
Расчёты по схемам реакций
Полное уравнение реакции со всеми коэффициентами отражает сохранение числа атомов каждого элемента. Если в расчёте участвуют не все участники реакции, а только некоторые из них, то нет необходимости составлять полное уравнение и находить все стехиометрические коэффициенты. Даже необязательно указывать все вещества, участвующие в реакции – достаточно ограничиться схемой, включающей необходимые вещества и коэффициенты.
Пример 18. Сколько килограммов фосфора теоретически можно получить из 62 кг фосфата кальция? Решение. При стандартном подходе необходимо записать полное уравнение получения фосфора из фосфата кальция: Ca3(PO4)2 + 3SiO2 + 5C = 2P + 5CO + 3CaSiO3 и выполнить расчёт по этому уравнению. Однако, в данной задаче нас интересует не конкретный способ получения фосфора, а только его общее количество. Это позволяет заменить уравнение на схему: Ca3(PO4)2 ® 2P Эта схема содержит только те вещества и те стехиометрические коэффициенты, которые непосредственно участвуют в расчёте. Так же, как и полное уравнение, она отражает закон сохранения массы, но не всех элементов, а только одного – фосфора. Дальнейшие действия аналогичны рассмотренным выше. Выполним расчёт по молям: n(Ca3(PO4)2) = m / M = 62 / 310 = 0,2 кмоль. Согласно схеме, количество фосфора в 2 раза превышает количество фосфата: n(P) = 2n(Ca3(PO4)2) = Масса фосфора: m (P) = n × M = 0,4 × 31 = 12,4 кг. Ответ. 12,4 кг P.
Принцип сохранения числа атомов конкретного элемента позволяет включать в расчётную схему не одно, а сразу несколько уравнений реакции и тем самым избегать всех промежуточных вычислений. Получается очень экономный и эффективный способ расчёта.
Пример 19. Рассчитайте массу серной кислоты, которую теоретически можно получить из 600 кг пирита (дисульфида железа (II)). Решение. Производство серной кислоты из пирита включает три основные стадии – обжиг пирита: 4FeS2 + 11O2 = 2Fe2O3 + 8SO2, окисление сернистого ангидрида до серного: 2SO2 + O2 = 2SO3
и гидратацию последнего: SO3 + H2O = H2SO4. Согласно этим уравнениям: n(H2SO4) = n(SO3) = n(SO2) = 8/4 n(FeS2). Тем самым, используя три уравнения, мы связали количества исходного сырья и целевого продукта реакции. Однако, мы могли бы это сделать сразу, записав суммарную схему процесса с коэффициентами, отражающими закон сохранения числа атомов серы: FeS2 ® 2H2SO4. В соответствии с этой схемой, n(H2SO4) = 2n(FeS2) = 2×(600/120) = 10 кмоль. Масса серной кислоты: m (H2SO4) = n × M = 10 × 98 = 980 кг. Разумеется, в практических расчётах необходимо принимать во внимание то, что многие реакции протекают не до конца, поэтому надо учитывать выход продукта на каждой стадии. Однако, если речь идёт только о максимально возможном количестве продукта, которое соответствует 100%-ному выходу, то можно ограничиться схемой с коэффициентами. Ответ. 980 кг H2SO4.
|
||||||||
|
Последнее изменение этой страницы: 2021-05-27; просмотров: 263; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.119.104.238 (0.03 с.) |
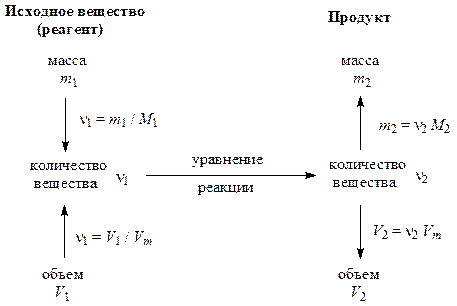
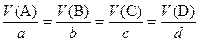 .
.




