
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Производство серной кислоты .Стр 1 из 4Следующая ⇒
Лекция №6. ГЛАВА VI Примеры технологического оформления химических процессов. Огромное разнообразие химико-технологических процессов и их специфические особенности создают большие трудности при попытке выделить из их числа такие, которые достаточно полно отражали бы особенности всех или хотя бы большей группы химических процессов. В связи с этим в данной главе будет целесообразно рассмотреть инженерные оформление некоторых процессов неорганического синтеза, органического и нефтехимического синтеза, а также отдельные процессы получения высокомолекулярных соединений и переработки нефти. Неорганический синтез. Одним из наиболее хорошо изученных процессов неорганического синтеза является производство серной кислоты, аммиака и азотной кислоты, которые применяют в производстве самых разнообразных веществ: минеральных солей, удобрений, всевозможных органических соединений, красителей, взрывчатых веществ и т.д. Теоретические основы и отдельные технологические схемы Производство аммиака. Аммиак (NH3) является важнейшим химическим продуктом, так как он служит исходным сырьем для получения самых разнообразных азотсодержащих соединений. При непосредственном соединении аммиака с кислотами получают соли, например, нитрат или сульфат аммония. При взаимодействии аммиака с CO2 образуется карбамид (мочевина), которая является одним из лучших азотных удобрений благодаря высокой концентрации азота и хорошим физическим свойствам. Аммиак при его окислении дает окись азота и двуокись азота. Последняя является исходным веществом для получения азотной кислоты, сложных (комплексных) минеральных удобрений и самых разнообразных солей (нитратов). Аммиак представляет собой бесцветный газ с характерным резким запахом. При охлаждении до -33°С он сжижается, а при -78°С затвердевает, образуя бесцветную кристаллическую массу. Критическая температура аммиака 132,4°С, критическое давление 111,5 атм. Аммиак хорошо растворим в воде: при 20°С и атмосферном давлении в 1 л воды растворяется 700 л газообразного аммиака. Производство азотной кислоты Азотная кислота принадлежит к числу важнейших кислот и по объему производства занимает второе место после серной кислоты. Азотная кислота широко применяется в экономике: 75-80% всей производимой в стране кислоты расходуется на получение комплексных (сложных) минеральных удобрений и самых разнообразных солей (нитратов), а 10-15% - на получение взрывчатых веществ и синтетических красителей. Азотная кислота и жидкая четырехокись азота используется в качестве окислительных компонентов реактивного топлива. Большинство металлов (за исключением Pt, Rh, Ir, Au) растворяются в азотной кислоте, но на поверхности железа концентрированная азотная кислота образует плотный слой оксида железа, который защищает металл от дальнейшего разрушения.
Азотную кислоту выпускают двух видов: разбавленную 45-55% HNO3 и концентрированную 97-98,5% HNO3.
Лекция №6. ГЛАВА VI Примеры технологического оформления химических процессов. Огромное разнообразие химико-технологических процессов и их специфические особенности создают большие трудности при попытке выделить из их числа такие, которые достаточно полно отражали бы особенности всех или хотя бы большей группы химических процессов. В связи с этим в данной главе будет целесообразно рассмотреть инженерные оформление некоторых процессов неорганического синтеза, органического и нефтехимического синтеза, а также отдельные процессы получения высокомолекулярных соединений и переработки нефти. Неорганический синтез. Одним из наиболее хорошо изученных процессов неорганического синтеза является производство серной кислоты, аммиака и азотной кислоты, которые применяют в производстве самых разнообразных веществ: минеральных солей, удобрений, всевозможных органических соединений, красителей, взрывчатых веществ и т.д. Производство серной кислоты. Серная кислота принадлежит к числу сильных кислот и является самой дешевой из них. Серная кислоты удобна для использования, она не дымит, не имеет запаха, при комнатной температуре находится в жидком состоянии и в концентрированном виде не разрушает черные металлы. Этими достоинствами объясняется широкое применение серной кислоты. Безводная 100%-ная серная кислота (моногидрат) представляет собой тяжелую, маслянистую и бесцветную жидкость, которая смешивается с водой во всех соотношениях с выделением большого количества тепла. Плотность H2SO4 при 20°С равна 1,83г/см3, температура кипения 286°С, температура замерзания 10,5°С.
Химическая схема получения H 2 SO 4 включает три основных химических процесса: а) окисление пирита кислородом воздуха до сернистого ангидрида; б) окисление сернистого ангидрида в серный ангидрид на катализаторе;
в) соединение сернистого ангидрида с водой и образование серной кислоты;
Принципиальная схема производства серной кислоты из флотационного колчедана является схемой с открытой цепью, т.е. проточной, когда газ последовательно проходит все аппараты (Рис. 6.1). Операция 1 – обжиг сырья (получение сернистого ангидрида из пирита). Наряду с SO2 образуется огарок Fe2O3. Сернистый ангидрид охлаждают с использованием тепла для получения пара (операция 2), а затем освобождают от пыли (операция 3) и подвергают специальной очистке (операция 4 – газ охлаждают, промывают, сушат). Очищенный сернистый ангидрид нагревают теплом отходящих газов (операция 5) и в присутствии катализатора окисляют до серного ангидрида (операция 6). После этой операции газ охлаждают (операция 5) и направляют на выделение серного ангидрида абсорбцией 98,3%-ной серной кислотой (операция 7), при этом серный ангидрид соединяется с водой (избыток ее имеется в серной кислоте). Образующуюся H2SO4 выводят из процесса в качестве готового продукта. Рис. 6.1. Принципиальная схема производства серной кислоты контактным методом.
|
||||||
|
Последнее изменение этой страницы: 2021-05-27; просмотров: 48; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.97.189 (0.007 с.) |
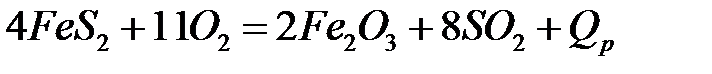 ,
,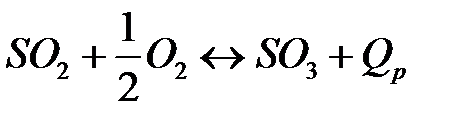 ,
,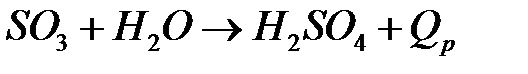 .
.


