Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Лекция№ 5. ОХТ. Массообменные процессы и аппараты.Стр 1 из 6Следующая ⇒
Лекция№ 5. ОХТ. Массообменные процессы и аппараты. Массообменные процессы и аппараты. Общие сведения. Далее Слайд№5.1: Технологические процессы, скорость протекания которых определяется скоростью переноса вещества (массы) из одной фазы в другую, называется массообменными процессами, а аппараты, предназначенные для проведения этих процессов – массообменными аппаратами. В химическое технологии массообменные процессы применяются для очистки сырья от различных примесей и выделение целевых продуктов из реакционной смеси. Массообмен представляет собой сложный процесс, включающий перенос массы в пределах одной фазы, перенос через поверхность раздела фаз и его перенос в пределах других фазы. Массопередача происходит обычно через границу раздела соприкасающихся фаз. Перенос вещества из фазы к границе раздела фаз или в обратном направлении т.е. в пределах одной из фаз называется массопередачей. Процессы массопередачи можно разделить на две группы. К первой группе – относятся процессы (абсорбция, ректификация), в которых участвуют минимально три вещества: одно образует первую фазу, другое – вторую фазу, а также представляет собой распределяемое между фазами третье вещество. Вещества, составляющие каждую из фаз, являются лишь носителями распределяемого вещества и сами не переходят из фазы в фазу. Так, например, при поглощении аммиака водой из его смеси с воздухом вода и воздух служат носителями распределяемого вещества – аммиака. Ко второй группе относятся процессы (например, ректификация), в которых вещества, составляющие две фазы, обмениваются компонентами, сами непосредственно участвуют в массопередаче и уже не могут рассматриваться как инертные носители распределяемого вещества. Процессы массопередачи можно разделить на две группы. К первой группе – относятся процессы (абсорбция, ректификация), в которых участвуют минимально три вещества: одно образует первую фазу, другое – вторую фазу, а также представляет собой распределяемое между фазами третье вещество. Ко второй группе относятся процессы (например, ректификация), в которых вещества, составляющие две фазы, обмениваются компонентами, сами непосредственно участвуют в массопередаче и уже не могут рассматриваться как инертные носители распределяемого вещества.
Слайд 5.1до, далее слайд 5.2: Абсорбция – избирательное поглощение газов и паров жидкими поглотителями – абсорбентами. Ректификация – разделение жидкой смеси на чистые или обогащенные составляющие в результате противоточного взаимодействия потоков пара и жидкости. Или
где β– коэффициент массопередачи; когда dm отнесено к единице времени, уравнение (5.2) и (5.3) принимает вид:
Или
Далее слайд 5.3: На рис. 5.1 приведены варианты выражения движущей силы диффузионных процессов.
Как видно из приведенных рисунков движущая сила меняется с изменением рабочих концентраций, поэтому для всего процесса массообмена, протекающего в пределах изменения концентраций от начальных до конечных должна быть определена средняя движущая сила ( Далее слайд 5.4: Или
могут встретиться два случая: 1. Зависимость между равновесными концентрациями не линейна; т.е. 2. Зависимость между равновесными концентрациями линейна, т.е.
С учетом средней движущей силы процесса основное уравнение массопередачи для всех поверхностей контакта фаз может быть записано в виде:
или
При определении средней движущей силы могут встретиться два случая: 1. Зависимость между равновесными концентрациями не линейна; для этого случая равновесная концентрация определяется общей функциональной зависимостью 2. Зависимость между равновесными концентрациями линейна, т.е. В аппаратуре, используемой для проведения массообменных процессов, равновесные концентрации распределяемого вещества иногда не достигается. Действительные концентрации распределяемого вещества, или рабочие концентрации, всегда отличаются от равновесных. Разность между этими концентрациями, характеризующая степень отклонения от равновесия и представляет собой движущую силу массообменного процесса.
Материальный баланс. Материальный баланс массообменных (диффузионных) процессов в общем виде может быть составлен на основе следующих рассуждений. Обозначим массовые скорости распределяющих фаз вдоль поверхности их раздела, выраженные в килограммах инертного вещества в час, через G и L, а концентрации распределяемого вещества соответственно При
Для элемента поверхности dF имеем:
Интегрируя уравнения (5.8) в пределах от начальных до конечных концентраций
Из уравнения (5.9) получим соотношения между массовыми потоками распределяющих фаз:
Интегрируя уравнение (5.8) в пределах от начальных концентраций до текущих
Откуда
или
где Аналогично для противоточного взаимодействия фаз можно получить уравнение:
Из уравнений (5.14) и (5.15) следует, что концентрации распределяемого вещества в фазах G и L связаны линейной зависимостью. Поэтому удобно процессы массообмена представлять графически в координатах Энергетический баланс. В основу энергетического баланса массообменных процессов также положен закон сохранения энергии:
Тепловой баланс составляют по данным материального баланса с учетом физических превращений, протекающих в аппарате, а также с учетом подвода или отвода тепла
где Полученное уравнение теплового баланса (5.18) может принимать различную форму в зависимости от типа массообменного процесса в связи с чем, некоторые из приведенных статей прихода (или расхода) в уравнении теплового баланса могут отсутствовать. Процессы абсорбции. В химической технологии различают физическую абсорбцию и хемосорбцию. При физической абсорбции растворение газа не сопровождается химической реакцией. При хемосорбции абсорбируемый компонент вступает в химическую реакцию в жидкой фазе. Примерами использования процессов абсорбции в технике могут служить разделение углеводородных газов на нефтеперерабатывающих установках, получение соляной кислоты, получение аммиачной воды, очистка отходящих газов с целью улавливания ценных продуктов или обезвреживание выбросов вредных (загрязняющих) веществ и др.
Процессов абсорбции. Кинетические закономерности абсорбции соответствуют общему уравнению массопередачи для диффузионных систем:
В этих уравнениях движущую силу y - yp часто заменяют на p - pp, а xp - x – на ср-с. Тогда:
где р – рабочее парциальное давление распределяемого газа в газовой смеси, Па; рр – равновесное давление газа над абсорбентом, соответствующее рабочей концентрации в жидкости, Па; с – рабочая концентрация распределяемого газа в жидкости, кмоль/м3; ср – равновесная концентрация распределяемого газа в жидкости, соответствующая рабочему парциальному давлению его в газовой смеси. При таком способе выражения концентрации уравнение для равновесной зависимости имеет вид:
а коэффициент ψ выражается в кмоль/м3·Па. Коэффициенты массопередачи в уравнениях (5.19) и (5.20) можно определить по уравнениям:
где Чем выше растворимость газа, тем больше значение величины ψ; для труднорастворимых газов ψ имеет наименьшее значение. Величина ψ влияет на структуру уравнений, описывающих коэффициент массопередачи. Если ψ велико, то в уравнении (5.21) величина Материальный баланс процесса абсорбции выражается общим уравнением:
где G – поток газовой смеси, кмоль/час инертного газа; L – поток абсорбента, кмоль/час абсорбента.
Процессы ректификации. Процессы ректификации имеют большое значение в химической технологии. В качестве примеров достаточно указать на разделение природных углеводородов нефти и синтетических углеводородов с целью получения моторных топлив, на выделение индивидуальных газов из их смесей путем предварительного сжижения и последующей ректификации жидкой смеси.
Процессы экстракции. Процессы экстракции широко используют для извлечения ценных продуктов из разбавленных растворов, а также для получения концентрационных растворов. Главное же то, что экстракцию следует рассматривать (наряду с ректификацией) как один из основных способов разделения жидких однородных смесей.
В большинстве случаев экстракцию применяют в сочетании с ректификацией. Пусть в растворителе L растворено распределяемое вещество m, и концентрация раствора (исходной смеси) незначительна. Можно подобрать второй растворитель G (экстрагент), которым можно экстрагировать распределяемое вещество m из исходного раствора и получить концентрированный раствор распределяемого вещества в растворителе G+m (экстракт) и очищенный от распределяемого вещества растворитель L (рафинат). Поскольку расход тепла на ректификацию резко уменьшается с ростом концентрации исходного вещества в разделяемой смеси, предварительное экстрагирование позволяет значительно сократить затраты тепла на разделение исходной смеси. Принципиальная схема сочетания процессов экстракции и ректификации показана на рис. 5.6.
Процессов экстракции. Кинетические закономерности процесса экстракции определяются основными законами массопередачи. Поскольку при экстракции происходит массообмен между двумя жидкими фазами, распределяемое вещество переходит из одной жидкости в другую. Для развития поверхности фазового контакта обычно одну из жидкостей диспергируют до капель определенной величины. Таким образом распределяемое вещество переходит из сплошной фазы к поверхности капли, и затем внутрь ее или из капли через поверхность раздела фаз в ядро потока сплошной фазы. Рассмотрим три случая: Случай первый – диффузионное сопротивление внутри капли незначительно по сравнению с диффузионным сопротивлением в сплошной фазе. В этом случае массообмен определяется только диффузионным сопротивлением в сплошной фазе. Коэффициент массопередачи
Коэффициент массопередачи β ’ c в свою очередь может быть рассчитан по приближенному уравнению подобия:
где Случай второй – диффузионным сопротивлением внутри капли пренебречь нельзя, в то время как диффузионное сопротивление сплошной фазы незначительно. В этом случае массообмен определяется диффузионным сопротивлением внутри капли. Коэффициент массопередачи может быть принят равным коэффициенту массопередачи (β y ≈ β g), а количество вещества, переносимого из фазы в фазу, составит:
Коэффициент массопередачи β g может быть найден по приближенному уравнению подобия:
где Случай третий – диффузионным сопротивлением в сплошной фазе и внутри капли пренебречь нельзя и необходимо учитывать распределение массы как в сплошной среде, так и внутри капли. В этом случае можно использовать для расчета коэффициентов массопередачи уравнения (5.52) и (5.54), а затем рассчитать коэффициенты массопередачи по уравнениям:
Материальный баланс экстракции выражается общими для массообменных процессов уравнениями в дифференциальной и интегральной формах (см. уравнения (5.8) – (5.16)). В случае частичной взаимной растворимости фаз L и G их величины не будут постоянными по высоте аппарата, а, следовательно, и отношение G / L будет переменной величиной. Отсюда вывод: рабочая линия экстракции в системе координат x - y при частичной взаимной растворимости фаз не будет прямой линией.
Уравнение материального баланса по общим потокам в этом случае будет иметь вид:
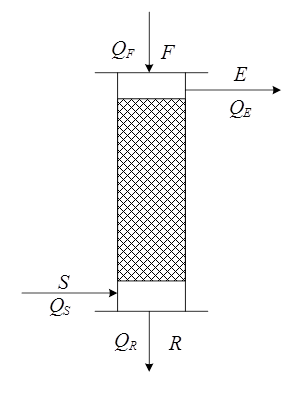
где F, R – массовые количества соответственно исходного раствора и полученного рафината, кг/час; S, E – массовые количества соответственно экстрагента и полученного экстракта, кг/час. Если переписать уравнение (5.56) в виде:
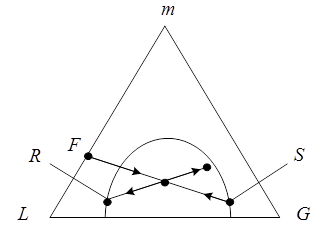
То уравнение материального баланса может быть представлено графически на треугольной диаграмме (Рис. 5.8) как процесс смешения исходных потоков F + S (с образованием тройной смеси, изображаемой точкой N, и последующим разделением этой тройной смеси N на конечные потоки R + E). Из диаграммы по правилу рычага:
можно найти количество необходимого для процесса экстрагента
или соотношение между количествами полученных потоков рафината и экстракта
а также состав любого из потоков, если заданы составы и количества трех остальных потоков.
Материальный баланс процесса экстракции является основой для составления теплового баланса, который в общем виде можно представить следующим образом:
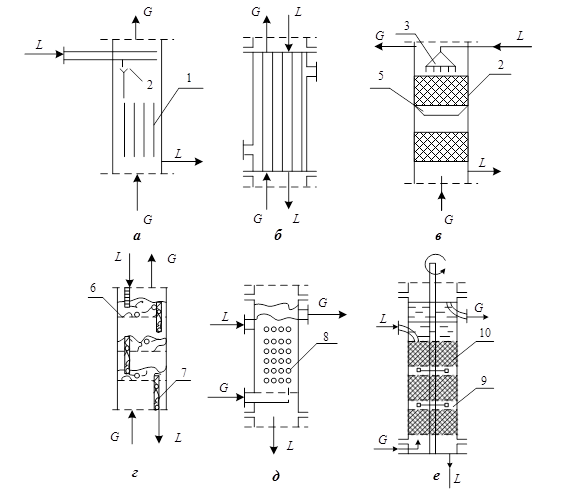
где QS, QE – тепло поступающее в экстрактор соответственно с экстрагентом и исходным раствором, кДж/час; QR, QF – тепло выходящее из экстракта с рафинатом и экстрактом, кДж/час; В каждом конкретном случае процесса экстракции уравнение (5.61) принимает свою строго определенную форму и служит для расчета энергетических затрат ( § 5 Аппаратурное оформление массообменных процессов. Аппараты, предназначенные для проведения процессов абсорбции, ректификации и экстракции, называют, соответственно, абсорберами, ректификационными колоннами и экстракторами. В зависимости от способа создания поверхности фазового контакта эти аппараты можно подразделить на три основные группы: а) аппараты, в которых поверхностью фазового контакта является поверхность жидкости, растекающейся по специальной насадке; б) аппараты, в которых поверхность фазового контакта создается потоками газа (пара) и жидкости; в) аппараты, в которых поверхность фазового контакта создается путем разбрызгивания жидкости. На рис. 5.9 представлены принципиальные схемы некоторых из аппаратов для проведения массообменных процессов абсорбции, ректификации и экстракции. На рис. 5.9 а показано контактное устройство аппарата с листовой насадкой. Контактное устройство представляет собой насадку 1 в виде вертикальных листов из твердого материала, помещенную в цилиндрическую колонну. В верхней части контактного устройства находятся распределяющие жидкость L приспособления 2, с помощью которых листовая насадка равномерно орошается с обеих сторон. Газ (пар) поступает в нижнюю часть аппарата и движется навстречу жидкости, взаимодействуя с ней. Контактное устройство трубчатого аппарата показано на рис. 5.9 б. Взаимодействующая с газом (паром) жидкость поступает в верхнюю часть контактного устройства на трубную решетку, равномерно распределяется по трубам и в виде тонкой пленки стекает по их внутренней поверхности. Газ (пар) поступает в нижнюю часть аппарата под трубную решетку, распределяется по трубам и, поднимаясь вверх, взаимодействует с жидкостью.
Рис. 5.9. Принципиальные схемы аппаратов для проведения массообменных процессов Аппараты со смоченной насадкой выполняются в виде цилиндрической колонны, заполненной насадочными телами (насадочные колонны). Схема насадочной колонны приведена на рис. 5.9 в. Основными узлами аппаратов с насадкой являются приспособления 3, распределяющие жидкость по насадке, насадочные тела 4 и устройства 5, направляющие к центру растекающуюся жидкость. Газ (пар) G и жидкость L обычно взаимодействуют в противотоке. Жидкость поступает в верхнюю часть контактного устройства, распределяется по насадочным телам при помощи приспособлений 1 и стекает вниз по поверхности последних. Газ (пар) вводится снизу и движется вверх по каналам, образованными насадочными телами. Аппараты, представленные на рис. 5.9 г снабжены горизонтальными тарелками 6 и переливными устройствами 7. Жидкость L поступает на верхнюю тарелку, переливается через переливные устройства сверху вниз и удаляется из нижней части аппарата. Газ (пар) G вводится в нижнюю часть аппарата и перемещается вверх, распределяясь на каждой тарелке в виде пузырьков или факелов. В зависимости от способа распределения газа (пара) на тарелках различают тарелки сетчатые и колпачковые. Для проведения процессов экстракции применяют полые (распылительные) экстракторы, колонные смесительно-отстойные экстракторы и ряд других. На рис. 5.9 д приведена принципиальная конструкция полого (распылительного) экстрактора. Экстрактор заполняется тяжелой жидкостью L, которая сплошным потоком перемещается в аппарате со скоростью w и удаляется через сливное устройство. Легкая жидкость G вводится в аппарат через распылитель 8 и в виде капель поднимается вверх со скоростью w д. В верхней части экстрактора капли сливаются, образуя сплошной слой легкой жидкости, которая и выводится из аппарата через верхний штуцер. В некоторых случаях для улучшения расслаивания фаз используют экстракторы (рис. 5.9 е), у которых между смесительными секциями 9 расположены отстойные зоны 10, заполненные для ускорения расслаивания потоков сеткой, насадочными телами либо блоками концентрических цилиндров. Такие колонны устанавливаются как в вертикальном, так и наклонном положении.
Вопросы и упражнения для самостоятельной Проработки материала. 1. Какие процессы относятся к массообменным? Для чего они применяются? 2. Перечислите основные группы массобменных процессов. Раскройте их сущность. 3. Дайте определение процессам абсорбции, ректификации и экстракции. 4. Как определяется скорость массообменных процессов? Поясните как определяется движущая сила процесса. 5. Как определяются коэффициенты массопередачи для газового и жидкого потоков в процессах абсорбции? 6. Приведите уравнение материального баланса для процесса абсорбции? 7. Запишите уравнение теплового баланса абсорбера. Каким уравнением определяется конечная температура жидкой фазы? 8. Объясните принцип ректификации? Приведите уравнение материального баланса. 9. Приведите уравнения линий рабочих концентраций. Поясните для чего они используются. 10. С какой целью проводят тепловые расчеты процессов ректификации? Приведите уравнение теплового баланса. 11. Охарактеризуйте три основных случая развития поверхности фазового контакта в процессах экстракции. 12. Приведите уравнение материального баланса экстракции по общим потокам. Поясните его. Лекция№ 5. ОХТ. Массообменные процессы и аппараты.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-05-27; просмотров: 1048; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.224.73.125 (0.091 с.) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
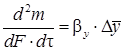 ,
,
 - движущая сила массообмена по фазе L;
- движущая сила массообмена по фазе L; 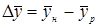 - движущая сила моссобмена по фазе G.
- движущая сила моссобмена по фазе G.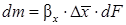
 .
.


 -равновесная и текущая концентрации вещества в фазе G;
-равновесная и текущая концентрации вещества в фазе G;  -равновесная и текущая концентрации вещества в фазе L.
-равновесная и текущая концентрации вещества в фазе L.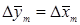 ).
). .
.
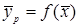 ;
;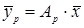 (где А – постоянная величина).
(где А – постоянная величина).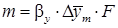
 кг/кг инертного вещества и
кг/кг инертного вещества и 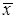 кг/кг инертного вещества.
кг/кг инертного вещества.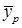 и отсутствии потерь в процессе взаимодействия фаз при параллельных потоках вдоль поверхности раздела величина
и отсутствии потерь в процессе взаимодействия фаз при параллельных потоках вдоль поверхности раздела величина 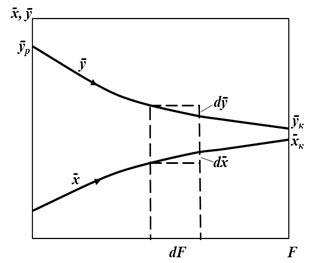

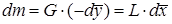 .
.
 и
и  , получим:
, получим: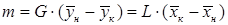 .
.
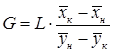 ,
,
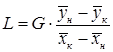 .
.
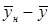 и
и 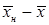 , получим:
, получим: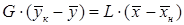 .
.

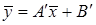 ,
,
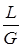 - удельный расход одной из распределяющих фаз.
- удельный расход одной из распределяющих фаз.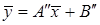 ,
,
 .
.
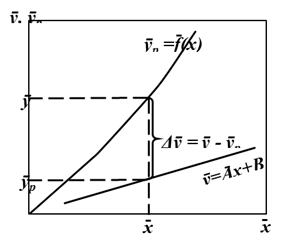
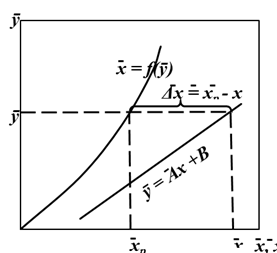
 (Рис. 5.3), т.е. в виде зависимости между так называемыми рабочими концентрациями. Уравнение прямой, выражающее зависимость между рабочими концентрациями, называют рабочей линией процесса.
(Рис. 5.3), т.е. в виде зависимости между так называемыми рабочими концентрациями. Уравнение прямой, выражающее зависимость между рабочими концентрациями, называют рабочей линией процесса.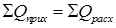 .
.
 ,
,
 - тепло вносимое в аппарат и выносимое из него с взаимодействующими фазами;
- тепло вносимое в аппарат и выносимое из него с взаимодействующими фазами; 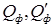 - тепло, выделяемое и поглощаемое в результате фазовых переходов;
- тепло, выделяемое и поглощаемое в результате фазовых переходов;  - тепло подводимое в аппарат и выводимое из аппарата через теплообменные устройства;
- тепло подводимое в аппарат и выводимое из аппарата через теплообменные устройства;  - тепловые потери в окружающую среду (5% от прихода).
- тепловые потери в окружающую среду (5% от прихода).
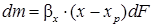 .
.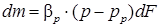 ,
,
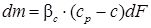 ,
,
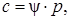
 ,
,
 ,
,
 - коэффициент массопередачи от потока газа к поверхности фазового контакта, кмоль/м2·ч·Па;
- коэффициент массопередачи от потока газа к поверхности фазового контакта, кмоль/м2·ч·Па; 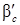 - коэффициент массопередачи от поверхности фазового контакта к потоку жидкости, м/ч.
- коэффициент массопередачи от поверхности фазового контакта к потоку жидкости, м/ч. ; тогда можно считать
; тогда можно считать 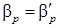 , т.е. в данном случае диффузионное сопротивление сосредоточено в газовой фазе. Если ψмало, то в уравнении (5.21)
, т.е. в данном случае диффузионное сопротивление сосредоточено в газовой фазе. Если ψмало, то в уравнении (5.21) 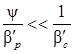 и можно полагать, что
и можно полагать, что 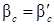 , т.е. в этом случае диффузионное сопротивление сосредоточено в жидкой фазе.
, т.е. в этом случае диффузионное сопротивление сосредоточено в жидкой фазе.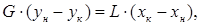
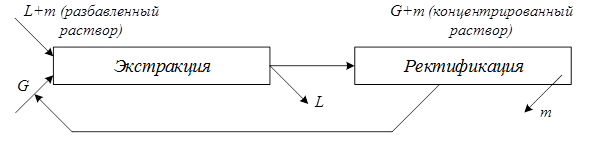 Рис. 5.6. Принципиальная схема сочетания процессов экстракции и ректификации.
Рис. 5.6. Принципиальная схема сочетания процессов экстракции и ректификации.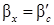 , а количество перенесенного из фазы в фазу распределяемого вещества может быть определено из соотношения:
, а количество перенесенного из фазы в фазу распределяемого вещества может быть определено из соотношения: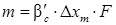 .
.
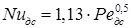 ,
,
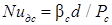 - диффузионное число Нуссельта для сплошной фазы;
- диффузионное число Нуссельта для сплошной фазы; 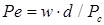 - диффузионное число Пекле для сплошной фазы; Pc – коэффициент диффузии распределяемого вещества в сплошной фазе, м2/с; d – диаметр капли, м; w – относительная скорость движения капель в сплошной фазе, м/с.
- диффузионное число Пекле для сплошной фазы; Pc – коэффициент диффузии распределяемого вещества в сплошной фазе, м2/с; d – диаметр капли, м; w – относительная скорость движения капель в сплошной фазе, м/с.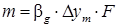 .
.
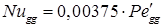 ,
,
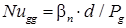 - диффузионное число Нуссельта для дисперсной фазы;
- диффузионное число Нуссельта для дисперсной фазы;  - модифицированное диффузионное число Пекле для дисперсной фазы; β g – коэффициент массопередачи по дисперсной фазе, м/с; Р g – коэффициент распределяемого вещества в дисперсной фазе, м2/с; Mg и Mc – динамический коэффициент вязкости соответственно дисперсной и сплошной фазы, Н·с/м2.
- модифицированное диффузионное число Пекле для дисперсной фазы; β g – коэффициент массопередачи по дисперсной фазе, м/с; Р g – коэффициент распределяемого вещества в дисперсной фазе, м2/с; Mg и Mc – динамический коэффициент вязкости соответственно дисперсной и сплошной фазы, Н·с/м2.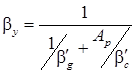 или
или 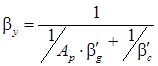 .
.
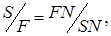
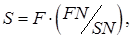
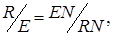
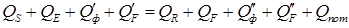 ,
,
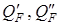 – тепло подводимое для проведения процесса экстракции или отводимое от него через, теплообменные устройства, кДж/час;
– тепло подводимое для проведения процесса экстракции или отводимое от него через, теплообменные устройства, кДж/час; 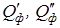 – тепло выделяемое при частичном растворении экстрагента в исходном растворе или поглощаемое в этом процессе, кДж/час; Q пот – тепловые потери в окружающую среду, кДж/час.
– тепло выделяемое при частичном растворении экстрагента в исходном растворе или поглощаемое в этом процессе, кДж/час; Q пот – тепловые потери в окружающую среду, кДж/час.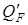 или
или 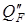 ) на проведение экстракционных процессов.
) на проведение экстракционных процессов.