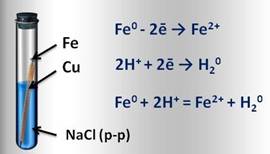Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Положение металлов в Периодической системе, особенности строения их атомов, физические свойства.Стр 1 из 7Следующая ⇒
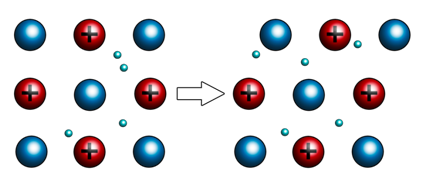
Физические свойства металлов. Для металлов характерна металлическая химическая связь. В узлах кристаллической решётки располагаются атомы и положительные ионы металлов, которые связаны благодаря обобществлению внешних электронов, которые принадлежат всему кристаллу.
Для большинства металлов характерен белый или серый цвет, только золото окрашено в желтый цвет, а медь в желто-красный.
Au Cu Во-первых, для металлов характерна пластичность, которая проявляется в их ковкости, то есть они способны изменять форму под внешним воздействием и сохранять принятую форму после прекращения этого воздействия. Из-за этого, металлы способны расплющиваться от удара или вытягиваться в проволоку. Эти свойства используют кузнецы. При этом слои смещаются относительно друг друга, но связь сохраняется благодаря «свободным» электронам.
Наиболее пластичными являются золото, серебро, медь. Например, из золота можно изготовить «золотую фольгу» толщиной 0,003 мм, которую используют для золочения изделий.
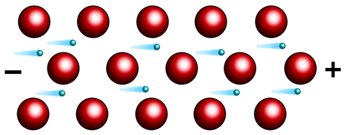
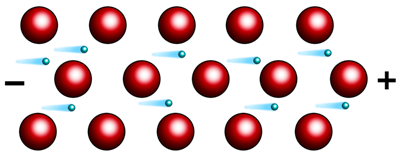
Второе свойство металлов – это электропроводность. Оно обусловлено присутствием в их кристаллических решётках подвижных электронов, которые направленно перемещаются по действием электрического поля.
При нагревании колебательные движения ионов в кристалле усиливаются, что затрудняет направленное движение электронов и ведёт к снижению электрической проводимости. А вот при охлаждении, электропроводность металлов усиливается, и близи абсолютного нуля переходят в сверхпроводимость. Наибольшую электропроводность имеют серебро и медь, а наименьшую – марганец, свинец, ртуть и вольфрам. Наличие свободных электронов в металлах объясняет и такое их свойство, как электро- и теплопроводность. Лучшими проводниками электрического тока являются: серебро, медь, золото, алюминий. Третье физическое свойство металлов – это теплопроводность, это свойство тоже связано с высокой подвижностью свободных электронов.
Четвёртое свойство – металлический блеск связано с отражение световых лучей. Металлы обладают металлическим блеском. Свет поглощается поверхностью металла, и электроны начинают испускать свое излучение, которое мы воспринимаем как металлический блеск. Палладий, ртуть, серебро и медь лучше других отражают свет.
В порошкообразном состоянии большинство металлов теряет блеск, приобретая серую или чёрную окраску, но только алюминий и магний сохраняют блеск в порошке. Из алюминия, серебра и палладия изготавливают зеркала, в том числе и те, которые используются в прожекторах.
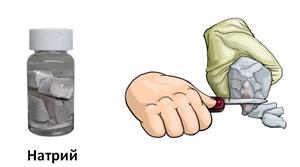
Самые твёрдые металлы – это металлы побочной подгруппы VIA группы. Например, хром по твёрдости напоминает алмаз. Наиболее твёрдыми ещё являются титан и молибден. Самые мягкие – щелочные металлы, например, натрий и калий легко режутся ножом.
По плотности различают легкие металлы, у которых плотность меньше 5 г/см3. К таким относятся щелочные и щелочноземельные металлы и алюминий. Из переходных металлов к ним относятся скандий, иттрий и титан. Они имеют большое значение в технике благодаря своей лёгкости и тугоплавкости.
Тяжелыми считаются металлы, у которых плотность больше 5 г/см3. Самым тяжелым является осмий, а самым лёгким – литий.
По температуре плавления металлы делятся на легкоплавкие, у которых эта температура меньше 1000 0С, и тугоплавкие, у которых она больше 1000 0С. Самым легкоплавким металлом является ртуть, а самым тугоплавким – вольфрам, из которого изготавливают нити накаливания для ламп. Кроме того, в конструкцию лампы входит ещё восемь металлов.
В технике металлы делятся на чёрные – это железо и его сплавы и цветные – это все остальные.
Таким образом, с серой при определённых условиях реагируют все металлы кроме золота, в результате этого взаимодействия образуются сульфиды, в которых степень окисления серы равна мину двум. В этих реакциях металлы выступают в роли восстановителей, а сера – в роли окислителя. C фтором, хлором, бромом и йодом – металлы реагируют с образованием галогенидов.
Так, в реакции алюминия с йодом образуется йодид алюминия, а катализатором в этой реакции является вода. В этой реакции алюминий также повышает свою степень окисления с 0 до +4, являясь при этом восстановителем, а йод является окислителем и понижает свою степень окисления с 0 до -1. При этом два атома алюминия отдают по три электрона молекуле йода.
Таким образом, в реакциях с галогенами, металлы являются восстановителями и повышают свою степень окисления, а сами галогены являются окислителями и понижают свою степень окисления, при этом металлы окисляются, а галогены восстанавливаются. В результате этих реакций образуются галогениды. Металлы не только реагируют с неметаллами – простыми веществами, но и вступают в реакции со сложными веществами. Например, с водой эффективно реагируют щелочные и щелочнозе-мельные металлы. Если натрий поместить в ёмкость с водой, в которую добавили несколько капель фенолфталеина, то он будет двигаться по поверхности воды, бурно реагируя с ней. При этом выделяется водород и образуется гидроксид натрия, окрашивающий фенолфталеин в малиновый цвет. Металлический натрий выступает в качестве восстановителя, он повышает свою степень окисления с 0 до +1, а ионы водорода выступают в качестве окислителя и водород понижает свою степень окисления с +1 до 0. В этой реакции два атома натрия отдают по одному электрону ионам водорода.
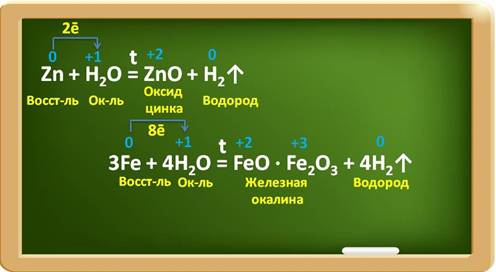
Некоторые металлы взаимодействуют с водой при определённых условиях, например, цинк – при нагревании, железо – в раскалённом виде с парами воды. При этом образуются оксиды металлов и выделяется водород. Так, в реакции с цинком образуется оксид цинка и водород. Цинк при этом, являясь восстановителем, повышает свою степень окисления с 0 до +2 и отдаёт по два электрона ионам водорода. Катионы водорода выступают в роли окислителя и понижают свою степень окисления с +1 до 0. В реакции с железом, аналогично, железо является восстановителем, повышает свою степень окисления с 0 до +2 и +3, при этом три атома железа отдают по восемь электронов ионам водорода, а ионы водорода понижают свою степень окисления с +1 до 0 и являются окислителями.
Если металл стоит в ряду активности после водорода, то он не вытесняет водород из воды ни при каких условиях.
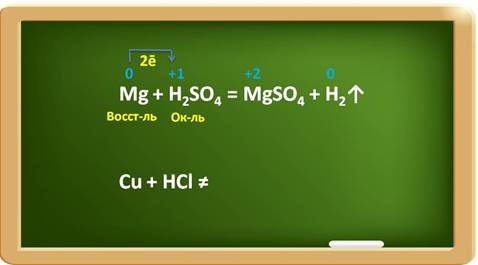
Таким образом, щелочные и щелочноземельные металлы реагируют с водой с образованием щелочей, при этом выделяется водород, некоторые металлы реагируют с водой только при нагревании, при этом образуются оксиды и выделяется водород, а металлы, стоящие в ряду активности после водорода не реагируют с водой. В этих реакциях металлы выступают в роли восстановителей, а ионы водорода – в роли окислителя. Металлы реагируют и с кислотами. Активность металлов при взаимодействии с растворами кислот зависит от положения металла в ряду активности. Металлы, стоящие в ряду активности до водорода, способны вытеснять водород из разбавленных растворов кислот.
Следует учитывать и следующее металл реагирует с кислотой: · металл должен стоять в ряду активности до водорода; · если образуется растворимая соль; · концентрированная серная и азотная кислота любой концентрации иначе реагируют с металлами, при этом водород не выделяется; · на щелочные металлы это правило не распространяется, так как они реагируют активно с водой, а речь в данном случае идёт о растворах кислот Например, в реакции магния с раствором серной кислоты, магний выступает в роли восстановителя, а ионы водорода в качестве окислителя. При этом магний повышает свою степень окисления с 0 до +2, а водород понижает свою степень окисления с +1 до 0. Каждый атом магния отдаёт по два электрона ионам водорода. Металлы, стоящие в ряду активности после водорода, к такому взаимодействию не способны: Например, медь стоит в ряду активности после водорода, поэтому она не реагирует с раствором соляной кислоты.
Если налить в две пробирки растворы кислот: в первую – раствор соляной кислоты, во вторую – раствор серной кислоты, а затем поместить в каждую по грануле цинка, то в результате у нас появляются пузырьки газа и в первой, и во второй пробирке. Значит, цинк стоит в ряду активности металлов до водорода, поэтому он способен вытеснять водород из раствора кислот. Цинк в обеих реакциях является восстановителем, он повышает свою степень окисления с 0 до +2, а водород понижает свою степень окисления с +1 до 0, при этом выступая в роли окислителя. В этих двух реакциях атом цинк отдаёт по два электрона ионам водорода.
Следует помнить, что металлы, стоящие в ряду активности до водорода, реагируют с растворами кислот, но в результате этих реакций должна образоваться растворимая соль, на щелочные металлы эти правила не распространяются, концентрированная серная и азотная кислота любой концентрации иначе реагируют с металлами. Металлы реагируют с растворами солей, при этом нужно также использовать ряд активности металлов: более активный металл способен вытеснять другой металл из раствора соли, однако при этом должна образоваться растворимая соль и щелочные металлы брать нельзя, потому что они реагируют с водой, а реакции эти протекают в растворе.
Если в две пробирки налить раствора сульфата меди (II) и поместить в первую кусочек железа, а во вторую гранулу цинка, то реакция будет у нас идти в двух пробирках. На кусочке железа и грануле цинка оседает медь и раствор сульфата (II) изменяет свою окраску: в первой пробирке – на жёлтую, во второй – с голубой на более светлую. В этой реакции железо выступает в роли восстановителя, само при этом окисляясь. Атомы железа превращаются в ионы железа. Ионы меди выступают в роли окислителя, они восстанавливаются, превращаясь в атомы меди. В результате окислительно-восстановительной реакции электроны от атомов железа переходят к ионам меди. Во второй реакции, в роли восстановителя выступает цинк, сам он окисляется, атомы цинка превращаются в ионы цинка, ионы меди выступают в роли окислителя, ионы меди восстанавливаются и превращаются в атомы меди, электроны от атомов цинка переходят к ионам меди.
Следовательно, металлы реагируют и с растворами кислот, но нужно помнить, что каждый металл вытесняет из раствора соли другой металл, стоящий правее него в ряду напряжений металлов, при этом должна образоваться растворимая соль и щелочные металлы брать нельзя, так как они реагируют с водой.
Конвертер Для получения некоторых металлов в качестве восстановителя используют водород. WO3 + 3H2 = W + 3H2O
В роли восстановителей можно также использовать более активные металлы, способные вытеснять другие металлы из их оксидов и солей. Этот способ получения металлов называется металлотермией. Если используют алюминий, то говорят об алюминотермии: Fe2O3 + 2Al = 2Fe + Al2O3
Восстановление железа методом алюминотермии до сих пор применяется при сварке рельсов.
Гидрометаллургия – это методы получения металлов, основанные на химических реакциях, происходящих в растворе. Гидрометаллургические процессы включают стадию перевода нерастворимых соединений металлов из руд в растворы, с последующим восстановительным выделением металлов из полученных растворов с помощью других металлов или электрического тока. Электрометаллургия – методы получения металлов, основанные на электролизе, т.е. выделение металлов из растворов или расплавов их соединений с помощью постоянного электрического тока. Этот метод применяют для получения активных металлов – щелочных и щелочноземельных, алюминия, также для получения легированных сталей. С помощью этого метода, английский химик Г. Дэви впервые получил калий, натрий, барий и кальций.
Большое значение имеет микробиологический метод получения металлов. В этом методе используется жизнедеятельность некоторых бактерий. Так, тионовые бактерии способны переводить нерастворимые сульфиды в растворимые сульфаты. Бактериальный метод применяют для извлечения меди из её сульфидных руд. А затем полученный раствор сульфата меди (II) подаётся на гидрометаллургическую переработку. Кроме этого, учёные обнаружили, что некоторые микроводоросли и бактерии накапливают на своей поверхности отдельные металлы (например, золото) или их оксиды. Микроорганизм постепенно обрастает «шубой» из минеральных частиц, увеличивается в размерах в десятки раз, что позволяет легко выделить частицы из раствора.
При промышленном производстве металлов большое значение имеют вопросы охраны окружающей среды от загрязнений отходами производства. Охрана окружающей среды предусматривает, прежде всего, дезактивацию выбросов, например отходящих газов при выплавке чугуна. Здесь главную опасность представляет образующийся при переработке сернистых руд оксид серы (IV), который, попадая в атмосферу, может вызывать «кислотные дожди». Наряду с комплексным использованием сырья, строительством очистных сооружений, устройством замкнутых циклов водопользования с целью охраны окружающей среды необходимы вывод промышленных предприятий за городскую черту, создание лесозащитных вокруг городов и промышленных центров. Таким образом, металлы встречаются в природе в виде соединений или в самородном состоянии. В земной коре металлы чаще всего встречаются в виде соединений: оксидов, силикатов, карбонатов, сульфидов, хлоридов. Эти соединения входят в состав руд и минералов. Для получения металлов из руд руду сначала измельчают, обогащают, переводят в оксид и только после этого восстанавливают металл. В качестве восстановителей используют C, CO, H2, Si или более активные металлы. Металлургия занимается получением металлов и их сплавов из руд. В зависимости от метода получения металла из руды существует несколько видов металлургических производств: пирометаллургия, гидрометаллургия и электрометаллургия.
Коррозия металлов. Сплавы Поэт В. Шефнер писал: «Коррозия – рыжая крыса, грызёт металлический лом». А также есть народную мудрость: «Ржа ест железо». Слово коррозия (от лат. сorrosio –разъедание) – это самопроизвольное разрушение металлов и сплавов под влиянием окружающей среды.
Каждый год из-за коррозии теряется около четверти всего произведённого в мире железа. Порча изделий из металла и потеря металлов обходится очень дорого. Затраты на ремонт или замену изделий во много раз превышают стоимость того металла, из которого они изготовлены. Коррозия вызывает и серьёзные экологические последствия. Если происходит разрушение трубопроводов газа или нефти, то это приводит к загрязнению окружающей среды, а это негативно сказывается на здоровье людей.
Коррозию металлов и сплавов вызывают такие компоненты окружающей среды, как вода, кислород, оксиды углерода и серы, содержащиеся в воздухе, водные растворы солей (морская вода, грунтовые воды).
Различают коррозию: · химическую · электрохимическую При химической коррозии металл разрушается под действием окислителей – неэлектролитов, например газов (кислорода, хлора и др.) при повышенной или даже обычной температурах. 2Fe + 3Cl2 = 2FeCl3 При электрохимической коррозии разрушение металлов происходит в растворах электролитов. Это значит, что в окружающей среде, где находится металл, должны быть вода и окислители: кислород, растворённые кислоты, соли. Так, под действием воздуха и содержащихся в нём паров воды на поверхности медных и бронзовых изделий образуется зелёная плёнка, называемая патиной. 2Cu + O2 + CO2 + H2O = (CuOH)2CO3
Но чаще всего коррозии подвергаются изделия из железа. Особенно сильно коррозирует металл во влажном воздухе и при соприкосновении с водой. Процесс коррозии железа часто называют ржавлением. Автомобили, сельскохозяйственные машины, стальные балки, кухонная посуда – все эти изделия, будучи новыми, имеют гладкую, блестящую поверхность. Но при хранении во влажной атмосфере и при недостаточном уходе, они покрываются бурыми пятнами ржавчины, состав которой можно выразить обобщённой формулой Fe2O3 · nH2O.
При коррозии металлов и сплавов протекают окислительно-восстановительные реакции, в результате которых атомы металла, взаимодействуя с компонентами окружающей среды, окисляются, а сам окислитель восстанавливается. При этом металл из свободного состояния переходит в химические соединения – оксиды, сульфиды, гидроксиды. 4Fe + 3O2 + 6H2O = 4Fe(OH)3 Химически чистое железо почти не подвержено коррозии, а техническое железо, которое содержит различные примеси, ржавеет. Следовательно, одной из причин коррозии является наличие примесей в металле.
Возле города Дели в Индии находится железная колонна с очень маленькими пятнышками ржавчины, хотя её возраст почти 1700 лет. Это знаменитая Кутубская колонна высотой около семь м и массой шесть с половиной т. Согласно одной из гипотез, долговечность и коррозионная устойчивость колонны объясняются очень малым количеством различных примесей в железе и относительно невысокой влажностью, характерной для этой местности.
Например, если два различных металла, которые находятся в контакте между собой, опустить в водный раствор электролита (это могут быть грунтовые воды, сконденсированная влага из атмосферы), то металл более активный, расположенный в электрохимическом ряду напряжений левее, будет разрушаться, и тем самым предохранять менее активный металл от коррозии. Например, при контакте железа с медью в водной среде, железо, как более активный металл, постепенно коррозирует, переходя в воду в виде ионов железа. Таким образом, коррозия металла резко усиливается при соприкосновении его с менее активным металлом.
Образовавшиеся свободные электроны от атомов железа, перейдут к меди и на её поверхности соединяться с ионами водорода, которые образуются из компонентов водной среды (например, серной или других кислот). Этот электрохимический процесс можно представить так:
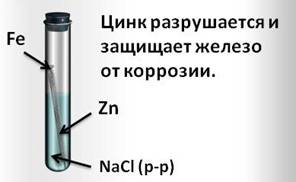
И, наоборот, при контакте железа с более активным цинком, цинк разрушается и защищает железо от коррозии.
Сплавы. Окружающие нас металлические предметы редко состоят из чистых металлов. Только алюминиевые кастрюли или медная проволока имеют чистоту около 99%. В большинстве же других случаев люди имеют дело со сплавами.
В расплавленном состоянии металлы обычно смешиваются между собой, образуя однородную жидкость – расплав. Большинство металлов, например олово и свинец, золото и серебро, цинк и медь, могут смешиваться в каком угодно соотношении. При застывании этого однородного расплава получают твёрдую массу, которую называют сплавом.
Физические свойства сплавов отличаются от свойств составляющих их металлов. Например, сплав меди и цинка – латунь – значительно твёрже, чем отдельно взятые металлы, а прочность бронзы выше, чем у составляющих её меди и олова, сталь и чугун прочнее технически чистого железа. К серебру или золоту, которые в чистом виде очень мягки, для придания им твёрдости добавляют медь, хотя она в чистом виде также значительно мягче полученного сплава.
Поэтому в чистом виде металлы используют редко. Значительно чаще применяют их сплавы. Из различных металлов получены десятки тысяч различных сплавов. Интересно, что для производства золотых изделий используют сплавы золота с медью. В зависимости от массовой доли в них золота различают пробы: 960, то есть это означает, что на 960 массовых частей золота приходится 40 массовых частей меди – это высшая проба, 920 проба – это ювелирный металл, 880 – 750 – монетный сплав, 750 – 375 – сплав для ювелирных изделий, а 360 – сплав для корпусных часов. Проба золота может быть выражена в каратах. В этом случае она показывает, сколько каратов (один карат = 0,2 г) чистого золота содержится в двадцать четыре каратах сплава. Проба при этом выражается числами 22, 18 и 14. Само слово «карат» происходит от названия зёрен субтропического дерева, которые использовали для взвешивания золота и драгоценных камней.
Существует сплав никеля с титаном, обладающий одним, почти фантастическим, свойством – своего рода памятью. Если куску проволоки из этого сплава в нагретом состоянии придать определённую форму, охладить, а потом как угодно смять или согнуть, то при повторном нагревании до некоторой минимальной температуры он снова примет ту форму, какую имел после горячей деформации.
Температура плавления большинства сплавов ниже температуры плавления наиболее легкоплавкого из металлов, образующих сплав. Например, температура плавления сплава олова и свинца, равна 180 0С, с температурами плавления чистых металлов, образующих сплав, соответственно 232 и 328 0С.
Комбинируя различные металлы в разнообразных количественных соотношениях, можно получить большое число сплавов с важными техническими свойствами: · лёгкие; · кислотоустойчивые; · сверхтвёрдые; · коррозионно-стойкие. Так, чистая медь очень плохо поддаётся литью, из неё трудно получить отливки. И в тоже время оловянная бронза – сплав меди и олова – имеет прекрасные литейные свойства: из неё отливают художественные изделия, требующие тонкой проработки деталей. Чистый алюминий – очень мягкий металл, сравнительно непрочный на разрыв. Но сплав, состоящий из алюминия, магния, марганца, меди и никеля, называемый дюралюминием, в четыре раза прочнее алюминия на разрыв.
А если скомбинировать металлы в различных соотношениях друг с другом, а также с некоторыми неметаллами, то можно получить большое число сплавов. Физические свойства сплавов отличаются от свойств составляющих их металлов. Чугун и сталь – наиболее распространённые сплавы железа, то есть чёрные сплавы, а к цветным сплавам относятся бронза, латунь, мельхиор, дюралюминий, припой, монель-металл.
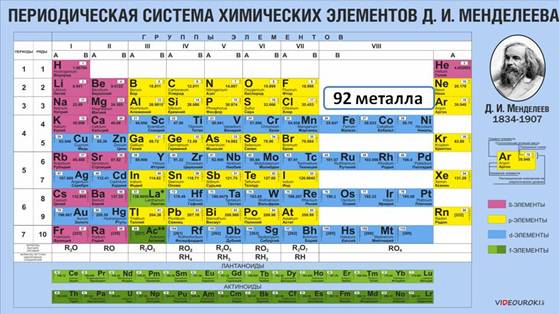
Положение металлов в Периодической системе, особенности строения их атомов, физические свойства. Большинство химических элементов в Периодической системе относится к металлам, они располагаются по диагонали от бора к астату. К металлам относятся девяноста два химических элемента.
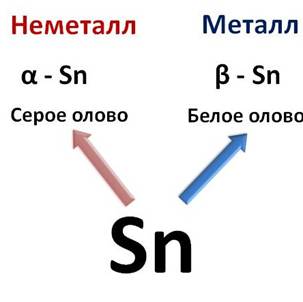
Каждый период (кроме первого) начинается металлом. Так, металлы IA группы называются щелочными металлами. К ним относятся: Li, Na, K, Rb, Cs, Fr. Своё название они получили благодаря соответствующим гидроксидам, которые называются щелочами, т.е. растворимыми в воде основаниями. Щелочные металлы имеют на внешнем энергетическом уровне только один электрон, который они легко отдают, при этом проявляют восстановительные свойства. Ме0 – ē → Ме+ Причём восстановительные свойства в этой группе увеличиваются от лития к францию, как и радиусы атомов, поэтому растёт и способность к отдаче внешнего электрона. Химическая активность щелочных металлов по группе сверху вниз тоже увеличивается. Металлы IIA группы также являются типичными металлами и сильными восстановителями, так как в реакциях они отдают два своих электрона. Ме0 – 2ē → Ме2+ Кальций, стронций и барий называют щелочноземельными элементами, потому что их оксиды, которые раньше называли «землями» при растворении в воде образуют щёлочи. К металлам относятся и элементы IIIA группы кроме бора. У этих металлов на внешнем энергетическом уровне находится три электрона, которые они отдают и превращаются в ионы. Ме0 – 3ē → Ме3+ В IVA группе к металлам относятся германий, олово, свинец, в VA группе металлами являются сурьма и висмут, в VIA группе – полони й, а в VIIA и VIIIA группе все элементы являются неметаллами. Элементы побочных подгрупп все являются металлами. Их отличительной особенностью является то, что на внешнем уровне у них обычно содержится один или два электрона, остальные валентные электроны располагаются на предвнешнем слое. К металлам относятся и лантаниды, и актиниды, которые обычно располагаются ниже основной таблицы. Запомните: · у металлов сравнительно большие радиусы атомов; · их внешние электроны значительно удалены от ядра и слабо с ним связаны; · атомы металлов содержат на внешнем уровне от одного до трех электронов; · легко отдают электроны, превращаясь при этом в положительные ионы; · являются восстановителями; · металлы не могут присоединять электроны. Однако деление элементов на металлы и неметаллы условно. Например, аллотропные модификации олова: так серое, или α-олово – неметалл, а белое, или β-олово – металл.
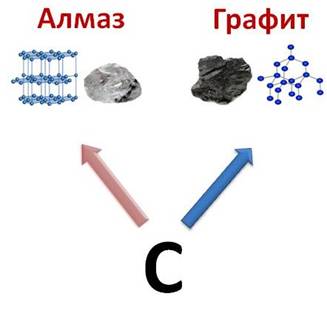
Такая модификация углерода, как алмаз – это неметалл, а графит имеет некоторые характерные свойства металлов.
Такие металлы, как цинк, хром, алюминий и другие – типичные металлы, но образуют оксиды и гидроксиды амфотерного характера. А теллур и йод – типичные неметаллы, но обладают некоторыми свойствами, характерными для металлов.
|
|||||||||
|
Последнее изменение этой страницы: 2021-04-20; просмотров: 200; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.142.196.27 (0.134 с.) |
















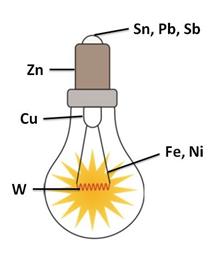
 Ряд государств, приняло решение о замене привычных ламп накаливания на более экономичные и долговечные современные лампы, например, галогенные, люминесцентные и светодиодные. Галогенная лампа – это тоже лампа накаливания с вольфрамовой нитью, заполненная инертными газами с добавкой паров галогенов (брома или йода).
Ряд государств, приняло решение о замене привычных ламп накаливания на более экономичные и долговечные современные лампы, например, галогенные, люминесцентные и светодиодные. Галогенная лампа – это тоже лампа накаливания с вольфрамовой нитью, заполненная инертными газами с добавкой паров галогенов (брома или йода). Люминесцентные лампы – это лампы дневного света, но они содержат ртуть, поэтому нуждаются в особом способе утилизации.
Люминесцентные лампы – это лампы дневного света, но они содержат ртуть, поэтому нуждаются в особом способе утилизации. Светодиодные лампы – самые экономичные и долговечные (срок работы до 100 тыс. ч), но и самые дорогие из ламп.
Светодиодные лампы – самые экономичные и долговечные (срок работы до 100 тыс. ч), но и самые дорогие из ламп.