
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Устойчивость атома как физической системы.
Спектры излучения и поглощения атомов и молекул. Дискретность (иначе – прерывистость) некоторых физических характеристик атомов и молекул. 1. В начале ХХ в. считалось, что атом имеет «планетарную» структуру – заряженное ядро и движущиеся вокруг него по орбитам электроны. В классической физике движение по орбите – это движение с ускорением (центростремительным). Известно, что заряженная частица, т.е. электрон, движущаяся с ускорением, излучает электромагнитные волны и, следовательно, теряет энергию. Итог – падение электрона на ядро. По оценкам этот процесс реализуется за время 2.В процессе падения на ядро по законам классической физики электрон должен непрерывно излучать энергию. Следовательно, спектр излучения атома должен быть непрерывным. Однако из эксперимента известно, что у атомов спектры линейчатые. Пример – атом водорода. У него положение линий в спектре испускания (и поглощения) электромагнитного излучения описывается «обобщенной формулой Бальмера»:
Здесь m принимает значения 1, 2, 3, …, при заданном m n =m +1, m +2, m +3 …; λ – длина волны излучения, а индексы внизу указывают, к какой серии относится линия в спектре: m =1 и n =2, 3, 4, … - серия Лаймена, m =2 и n =3, 4, 5, … - серия Бальмера и т.д.; наконец, R =1.097 ۰ 107 м -1 – постоянная Ридберга
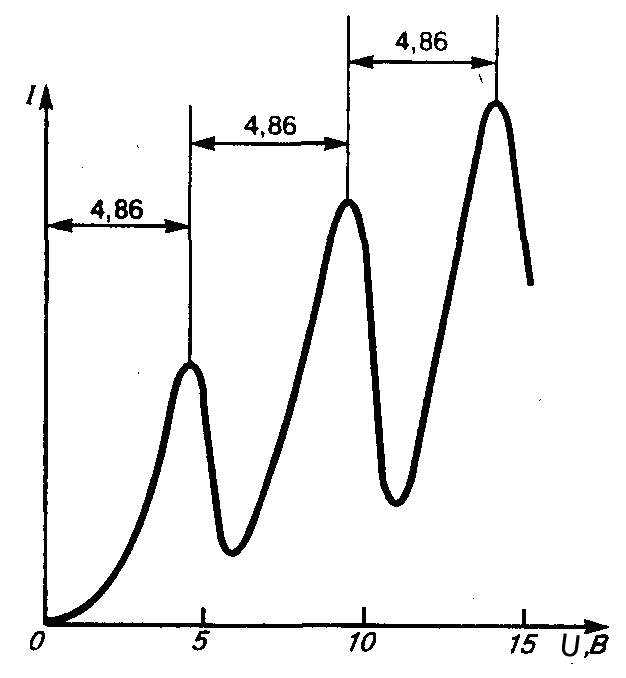
Экспериментально было показано, что некоторые физические характеристики атомов являются дискретными. Так, в опытах Франка-Герца была доказана дискретность величины энергии, которую могут принимать атомы ртути при столкновениях с электронами. В экспериментах Штерна-Герлаха была продемонстрирована дискретность проекции момента количества движения атома на заданное направление, т.е. пространственное квантование у атомов.
Вольтамперная характеристика
Если атом обладает магнитным моментом
Расщеплялся на отдельные линии. Впервые квантовые идеи попытался использовать Нильс Бор, разрабатывая теорию атома водорода.
Н. Бору удалось получить правильный спектр для атома водорода – уровни энергии электрона и обобщенную формулу Бальмера. Недостатки теории. Непоследовательность – наряду с квантовыми использовались и классические представления.
|
|||||
|
Последнее изменение этой страницы: 2021-04-05; просмотров: 83; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.222.83.185 (0.008 с.) |
 с. Это и будет примерное время существования атома как физической системы из ядра и электронов. Однако из эксперимента известно, что атом – устойчивая система!
с. Это и будет примерное время существования атома как физической системы из ядра и электронов. Однако из эксперимента известно, что атом – устойчивая система!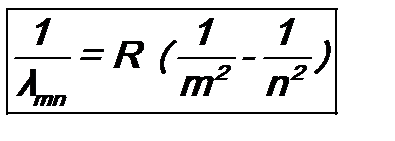 .
.


 , то в магнитном поле
, то в магнитном поле  он приобретает дополнительную энергию
он приобретает дополнительную энергию  , где θ – угол между векторами
, где θ – угол между векторами  , которая будет в магнитном поле действовать на атом, равна
, которая будет в магнитном поле действовать на атом, равна , т.е. изменяться в пределах
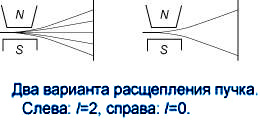
, т.е. изменяться в пределах  . Пучок атомов должен будет равномерно размываться. Однако он
. Пучок атомов должен будет равномерно размываться. Однако он



