
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Качественные реакции алифатических углеводородовСтр 1 из 5Следующая ⇒
УЧЕБНОЕ ПОСОБИЕ ПО ОРГАНИЧЕСКОЙ ХИМИИ «КАЧЕСТВЕННЫЕ РЕАКЦИИ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ» для студентов очной и очно - заочной форм обучения (базовый уровень)
Екатеринбург 2017 г. Учебное пособие для студентов по дисциплине «Органическая химия» / сост. преподаватель химии Т.В. Главатских – Екатеринбург; Фармацевтический филиал ГБПОУ «СОМК», 2017 г. – 50 стр.
Рецензент: А.И. Серебрякова, кандидат химических наук, преподаватель высшей квалификационной категории Медицинского колледжа ФГБОУ ВП УрГУПС
Учебное пособие по теме «Качественные реакции органических соединений» составлено в соответствии с действующей программой по органической химии. Пособие должно сформировать у студентов целостное представление об анализе органических соединений. Пособие знакомит студентов с качественными реакциями органических соединений, химическими формулами лекарственных соединений и их применением в медицине. Материал тесно взаимосвязан с профессиональной направленностью: 95% лекарственных препаратов – вещества органической природы. Органические соединения используют для изготовления протезов различных органов, изделий медицинской техники, в стоматологии. Екатеринбург: Фармацевтический филиал ГБПОУ «СОМК»
Учебное пособие утверждено на заседании ЦМК химии (№3 протокола от «06» октября 2017г.)
Рассмотрено и одобрено на заседании методического совета Фармацевтического филиала ГБПОУ «СОМК» (протокол № 4 от «» октября?? 20 17 г.)
Рассмотрено и одобрено на заседании ЦМС колледжа (протокол № ___ от «__» _________ 2017 года)
Председатель ЦМС О.В. Ледянкина, к. фарм. наук
СОДЕРЖАНИЕ
КАЧЕСТВЕННЫЕ РЕАКЦИИ АЛИФАТИЧЕСКИХ УГЛЕВОДОРОДОВ АЛКАНЫ
Алканы не окисляются перманганатом калия на холоде, вследствие этого раствор не будет изменять окраску. Предельные углеводороды в обычных условиях химически инертны: они не взаимодействуют с концентрированными серной и азотной кислотами, не окисляются сильными окислителями, такими как, перманганат калия, дихромат калия и др. Этим свойством алканов пользуются в фармации, когда необходимо открыть примеси, например, в вазелиновом масле: 1) при прибавлении к испытуемому маслу раствора перманганата калия в сернокислой среде при комнатной температуре розовая окраска не исчезает; или 2) при добавлении к испытуемому маслу бромной воды при комнатной температуре желто-бурая окраска не исчезает, то это служит признаком отсутствия в вазелиновом масле примесей. Применение алканов в медицине. - бутан (С4Н10) используют для заполнения аэрозольных упаковок лекарств; - вазелин (С5Н12 – С25Н52) и парафин (С19 –С35) являются основой для мазей; - вазелиновое масло (С5Н12 – С15Н32) применяется в составе комбинированных лекарственных средств, как смягчающее средство; как мазевая основа. - парафин применяются для лечения теплом при невралгиях, невритах, артритах, артрозах и т.д.
АЛКЕНЫ И АЛКИНЫ
Для непредельных связей характерны реакции электрофильного присоединения, такие реакции являются качественными для обнаружения двойных и тройных связей.
СН2 = СН2 + Вг2 --- > СН2 – СН2 | | Вг Вг этилен 1,2 -дибромэтан
Вг Вг + Вг2 | | СН ≡ СН + Вг2 à СН=СН à СН - СН | | | | Вг Вг Вг Вг ацетилен 1,2 -дибромэтилен 1,1,2,2- тетрабромэтан
Бурая окраска брома быстро исчезает, присоединение брома идет легко, при комнатной температуре. При окислении алкенов раствором перманганата калия в нейтральной или слабощелочной среде происходит разрыв π - связи и присоединение гидроксильной группы к каждому атому углерода, т.е. реакция гидроксилирования. В результате получаются двухатомные спирты (гликоли). Эта реакция носит имя открывшего ее русского химика Е.Е.Вагнера (1888), она используется как качественная реакция для обнаружения двойной связи. В результате этой реакции окрашенный раствор перманганата калия быстро обесцвечивается и выпадает бурый осадок оксида марганца (IV). 3СН2=СН2 + 2КмпО4 +4Н2О ----- > 3СН2 – СН2 +2КОН +2МпО2↓ | | ОН ОН этилен этандиол-1,2 (этиленгликоль)
Мп+7 +3е ----> Мп+4 2 окислитель 2С-2 - 2е ----> 2С- 3 восстановитель Алкины легко окисляются различными окислителями, в частности перманганатом калия. При этом раствор перманганата калия обесцвечивается, что служит указанием на наличие тройной связи. Ацетилен окисляется раствором калия перманганата в нейтральной среде до щавелевой кислоты. 3С2Н2 + 8КмпО4 +4Н2О ---- > 3Н2С2О4 + 8МпО2 ↓+ 8КОН ацетилен щавелевая кислота
Мп+7 + 3е ---- Мп+4 8 окислитель 2С- - 8е ---- 2С+3 3 восстановитель
Реакция отличия алкинов, имеющих концевую тройную связь НС ≡, от алкенов и алканов – образование соли, называемые ацетиленидами. Ацетилениды серебра и меди (+1) легко образуются и выпадают в осадок при пропускании ацетилена через аммиачный раствор оксида серебра или хлорида меди (+1). NH3 НС ≡ СН + А g 2 О ----- > А g - С º С - А g ↓ + Н2О ацетилен ацетиленид серебра
NH3 СН3- С º СН + СиС1 ----- > СН3- С º С - Си + НС1 пропин метилацетиленид меди (+1)
Ацетилениды серебра и меди как соли очень слабых кислот легко разлагаются при действии сильной минеральной кислоты с выделением исходного алкина.
Из алкенов получают полимерные массы, из которых в производстве изготавливают медицинскую технику, вспомогательный материал (шприцы, системы для переливания крови, шовный материал и т.д.), полимерные пломбы для стоматологии и др. Введение в формулу лекарственного препарата двойной связи усиливает биологическое действие препарата на организм. Например, гексенал активнее действует на организм, чем фенобарбитал: гексенал фенобарбитал Ацетилен используется при получении таких химических веществ, как уксусная кислота, ароматические углеводороды, этиловый спирт; обладает наркотическими свойствами.
Пирогаллол Фенол (карболовая кислота) обладает сильной бактерицидной активностью; фенол входит в состав препарата «Фукорцин» - антигрибковое средство.
Трикрезол – смесь орто -, мета -, пара – крезолов, используют как дезинфицирующее средство и консервант инъекционных растворов. Многоатомные фенолы являются биогенными соединениями.
Резорцин (1,3 – дигидроксибензол) является составной частью смолы хвойных деревьев; относится к группе антисептических средств, обладает выраженным противомикробным эффектом, а также оказывает дерматопротекторное и противосеборейное действие. Основное применение резорцин имеет как дезинфицирующее средство при лечении кожных заболеваний. Пирокатехин (1,2 – дигидроксибензол) в природе находится преимущественно в виде сложных производных в диком винограде, в древесине деревьев, выделяющих камедь. Пирокатехин найден в листьях эфедры, чешуе лука, плодах грейпфрута и др.
Наиболее распространен гидрохинон (1,4-дигидроксибензол), его гликозид - арбутин содержится в листьях толокнянки, брусники, бадана и др.
Тимол применяют как сырьё в производстве ментола и некоторых индикаторов, например тимолфталеина; в медицине — как противоглистное средство при лечении анкилостомидоза, трихоцефалёза и некоторых др. гельминтозов; в качестве антисептического средства для дезинфекции полости рта, зева, носоглотки; в стоматологической практике — для обезболивания дентина; в фармацевтической промышленности — в качестве консерванта. Танины представляют собой полифенолы:
Танины (водорастворимые полифенолы) - содержатся в коре, древесине, листьях, плодах многих растений: дуба, ели, лиственницы, эвкалипта, чая и других. Танины придают листьям и плодам терпкий вяжущий вкус. Танины подавляют рост патогенных для многих растений микроорганизмов, защищают растения от поедания животными. В медицине танин находит применение как вяжущее лекарственное средство, противоядие (при отравлении солями свинца, ртути и др.), противодиарейное, кровоостанавливающее и противогеморроидальное средство. Также используются хирургами для дубления кожи рук перед выполнением операции.
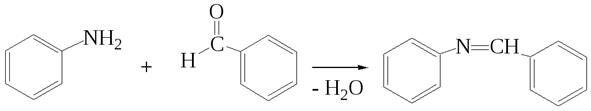
Ароматические амины, как и алифатические, при взаимодействии с альдегидами или кетонами образуют основания Шиффа – окрашенные соединения.
основание Шиффа
Для качественного анализа используют свойство анилина и его производных образовывать азокрасители. При действии соли азотистой кислоты – нитрит натрия, на анилин образуется диазосоединение (реакция диазотирования) с последующим азосочетанием с фенолом в щелочной среде или первичным ароматическим амином в кислой среде.
азосоединение (азокраситель)
Амины являются биогенными соединениями, аминогруппа содержится в аминокислотах, сульфаниламидных препаратах. СПИРТЫ Для спиртов характерна реакция этерификации – взаимодействие с карбоновыми кислотами (качественная реакция на спиртовый гидроксил):
Н2 S О4 конц.,Т* С2Н5ОН + СН3- СООН -------------------- > СН3 – СО-ОС2Н5 + Н2О этанол уксусная этиловый эфир кислота уксусной кислоты (фруктовый запах)
В результате реакции этерификации образуются сложные эфиры, которые имеют приятный запах фруктов Первичные спирты окисляются в альдегиды, вторичные спирты окисляются в кетоны, третичные спирты более устойчивы к окислению. Окисление спиртов обычно проводят сильными окислителями. Этанол окисляют раствором дихромата калия (К2Сг2О7) в сернокислой среде, при нагревании ощущается запах уксусного альдегида (запах свежих яблок): Т 3 С2Н5ОН + К2Сг2О7 +4Н2 S О4 ---- > 3 СН3 – С (О) Н + Сг2(S О4)3 + К2 S О4 + 7Н2О 2Сг+6 + 6е ----> 2 Сг+3 1 окислитель С- - 2е ---- > С+ 3 восстановитель
Подлинность этилового спирта устанавливают по реакции образования йодоформа (желтый осадок и характерный запах) – йодоформная проба.
С2Н5ОН + 4 I 2 + 6 N аОН ---- > СН I 3 ↓+ 5 N а I + Н-СОО N а + 5Н2О I2 + 2е ---> 2I- 4 окислитель 2С-2 – 8е ---> 2 С+2 1 восстановитель
Многоатомные спирты при взаимодействии со свежеприготовленным раствором гидроксида меди (+2) в щелочной среде образуют комплексное соединение синего цвета. Этой реакцией часто пользуются для качественного обнаружения соединений, имеющих в молекуле диольный фрагмент (глицерин, глюкоза, фруктоза, винная кислота и др.) - СН(ОН)СН(ОН)-.
раствор ярко – синего цвета
Это реакция отличия многоатомных спиртов от одноатомных спиртов. Этиловый спирт (этанол, С2Н5ОН) в зависимости от концентрации применяют по-разному: 96,6% - для лабораторных целей; 95% - для приготовления спиртовых растворов, настоек, экстрактов; 70% - для обработки инъекционного поля, в любой концентрации - для компрессов. Глицерин (пропантриол – 1,1,1) применяют в качестве растворителя (раствор Люголя), наружно для смягчения кожи, в промышленности для получения нитроглицерина. Многие лекарственные препараты содержат спиртовый гидроксил в своем составе: глюкоза, адреналин, эфедрин, ментол, терпингидрат и т.д.
ПРОСТЫЕ ЭФИРЫ
Способность простых эфиров к окислению необходимо учитывать при работе с этими веществами, т.к. некоторые из них, например, диэтиловый эфир, используются в фармацевтической и медицинской практике. Эфир окисляется кислородом воздуха в пероксид. Учитывая взрывоопасность пероксидов и гидропероксидов, необходимо при работе с простыми эфирами всегда проверять их на наличие пероксидных соединений. Проба на наличие пероксидных соединений проводится с раствором йодида калия (КI) в сернокислой среде. Если в эфире содержатся пероксидные соединения, то они окисляют йодид калия до свободного йода (I2), окрашивающего раствор в бурый цвет. Образование небольших количеств йода можно легко обнаружить, добавляя в пробу раствор крахмала, который дает при взаимодействии с йодом синее окрашивание. Наиболее характерной для дифенгидрамина гидрохлорида (димедрола) является реакция образования окрашенной оксониевой соли с концентрированной серной кислотой (образуется окрашивание от ярко-желтого до желто-бурого). При добавлении воды окраска исчезает, что связано с разложением этой соли.
дифенгидрамин
дифенгидрамина гидросульфат
Диэтиловый эфир (медицинский эфир) применяют в анализе в качестве растворителя; дифенгидрамина гидрохлорид (димедрол) применяют в медицине как гистаминное средство. Бутилвиниловый эфир (С4Н9 – О – СН = СН2) является исходным веществом для препарата «Винилин» (бальзам Шостаковского), который применяют наружно для лечения долго незаживающих ран. Дифенгидрамина гидрохлорид - антигистаминное, успокаивающее, снотворное.
АЛИФАТИЧЕСКИЕ АМИНЫ
Реакция с азотистой кислотой позволяет отличить первичные, вторичные и третичные амины. Первичные амины при взаимодействии с азотистой кислотой вступают в реакцию дезаминирования с образованием спирта.
С2Н5- N Н2 + НО- N О ---- > С2Н5ОН + N 2 ↑ + Н2О этиламин этанол (характерный запах)
Вторичные амины превращаются в нитрозамины (окрашенные соединения).
СН3- N Н-СН3 + НО- N О ----- > (СН3)2- N - N = О + Н2О диметиламин диметилнитрозамин
Третичные амины под действием азотистой кислоты практически не изменяются.
Первичные амины при температуре с хлороформом и спиртовой щелочью образуют изонитрилы – вещества с сильным тошнотворным запахом. Данная реакция используется для открытия первичных аминов в фармацевтическом анализе.
СН3 – N Н2 + СНС13 + 3 N аОН ---- > СН3- N ≡ С + 3 N аОН +3Н2О метиламин метилизонитрил (запах)
Амины встречаются в природе повсеместно в виде витаминов, гормонов, промежуточных продуктов обмена, есть они и в организме животных и в растениях. Кроме того, при гниении живых организмов также получаются средние амины, которые в жидком состоянии распространяют неприятный запах селедочного рассола.
АЛЬДЕГИДЫ
Альдегиды легко окисляются в соответствующие карбоновые кислоты. Для их окисления можно использовать различные окислители. Одной из качественных реакций для обнаружения альдегидной группы является реакция «серебряного зеркала» - окисление реактивом Толленса. Катион серебра восстанавливается в свободное серебро. На стенках пробирки появляется налет металлического серебра в виде зеркала. Т* СН3-С(О)Н + 2А g (N Н3)2ОН ------- > СН3СОО N Н4 + 2А g ↓ + 3 N Н3 + Н2О уксусный ацетат альдегид аммония
Аg + +1е ---> Аg 2 окислитель С+ - 2е ---> С+3 1 восстановитель
Другая качественная реакция на альдегиды заключается в окислении их гидроксидом меди (+2). При окислении альдегида гидроксид меди (+2), имеющий светло-голубой цвет, восстанавливается в гидроксид меди (+1) желтого цвета. Этот процесс протекает при комнатной температуре. Если подогреть испытуемый раствор, то гидроксид меди (+1) желтого цвета превращается в оксид меди (+1) кирпично-красного цвета, который плохо растворим в воде и выпадает в осадок. Т* СН3- С(О)Н + 2С u (ОН)2 ------ > СН3 - СООН + 2С u ОН↓ + Н2О
С+1 -2е ---> С+3 1 восстановитель Сu+2 + 1е ---> Сu+1 2 окислитель
Т* 2С u ОН↓------- > С u 2 О↓ + Н2О
С реактивом Несслера в щелочной среде из альдегида образуется соответствующая карбоновая кислота, в результате этой реакции выпадает в осадок восстановленная ртуть серо-черного цвета.
СН3- С (О) Н + [К2Н g ] I 4 +3 КОН --- > СН3СООК + Н g ↓ + 4К I +2Н2О
С+1 – 2е ---> С+3 1 восстановитель Нg+2 +2е---> Нg 1 окислитель
Также проводят реакцию с реактивом Фелинг а, при нагревании реакционной смеси постепенно выпадает осадок оксида меди (+1) кирпично –красного цвета.
СН3-С(О)Н+2 NаООС-СН-СН-СООК+3Н2О--- >СН3СООН + 2 NаООС-СН- СН-СООК+ | | | | О О ОН ОН \ / С u сегнетова соль (тартрат калия-натрия) + С u2О↓ + Н2О
С+1 – 2е ---> С+3 1 восстановитель Сu+2 +1е ---> Сu+1 2 окислитель
Для альдегидов (и кетонов) можно предложить качественную реакцию – реакцию образования оснований Шиффа, окрашенных соединений. Реакцию проводят с аммиаком и производными аммиака (гидразин, фенилгидразин, гидроксиламин, амины).
СН3 –С (О) Н + N Н3 ------- > СН3- СН= N Н + Н2О уксусный имин этаналя, альдегид, основание Шиффа этаналь
СН3 –С (О) Н + N Н2- N Н2 ----- > СН3- СН= N - N Н2 + Н2О гидразин гидразон этаналя, основание Шиффа
СН3- С (О) Н + N Н2- N Н-С6Н5 ----- > СН3 –СН= N - N Н-С6Н5 + Н2О фенилгидразин фенилгидразон этаналя, основание Шиффа
СН3- С (О) Н + N Н2-С2Н5 ---- > СН3- С= N -С2Н5 + Н2О этиламин этилимин этаналя, основание Шиффа
СН3 –С (О) Н + N Н2-ОН ----- > СН3- СН= N -ОН + Н2О гидроксиламин оксим этаналя, основание Шиффа
Многие лекарственные препараты и биологические соединения содержат оксогруппу. Формальдегид (формалин) – применяют для дезинфекции. Так как формалин предотвращает разложение, он используется в качестве бальзамирующего средства для длительного хранения биологических препаратов. Из формальдегида получают метенамин (гексаметилентетрамин, уротропин).
Метенамин применяют как противовоспалительное средство при заболевании мочевой системы. Широкое применение в медицине имеет глюкоза – общеукрепляющее, в составе растворов кровезамещающих, плазмозамещающих, дезинтоксикационных электролитов, а также для улучшения вкуса препаратов.
Камфора (1,7,7-триметилбицикло-[2.2.1]-гептан-2-он) распространена в природе, входит в состав многих эфирных масел. Особенно много её в масле камфорного лавра, базилика, полыней, розмарина. В медицине применяют d- и L- камфору; рацемическую камфору допускают лишь для наружного применения из-за повышенной токсичности ввиду химического загрязнения. При введении под кожу растворы камфоры в растительном масле тонизируют дыхательный центр, стимулируют сосудодвигательный центр. Оказывает также непосредственное действие на сердечную мышцу, усиливая обменные процессы в ней и повышая её чувствительность к влиянию симпатических нервов. Под влиянием камфоры суживаются периферические кровеносные сосуды. Способствует отделению мокроты. Возможно, что камфора ингибирует агрегацию тромбоцитов, в связи с чем она рекомендована к применению для улучшения микроциркуляции. Противозудное действие камфоры, возможно, связано с тем, что она, как и ментол, избирательно активирует холодовые рецепторы.
КАРБОНОВЫЕ КИСЛОТЫ
Все карбоновые кислоты в водном растворе диссоциируют на ионы, окрашивают лакмус в красный цвет и метиловый оранжевый в розовый цвет (рН < 7), фенолфталеин и тимолфталеин окраску не изменяют в кислой среде. Для всех карбоновых кислот характерна реакция этерификации - взаимодействие со спиртами.
Т*, Н2 SО4 конц. СН3-СООН + С2Н5ОН--------------------------- > СН3- С (О)-ОС2Н5 + Н2О уксусная этанол этиловый эфир кислота уксусной кислоты (фруктовый запах)
Муравьиная кислота обладает восстановительными свойствами, что и используют в качественном анализе. Реакцию проводят с реактивом Толленса при нагревании, в результате реакции появляется восстановленное серебро (на стенках пробирки металлическое серебро в виде зеркала). Т* НСООН +2А g (N Н3)2ОН -------- > 2А g ↓+4 N Н3↑ +СО2↑ + 2Н2О
Аg+ + 1е ----> Аg 2 окислитель С+2 – 2 е ----> С+4 1 восстановитель
Уксусную кислоту и ее соли определяют раствором хлорида железа (III). В результате реакции образуется ацетат железа (+3) – раствор красно-бурого цвета.
3 СН 3 – СОО Na + FeC13 ----- > (CH3 –COO)3 Fe + 3NaC1 ацетат железа (+3)
Качественную реакцию на бензойную кислоту проводят в слабощелочной среде, в результате образуется основной бензоат железа (+3) - осадок розово-желтого цвета.
С6Н5-СООН + N аОН ---- > С6Н5 –СОО N а + Н2О 1 кап.
6С6Н5- СОО Na + 2 FeC 13 + 10 H 2 O ---- > (C 6 H 5 – COO)3 Fe Fe (OH)3 *7 H 2 O ↓ основной бензоат железа (III) + 3 C 6 H 5 - COOH + 6 N аС1
Реакцию нельзя проводить в щелочной среде (образуется бурый осадок гидроксид железа (+3)), нельзя проводить в кислой среде (в осадок белого цвета выпадает бензойная кислота). Щавелевую кислоту и ее соли определяют с помощью хлорида кальция, образуется белый осадок оксалат кальция.
Н2С2О4 + СаС12 ---- > СаС2О4 ↓ + 2НС1 щавелевая оксалат кислота кальция
Данную реакцию используют в аналитической химии и в фармацевтическом анализе для определения ионов Са+2. В количественном анализе используют восстановительные свойства щавелевой кислоты: Т* 5Н2С2О4+ 2КмпО4 +3Н2 S О4 ------ > 10СО2 ↑+2Мп SO 4 + K 2 SO 4 +8 Н2О
С2О4-2 – 2е ---> 2СО2 5 восстановитель Мп+7 +5е ---> Мп+2 2 окислитель
Муравьиная кислота впервые выделена из рыжих лесных муравьев (брюшных желез) английским натуралистом Джоном Рэйему в 17 веке. Кроме этих насекомых, от которых она и получила свое название, муравьиная кислота в природе находится в некоторых растениях (крапива, хвоя), фруктах, а также в едких выделениях пчел. Муравьиный спирт – спиртовой раствор муравьиной кислоты, которая в медицине применяется в качестве бактерицидного, противовоспалительного средства. Уксусная кислота является консервантом, производным для получения лекарственных препаратов (ацетилсалициловая кислота, ретинола ацетат и др.) В природе уксусная кислота распространена в свободном виде или в виде солей и сложных эфиров в растениях (в зеленых листьях), в выделениях животных (моче, желчи), образуется при гниении и брожении (в кислом молоке, сыре, вине). Брожение происходит под влиянием специфических бактерий "уксусного грибка". Ацетат натрия является инертным по отношению к организму, т.к. не всасывается при приёме внутрь. Бензойная кислота применяется как противогрибковое и противомикробное средство. Бензойная кислота содержится в ягодах клюквы, брусники и т.д. Бензоат натрия оказывает сильное угнетающее действие на дрожжи и плесневые грибы, подавляет в клетках активность ферментов, ответственных за окислительно-восстановительные реакции, а также ферментов, расщепляющих жиры и крахмал. В натуральных продуктах он содержится в небольших дозах в яблоках, изюме и клюкве, корице, гвоздике и горчице. Щавелевая кислотаи ее соль являются исходным веществом в методе перманганатометрии, и реагентом для обнаружения катиона кальция. В чистом виде щавелевая кислота содержится в грибах тутовиках. В природе встречаются лишь соли щавелевой кислоты. Соли щавелевой кислоты содержатся в кислых овощах и ягодах: щавель, ревень, смородина и т.д.
ГИДРОКСИКИСЛОТЫ
Качественную реакцию на винную(виннокаменную) кислоту проводят при строгом соблюдении нейтральной среды с раствором калия хлорида в присутствии этанола (С2Н5ОН) и ацетата натрия (СН3-СООNa). Последний реактив используют для инактивации, выделившейся в результате реакции сильной кислоты.
СН3- СОО Na, С2Н5ОН Н2С2Н4О6 + КС1 ---------------------------- > КНС2Н4О6↓ + НС1 винная гидротартрат кислота калия
НС 1 + СН 3 - СОО Na ------- > CH3-COOH + NaC1 Растворимость гидротартрата калия (КНС2Н4О6) - белого кристаллического осадка возрастает с повышением температуры, поэтому реакцию надо вести при охлаждении. Кроме того, этот осадок образуется в пересыщенном растворе; для ускорения образования кристаллов требуется механическое воздействие (например, трение). Данную реакцию используют в аналитической химии и в фармацевтическом анализе для определения ионов К+. Винная кислота в своем составе имеет диольный фрагмент – -СН(ОН)-СН(ОН)-. Наличие гидроксильных групп в винной кислоте доказывают со свежеприготовленным раствором гидроскида меди (+2).
ФЕНОЛОКИСЛОТЫ Фенолокислоты в своем составе имеют фенольную гидроксильную группу, поэтому качественную реакцию на салициловую кислоту и другие фенолокислоты, проводят с раствором хлорида железа (+3), появляется комплекс фиолетового цвета.
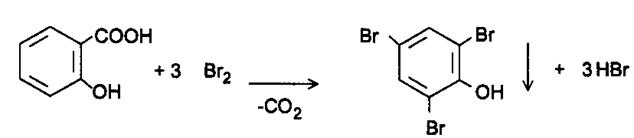
Салициловая кислота – это ароматическое соединение, можно предложить реакцию с бромной водой, в результате чего выпадает белый осадок 2,4,6 –трибромфенол.
Салициловая кислота - содержится в коре ивы, плодах и листьях малины и других растениях. В аптеке продается салициловый спирт 1%, 2% – это спиртовой раствор салициловой кислоты, применяется как антисептическое средство наружно.
|
|||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-04-05; просмотров: 314; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.143.31 (0.218 с.) |

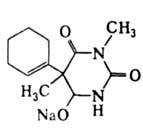
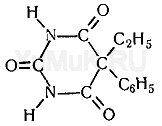
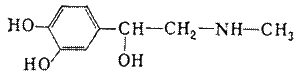 Адреналин содержится в разных органах и тканях, в значительных количествах образуется в хромафинной ткани, особенно в мозговом слое надпочечников. Адреналин вызывает сужение сосудов органов брюшной полости, кожи и слизистых оболочек, артериальное давление повышается.
Адреналин содержится в разных органах и тканях, в значительных количествах образуется в хромафинной ткани, особенно в мозговом слое надпочечников. Адреналин вызывает сужение сосудов органов брюшной полости, кожи и слизистых оболочек, артериальное давление повышается.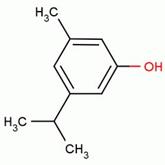 Тимол (2-изопропил-5-метилфенол) – изомер карвакрола, монотерпеновый фенол, который содержится в тимьяновом эфирном масле. Данный компонент можно обнаружить в масле чабреца (от 20 до 50%).
Тимол (2-изопропил-5-метилфенол) – изомер карвакрола, монотерпеновый фенол, который содержится в тимьяновом эфирном масле. Данный компонент можно обнаружить в масле чабреца (от 20 до 50%).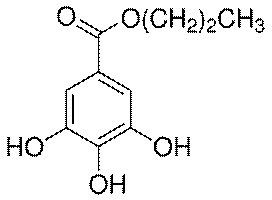 или
или 
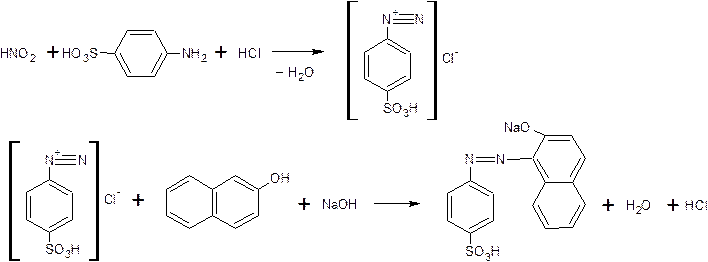

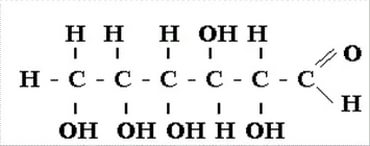 глюкоза
глюкоза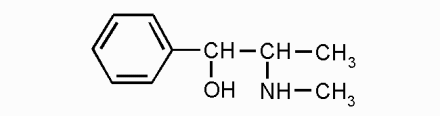 эфедрин
эфедрин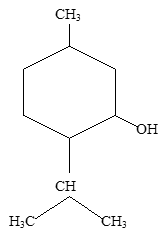 Ментол ((2R)-(2-пропил)-(5S)-метил-(1R)-циклогексанол) - органическое вещество, важный вторичный метаболит растений семейства яснотковые, получают синтетически или выделяют из мятного эфирного масла. Обладает слабыми местноанестизирующими свойствами, стимулирует холодовые рецепторы кожи и слизистых, слабый антисептик. Левовращающий изомер ментола обладает противоспалительными свойствами, используют для лечения слизистой оболочки носа, горла. Является основной составляющей рефлекторного сосудорасширяющего средства валидол.
Ментол ((2R)-(2-пропил)-(5S)-метил-(1R)-циклогексанол) - органическое вещество, важный вторичный метаболит растений семейства яснотковые, получают синтетически или выделяют из мятного эфирного масла. Обладает слабыми местноанестизирующими свойствами, стимулирует холодовые рецепторы кожи и слизистых, слабый антисептик. Левовращающий изомер ментола обладает противоспалительными свойствами, используют для лечения слизистой оболочки носа, горла. Является основной составляющей рефлекторного сосудорасширяющего средства валидол.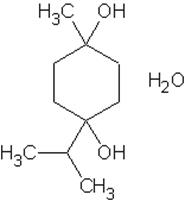 Терпингидрат (п-Ментандиол-1,8-гидрат) -лекарственное средство отхаркивающего действия. Терпингидрат входит в состав некоторых комбинированных противокашлевых лекарственных средств. Так, вместе с декстрометорфаном и левоментолом он входит в препарат «Гликодин», с кодеином и гидрокарбонатом натрия — в препараты «Кодтерпин», «Теркодин» и «Терпинкод».
Терпингидрат (п-Ментандиол-1,8-гидрат) -лекарственное средство отхаркивающего действия. Терпингидрат входит в состав некоторых комбинированных противокашлевых лекарственных средств. Так, вместе с декстрометорфаном и левоментолом он входит в препарат «Гликодин», с кодеином и гидрокарбонатом натрия — в препараты «Кодтерпин», «Теркодин» и «Терпинкод». + H2 SO4(конц) →
+ H2 SO4(конц) →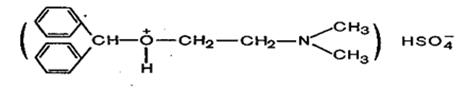
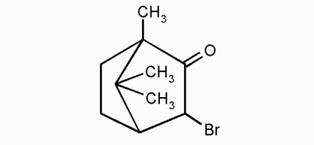 Бромкамфора (2-бромо-4,7,7-триметилбицикло[2.2.1]гептан-3-он) – синтетический препарат, основное действующее вещество которого — камфора бромистая. Оказывает успокаивающее действие на центральную нервную систему, благоприятно влияет на функции сердечно-сосудистой системы, улучшает сердечную деятельность.
Бромкамфора (2-бромо-4,7,7-триметилбицикло[2.2.1]гептан-3-он) – синтетический препарат, основное действующее вещество которого — камфора бромистая. Оказывает успокаивающее действие на центральную нервную систему, благоприятно влияет на функции сердечно-сосудистой системы, улучшает сердечную деятельность.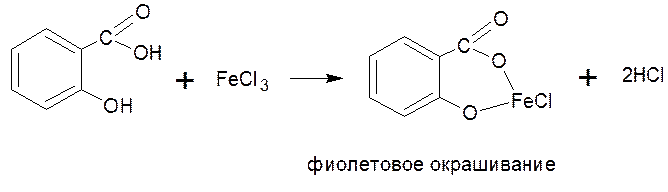
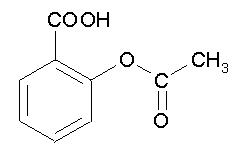 Ацетилсалициловая кислота («Аспирин», «Кардиомагнил», «Аспирин – Кардио» и другие) – известное жаропонижающее, болеутоляющее средство, применяется в профилактике тромбоэмболии после операций и в профилактике тромбоза глубоких вен.
Ацетилсалициловая кислота («Аспирин», «Кардиомагнил», «Аспирин – Кардио» и другие) – известное жаропонижающее, болеутоляющее средство, применяется в профилактике тромбоэмболии после операций и в профилактике тромбоза глубоких вен.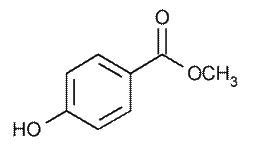 Метилсалицилат - основной компонент винтегреневого масла (эфирного масла гаультерии лежачей), а также эфирного масла берёзы вишнёвой. Применяют наружно в качестве обезболивающего и противовоспалительного средства.
Метилсалицилат - основной компонент винтегреневого масла (эфирного масла гаультерии лежачей), а также эфирного масла берёзы вишнёвой. Применяют наружно в качестве обезболивающего и противовоспалительного средства.


