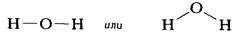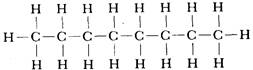Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Глава 7.1. Первоначальные химические понятияСтр 1 из 15Следующая ⇒
Соболев А. Д. Курс лекций по общей и неорганической химии 1 том Тула 2011 год
Соболев А. Д. Курс лекций по общей и неорганической химии для учащихся Химического лицея. Т 1. Издание 5-е исправленное и дополненное. ОГЛАВЛЕНИЕ Введение............................................................................................... 5 Глава 7.1. Первоначальные химические понятия §7.1.1. Предмет химии. Строение атомов......................................... 7 §7.1.2. Изотопы.................................................................................. 11 §7.1.3. Молекулы............................................................................... 16 §7.1.4. Силы межмолекулярного взаимодействия......................... 20 §7.1.5. Явления физические и химические. Признаки и условия течения химических реакций 24 §7.1.6. Элементарное введение в строение атома.......................... 28 §7.1.7. Электронные конфигурации атомов................................... 32 §7.1.8. Валентность и степень окисления. Формулы бинарных соединений 38 Глава 7.2. Основные понятия и законы химии § 7.2.1. Атомно-молекулярное учение и закон сохранения массы. Закон постоянства состава 41 § 7.2.2. Закон кратных отношений. Закон объемных отношений. Закон Авогадро 45 § 7.2.3. Основные химические понятия. Атомные и молекулярные массы 47 § 7.2.4. Закон эквивалентов. Газовые законы................................. 52 § 7.2.5. Некоторые методы определения атомных масс химических элементов 57 § 7.2.6. Химические формулы и уравнения.................................... 61 Глава 7.3. Воздух. Инертные газы § 7.3.1. Воздух.................................................................................... 67 § 7.3.2. Вакуум. Жидкий воздух....................................................... 72 § 7.3.3. Инертные газы. Открытие аргона...................................... 79 § 7.3.4. Нахождение в природе. Химические свойства. Получение и применение. 84 Глава 7.4. Кислород § 7.4.1. Кислород................................................................................ 92 § 7.4.2. Получение и применение кислорода................................. 96 § 7.4.3. Озон...................................................................................... 100 § 7.4.4. Чистое вещество................................................................. 105 § 7.4.5. Очистка веществ................................................................. 108 Введение Дорогие лицеисты, я поздравляю Вас. Вы приступаете к изучению химии, одной из самых интересных, загадочных и трудных наук. Изучение химии потребует от Вас собранности и серьезности. С самого начала нашей совместной работы мы будем относиться к Вам как к взрослым людям, серьезно относящимся к получению качественного естественно-научного образования.
Химию Вы будете изучать на лекционных и семинарских занятиях. В неделю у Вас будет одна двухчасовая лекция и четыре одночасовые семинара. На лекциях Вам будут рассказывать, тот материал, который потом будет отрабатываться на первых двух семинарах и спрашиваться на двух последних. Краткие ответы на теоретические вопросы Вы должны подготовить к устному опросу на последнем семинаре. На первый семинар по химии следующей недели, Вы должны предоставить решение 30 задач прошлой недели. На лекциях Вы можете вести конспект, в котором кратко излагается содержание лекции, в конспект могут вносится дополнения знания, полученные Вами из других источников, включая интернет. При подготовке к семинарам и экзаменам, конспект следует вести в общей или блочной тетради, оставляя большие поля. Эту тетрадь следует хранить, по крайней мере, до окончания лицея, были случаи, когда лицеисты пользовались своими конспектами для сдачи коллоквиумов, зачетов и экзаменов в ВУЗах. При подготовке к семинарам следует обратить внимание на вопросы выносимые на семинар и на экзаменационные вопросы, приводимые в конце сборника семинаров. Для подготовки к экзаменам следует завести особую тетрадь ответов на экзаменационные вопросы, в том или ином виде данные вопросы могут повторяться до окончания 11-го класса. В отличии от обычных школьных заданий, домашнее задание по химии у Вас имеется на весь учебный год, мы рекомендуем начать знакомство с ним в начале недели, чтобы у Вас было время задать учителю вопросы, ответы на которые Вы не нашли в учебниках. Наш опыт показывает, что Вам лучше иметь дело с преподавателем, ведущим семинарские занятия. Учащиеся, занимающиеся списыванием или привлекающие посторонних учителей химии для выполнения домашних заданий, как правило, досрочно покидают лицей. Вы должны отдавать себе отчет в том, что если Вы списали домашнюю работу и не в состоянии ее воспроизвести, то эта работа бессмысленна. Желаю успехов в обучении.
Директор МОУ «Химический лицей», четырежды Соросовский учитель, преподаватель общей и неорганической химии А. Д. Соболев. Глава 7.1 Табл. 1.1. Элементарные частицы материи
Атомы состоят из тяжелого положительно заряженного ядра, окруженного одной или несколькими отрицательно заряженными частицами (электронами). В ядре сконцентрирована практически вся масса атома и при этом ядро имеет очень небольшие размеры. Радиус типичного атома составляет приблизительно 100-250 пм (1 пм = 10-12 м), а радиус ядра имеет величину порядка 10-3 пм, т.е. радиус ядра в десять тысяч раз меньше радиуса атома. Если бы атом оказался увеличенным до размеров Земли, его ядро имело бы всего 60 м в диаметре и смогло свободно уместиться на небольшом футбольном поле. Ядро атома состоит из нуклонов (это общее название протонов и нейтронов). Протоны и нейтроны имеют почти одинаковые массы, но отличаются зарядом. У нейтрона нет электрического заряда, заряды протона и электрона одинаковы по величине, но противоположны по знаку, положительный заряд ядра компенсируется отрицательным зарядом окружающих его электронов. Табл. 1.2. Состав и свойства некоторых атомов и ионов
Изотопы Молекулы Образование атомов из элементарных частиц, является предметом рассмотрения ядерной физики. Когда атомы настолько сближаются друг с другом, что внешние электроны одного атома могут взаимодействовать с внешними электронами других атомов, между атомами возникают силы притяжения, удерживающие их вместе — химическая связь. В простейших случаях связь возникает в результате обобществления двух электронов между парой атомов, причем каждый из связанных атомов поставляет для этого по одному электрону. Связи, возникающие в результате обобществления электронов, называются ковалентными связями, а два или несколько атомов, связанных воедино ковалентными связями, называют молекулой. Молекула ¾ частица способная к самостоятельному существованию и представляющая совокупность атомов связанных между собой ковалентными связями. Молекулу можно изобразить в виде химической формулы, которая показывает качественный и количественный состав вещества.
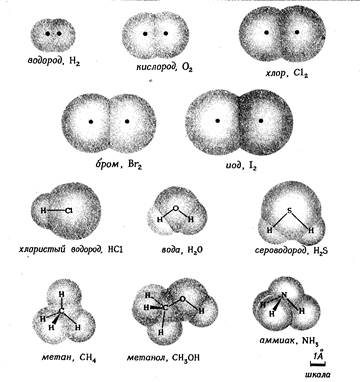
Рис. 1.2. Форма и относительные размеры некоторых простых молекул. Каждая пара связанных атомов как бы проникает друг в друга, потому что их электронные облака перекрываются между собой. Принято изображать молекулы таким образом, что расширяющаяся линия указывает связь, направленную от плоскости рисунка в сторону наблюдателя, а пунктирная линия указывает связь, уходящую за плоскость рисунка в сторону от наблюдателя.
В графических формулах молекул ковалентная связь, возникающая в результате обобществления пары электронов, схематически изображается прямой линией, соединяющей связанные атомы. Так, в молекуле воды один атом кислорода (О) связан с двумя атомами водорода (Н). Графическая формула этой молекулы может быть изображена двумя способами:
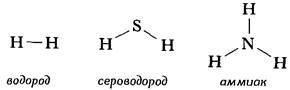
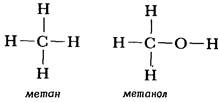
Второй вариант графической формулы воды учитывает тот факт, что молекула воды не линейна; две связи Н-О образуют угол 105° друг с другом. Молекулы газообразного водорода, сероводорода, аммиака, метана и метанола (метилового спирта) имеют следующие структурные формулы:
Графические формулы указывают только связи между атомами молекулы. Они не дают сведений о трехмерной структуре (или форме) молекул. Рис.1.2 дает представление о форме и относительном объеме нескольких молекул. Угол между связями в молекулах, содержащих более двух атомов, может принимать различные значения. В молекуле сероводорода равен 92°; четыре атома, присоединенных к центральному атому углерода в метане, направлены к четырем вершинам тетраэдра. Графическая формула неразветвленного октана, одного из компонентов бензина, такова:
Каждая из указанных выше графических формул может быть сведена к сжатой молекулярной формуле, которая показывает, сколько атомов каждого элемента имеется в молекуле, но совсем или почти совсем не дает сведений о том, как эти атомы соединены между собой. Молекулярная формула водорода Н2, воды Н2О, сероводорода H2S, аммиака NН3, метана СН4, метанола (метилового спирта) СН3ОН или СH4О, а октана C8H18. Формула октана может быть также записана в такой форме: СН3-СН2-СН2-СН2-СН2-СН2-СН2-СН3 Табл. 1.3. Температуры плавления и кипения некоторых веществ молекулярного строения
На температуры плавления и кипения сильное влияние оказывают вандерваальсовы силы межмолекулярного взаимодействия связанные с полярностью молекул. Если два атома связаны друг с другом ковалентной связью в результате обобществления пары электронов и неодинаково сильно притягивают к себе эти электроны, то электронная пара смещается в сторону того атома, который притягивает ее сильнее. На этом атоме возникает некоторый избыток отрицательного заряда, записываемый символом d- (а не знаком минус, который означает полный электронный заряд), а на соседнем атоме появляется небольшой положительный заряд d+. Поскольку способность притягивать электроны кислорода (электроотрицательность) больше, чем у водорода, атом кислорода в молекуле воды или метилового спирта несет на себе небольшой отрицательный заряд, а атомы водорода — небольшие положительные заряды (рис. 1.4). Такие молекулы называются полярными, они ведут себя как крошечные электрические диполи. Отрицательный заряд на атоме кислорода притягивает расположенные поблизости положительные заряды, а положительно заряженные атомы водорода притягивают другие отрицательные заряды. Так возникает еще один тип сил притяжения между молекулами, помимо вандерваальсовых сил притяжения. Из-за наличия дополнительных сил взаимодействия между полярными молекулами метанола (метилового спирта) он плавится и кипит при гораздо более высоких температурах, чем метан, который имеет сходные с метанолом размеры молекул. При комнатной температуре метанол представляет собой жидкость, а метан — газ.
В воде силы притяжения между атомами водорода и кислорода, принадлежащими различным молекулам, столь велики, что получили название водородных связей (H -связь). H-связи играют чрезвычайно важную роль в белках и других гигантских молекулах, из которых построены живые организмы. Если бы не полярность молекул воды и наличие между ними H-связей, вода плавилась бы и кипела при более низких температурах, чем даже сероводород. При комнатной температуре она находилась бы в газообразном состоянии, а не в виде наиболее распространенной на Земле жидкости.
Рис. 1.4. Связи О-Н в молекулах воды и метанола (метилового спирта) полярны, потому что атом кислорода сильнее притягивает электронную пару и перемещает к себе ее отрицательный заряд; при этом на атоме водорода возникает частичный положительный заряд. Полярность связей играет очень важную роль во взаимодействиях между молекулами. Квантовые числа Главное квантовое число (n) — определяет общую энергию электрона в слое, это номер слоя. На номер слоя налагаются такие же ограничения, как и на номер Вашей квартиры, номер может быть только целым и положительным числом от 1 до бесконечности. При n равном бесконечности электрон уже не принадлежит данному атому.
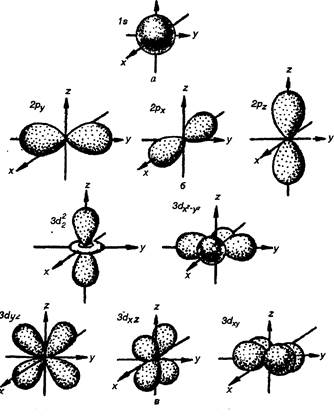
Рис. 1.5. Формы электронных облаков s-, p- и d-орбиталей. Каждый электронный слой в атоме имеет свою емкость, т. е. может содержать не больше определенного числа электронов, причем, чем дальше слой от ядра, тем электронов в нем может быть больше, максимальное число электронов в слое можно рассчитать по формуле:
N = 2n2
Каждое значение главного квантового числа это как бы этаж в доме, а на каждом этаже есть квартиры, состоящие из разного числа комнат. Чисто квартир на этаже определяет орбитальное квантовое число l. Орбитальное квантовое число l. Оно может принимать целочисленные значения от 0 до n–1 (l = 0, 1,..., n–1). Обычно численные значения l принято обозначать следующими буквенными символами:
В этом случае говорят о s-, p-, d-, f-состояниях электронов, или о s-, p-, d-, f-орбиталях, квартиры в доме состоят из разного числа комнат (атомных орбиталей), на одной атомной орбитали могут располагаться не более двух электронов. Атомная орбиталь (АО) — область пространства в котором вероятность нахождение электрона максимальна и равна 90%. АО можно представить в виде электронных облаков различной формы. Форма электронного облака зависит от значения орбитального квантового числа l. При l = 0 (s-орбиталь) электронное облако имеет шаровидную форму (сферическая симметрия) и не обладает направленностью в пространстве (рис. 1.5). При l = 1 (p-орбиталь), электронное облако имеет форму гантели, т. е. форму тела вращения, полученного из «восьмерки» (рис. 1.5). Формы электронных облаков d- и f-электронов намного сложнее, они показаны на рис. 1.5 и 1.6. Магнитное квантовое число ml. Оно может принимать значения целых чисел, как положительных, так и отрицательных, от - l до + l, включая 0, т. е. всего (2 l + 1) значений. Каждое значение ml определяет атомную орбиталь, поэтому для s-электронов l = 0, ml = 0 одна орбиталь, для p-электронов l = 1, ml = 0, ±1 три орбитали, для d-электронов l = 2, ml = 0, ±1, ±2 пять орбиталей, для f-электронов l = 3, ml = 0, ±1, ±2, ±3 семь орбиталей. Спиновое квантовое число, является индивидуальной характеристикой электрона. При движении электрона (заряженной частицы) возникает магнитное поле, которое взаимодействует с магнитными полями других электронов, как полюса магнита ¾ одинаковые отталкиваются, разноименные притягиваются. Спиновое квантовое число имеет два значения +1/2 и -1/2.
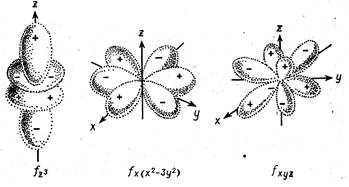
Рис. 1.6. Некоторые формы электронных облаков f-орбиталей. Глава 7.2. ОСНОВНЫЕ ПОНЯТИЯ И ЗАКОНЫ ХИМИИ Табл. 2.1. Состав (по массе) оксидов азота
Массовые части кислорода, приходящихся в этих соединениях на одну массовую часть азота, относится между собой как 0,57: 1,14: 1,71: 2,28: 2,85 = 1: 2: 3: 4: 5. Современная формулировка закона: если два химических элемента образуют между собой несколько соединений, то на одну и ту же массу одного элемента в этих соединениях, приходятся такие массы другого элемента, которые относятся между собой, как небольшие целые числа. То, что элементы вступают в соединения определенными порциями, явилось ещё одним подтверждением правильности атомистического учения и объяснения с его позиций химических процессов. Но, атомистические представления сами по себе не могли объяснить, например, количественных соотношений, которые наблюдаются в химических реакциях между газами. Французский учёный Жозеф Луи Гей-Люссак (1778-1850) в 1808 году, изучая химические реакции между газообразными веществами, обратил внимание на соотношения объёмов реагирующих газов и газообразных продуктов реакции и установил, что 1 л хлора (Cl2) целиком вступает в реакцию с 1 л водорода (H2) с образованием 2 л хлороводорода (HCl); 1 л кислорода (O2) взаимодействует без остатка с 2 л водорода (H2), образуя 2 л водяного пара (H2O). Эти опытные данные Гей-Люссак обобщил в законе объёмных отношений: Химические уравнения. Выражение реакции при помощи химических формул называется химическим уравнением. Химические уравнения показывают, какие вещества вступают в химическую реакцию и какие вещества образуются в результате этой реакции. Уравнение составляется на основе закона сохранения массы и показывает количественные соотношения веществ, участвующих в химической реакции. В качестве примера рассмотрим взаимодействие гидроксида калия с фосфорной кислотой: Н3РО4 + 3 КОН = К3РО4 + 3 Н2О. Из уравнения видно, что 1 моль ортофосфорной кислоты (98 г) реагирует с 3 моль гидроксида калия (3·56 г). В результате реакции образуется 1 моль фосфата калия (212 г) и 3 моль воды (3·18 г). Подписав под формулами веществ, принимавших участие в реакции их массы: Н3РО4 + 3 КОН = К3РО4 + 3 Н2О 98 168 212 54 98 + 168 = 266 г; 212 + 54 = 266 гвидим, что масса веществ, вступивших в реакцию, равна массе продуктов реакции. Уравнения химической реакции позволяет производить различные расчёты, связанные с данной реакцией. Пример 14. Определить массу фосфата калия, который получится при нейтрализации фосфорной кислоты гидроксидом калия массой 42 г. В соответствии с приведённым выше химическим уравнением вычислим число молей гидроксида калия пошедшего на нейтрализацию: n(KOH) = 42/56 = 0,75 (моль), следовательно: n(K3PO4) = 1/3n(KOH) = 0,25 (моль), m(K3PO4) = (39·3 + 31 + 16·4)·0,25 = 212·0,25 = 53 г. В уравнении реакции коэффициенты перед газообразными веществами показывают не только соотношение масс реагирующих газов, но и их объёмные соотношения. Это позволяет рассчитать объёмы участвующих в реакции газов непосредственно по уравнению минуя вычисления массы газа. Пример 15. При взаимодействии металлического натрия с водой выделилось 280 мл водорода (при н. у.). Сколько граммов натрия вступило в реакцию? Запишем уравнение реакции взаимодействия натрия с водой: 2 Na + 2 H2O = 2 NaOH + H2 n(H2) = 0,28/22,4 = 0,0125 (моль) = 1/2n(Na) n(Na) = 0,025 моль, m(Na) = 23·0,025 = 0,575 г. Воздух Сами того не замечая, мы живем на дне огромного воздушного океана. Та смесь газов, которая образует атмосферу, необходима для нас более, чем что-либо другое. Человек может прожить несколько недель без пищи, несколько дней без воды, но не может прожить и нескольких минут без воздуха. В воздухе таятся огромные, пока почти неиспользованные запасы энергии: вследствие неодинакового поглощения солнечных лучей различными участками земной поверхности создаётся неравномерный нагрев воздуха и возникают ветры, за счёт которых могут быть получены многие миллиарды киловатт-часов электроэнергии ежегодно. Общая масса атмосферы равна 5,2·1015 т, т. е. составляет менее одной миллионной от массы всего земного шара (6,0·1021 т). Однако на долю каждого человека всё же приходится более 1,5 млн. т воздуха. Около 90% массы атмосферы заключено в слое высотой до 16 км и лишь одна миллионная — выше 100 км. В древности воздух считался индивидуальным веществом. По учению греческого философа Анаксимена, воздух является началом всего сущего, а позднее он стал рассматриваться в качестве одного из основных элементов природы. То обстоятельство, что воздух имеет массу, было известно уже Аристотелю. Александрийский учёный Герон (62-150 гг. н. э.) писал о воздухе следующее: «Сосуды, которые кажутся большинству людей пустыми, на самом деле не пусты, а наполнены воздухом... Воздух образован частицами маленькими и лёгкими, в своём большинстве невидимыми... Отсюда должно быть принято, что воздух материален. Приведённый в движение, он становится ветром (так как ветер есть нечто иное, как воздух в движении)». Первые указания на сложность состава воздуха имеются в сочинениях древних китайских химиков. Из европейцев такое мнение впервые высказал Леонардо да Винчи (конец XV века). Оно было подтверждено опытным путём и стало общепринятым лишь около XVIII века. О силе ветра. Сила ветра измеряется специальными приборами (анемометрами) и обычно оценивается по 12-бальной шкале. Тихий ветер (1) лишь отклоняет дым из трубы, при сильном (6) качаются верхушки деревьев, а ураган (12) причиняет большие разрушения. Воздух имеет сложный состав. Его основные составные части можно подразделить на три группы: постоянные, переменные и случайные. К первым относятся кислород (около 21% по объёму), азот (около 78%) и так называемые инертные газы (около 1%). Содержание этих составных частей практически не зависит от того, в каком месте земного шара взята проба сухого воздуха. Ко второй группе относятся углекислый газ (0,02-0,04%) и водяной пар (до 3%). Содержание случайных составных частей зависит от местных условий: вблизи металлургических заводов к воздуху часто бывают примешаны заметные количества сернистого газа, в местах, где происходит распад органических остатков, — аммиака и т. д. Помимо различных газов, воздух всегда содержит большее или меньшее количество пыли. Кроме перечисленных газов воздух постоянно содержит следы (т. е. ничтожные количества) озона, водорода, метана, аммиака, оксидов азота и угарного газа. По мере совершенствования методов газового анализа число таких, практически незаметных составных частей воздуха постепенно возрастает. Атмосферная пыль содержит частицы диаметром от 10-7 до 10-2 см (из которых наиболее мелкие не оседают даже в неподвижном воздухе). Помимо пылинок, возникающих на земной поверхности (частиц почвы, дыма, пыльцы растений и т.д.), некоторое значение имеют пылинки вулканического и даже космического происхождения. Подсчитано, что на Землю ежегодно оседает около 5 млн. т космической пыли, (поверхность Земли равна 510 млн. км2), поэтому на квадратный метр приходится лишь сотая доля грамма. Абсолютная запылённость воздуха может быть в отдельных местах очень различной. Его относительная запылённость быстро уменьшается с высотой.
Кубический сантиметр комнатного воздуха обычно содержит миллионы пылинок. Общая запылённость воздуха возрастает. Было установлено, что за десятилетие с 1957 по 1967 г. помутнение атмосферы над Тихим океаном увеличилось на 30%. Количество пыли, выпадающей в большом городе, огромно. Было подсчитано, что на каждый м2 в Нью-Йорке ежемесячно выпадает до 17 г пыли, а в Токио — даже вдвое больше. Каждый кубический сантиметр воздуха городов содержит несколько тысяч микроорганизмов. Освобождение от пыли является первой стадией получения кондиционированного воздуха, который, помимо чистоты, характеризуется постоянными температурой и влажностью. Кондиционирование воздуха важно для некоторых отраслей промышленности, а также картинных галерей, музеев и т. д. Находящийся над Землей воздух давит на неё с силой более одного килограмма на каждый квадратный сантиметр поверхности. Эту величину легко подсчитать, зная, что нормальное атмосферное давление уравновешивается столбом ртути (r(Hg) = 13,6 г/см3) высотой 760 мм. Общее давление атмосферы может быть разложено на давления отдельных составляющих её газов — в этом случае говорят об их парциальных (частичных) давлениях. Например, из общей величины в 101325 Па на долю кислорода приходится 101,325·0,21 = 21,28 кПа. Соотношение между постоянными составными частями воздуха в нижних слоях атмосферы с высотой почти не меняется. Вся жизнь на земной поверхности развивалась в условиях атмосферного давления, поэтому мы не замечаем его, подобно тому как глубоководные рыбы не замечают колоссальных давлений на больших глубинах океана, тогда как на глубине 11 км давление превышает 1,01·108 Па. Изменение среднего атмосферного давления с высотой над уровнем моря:
Налагаемая атмосферным давлением на живые организмы нагрузка гораздо значительнее, чем это представляется с первого взгляда. Общая поверхность человеческого тела составляет в среднем около 20 тыс. см2. Это значит, что человек незаметно для себя испытывает постоянную нагрузку в размере примерно 20 т. Непосредственно примыкающий к поверхности Земли слой атмосферы характеризуется довольно закономерным изменением температуры — последняя понижается примерно на 6 град с каждым километром высоты. Слой этот — тропосфера — простирается на высоту около 18 км у экватора и 7 км у полюсов. Между ним и Землёй существует известная разность потенциалов, причём тропосфера заряжена положительно, а земная поверхность отрицательно. Основное значение для поддержания разности потенциалов имеет постоянное поступление в атмосферу множества мельчайших капелек морской воды, срываемых с гребней океанских волн и приобретающих при этом значительный положительный заряд. Более высокие слои атмосферы принято делить на стратосферу (приблизительно до 40 км), мезосферу (40-80 км), термосферу (80-800 км) и экзосферу (выше 800 км). Границы между этими слоями не являются чёткими и несколько изменяются в зависимости от широты местности, времени года и общего состояния атмосферы. Верхняя граница того или иного слоя носит название соответствующей «паузы». Так, граница между тропосферой и стратосферой называется тропопаузой. На высотах порядка нескольких тысяч километров экзосфера постепенно переходит в межпланетный газ. Помимо приведённой выше общей классификации атмосферных слоёв, для некоторых из них применяются другие названия. Так, слой высотой 30-80 км, в котором преимущественно протекают химические реакции под действием солнечных лучей, иногда называют хемосферой, слой выше 80 км, характеризующийся большим относительным содержанием заряженных частиц — ионосферой. Основной химический состав атмосферы примерно до 1000 км остаётся азотно-кислородным. В противоположность монотонно уменьшающемуся давлению, температурная кривая имеет минимум на высоте около 20 км, максимум около 50 км и новый минимум в мезопаузе. После этого температура начинает расти, достигая примерно 900 °С уже на высоте 200 км. Плотность атмосферы на больших высотах последовательно уменьшается. Общий характер высотного изменения температуры воздуха был предугадан Аристотелем. Он делил атмосферу на три слоя, из которых прилегающий к Земле пригоден для жизни, следующий сильно охлажден, а самый верхний, наоборот, сильно нагрет.
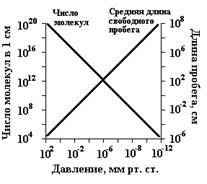
Рис. 3.1. Основныехарактеристики вакуума. По молекулярно-кинетической теории температура газа определяется средней энергией движения составляющих его частиц. «Совершенно очевидно, что имеется достаточное основание теплоты в движении. А так как движение не может происходить без материи, то необходимо, чтобы достаточное основание теплоты заключалось в движении какой-то материи», — писал в 1745 г. М. В. Ломоносов. Термометр изолирован от излучений, он показал бы очень низкую температуру, ниже -200 °С. Дело в том, что термометр (дающий практически интересующие нас оценки) регистрирует не энергию движения каждой отдельной частицы, а общую энергию, сообщаемую ему ударами окружающих частиц. Таких ударов за единицу времени тем больше, чем больше молекул в единице объема газа. Каждый кубический сантиметр воздуха земной поверхности содержит 2,7·1019 молекул. Вакуум. Жидкий воздух Обычно достигаемый в лабораториях вакуум («пустота»), при котором столкновения молекул между собой уже сравнительно редки, соответствует давлению примерно в 0,13 Па. При каком вакууме в каждом кубическом сантиметре разреженного газа остается еще около 3·1013 частиц. Даже с помощью самых совершенных методов современной техники не удается достигнуть вакуума, при котором в кубическом сантиметре газа оставалось бы менее 1000 частиц. Между тем кубический сантиметр межпланетного пространства содержит лишь десятки частиц, а межзвездного — еще гораздо меньше. Именно поэтому «межзвездное пространство одновременно и исключительно холодно и чрезвычайно горячо» (Эддингтон). Фактическая температура находящегося в межпланетном пространстве тела соответствует средней энергии движения его собственных частиц. Она определяется в основном лучепоглощением и лучеиспусканием этого тела. Например, обращенная к Солнцу сторона Луны (на ее экваторе) нагревается до +120 °С, а обратная осаждается до -150 °С. Так как одни поверхности (особенно-зеркальная) сильно затрудняют обмен лучистой энергией, а другие (особенно — шероховатая черная) такому обмену очень способствуют, путем изменения характера направленных к Солнцу и от него поверхностей находящегося в межпланетном пространстве тела можно регулировать его температуру. Масса литра воздуха при нормальных условиях (1,293 г), а его средняя молярная масса воздуха равна 22,4·1,293 = 29 г/моль. Пример 1. Вычислим плотность хлора по отношению к воздуху. Молекулярная формула хлора — Cl2, молярная масса — 35,5·2 = 71. Как вытекает из закона Авогадро, данный газ во столько раз тяжелее (легче) воздуха, во сколько раз его молярная масса больше (меньше) средней молярной массы воздуха. Следовательно, плотность хлора по отношению к воздуху будет 71:29 = 2,45, т. е. хлор приблизительно в 2,5 раза тяжелее воздуха. При достаточном охлаждении воздух переходит в жидкое состояние. Жидкий воздух можно довольно долго сохранять в сосудах с двойными стенками, из пространства между которыми для уменьшения теплопередачи выкачан воздух. Подобные сосуды используются, например, в термосах. Свободно испаряющийся при обычных условиях жидкий воздух имеет температуру около -190 °С. Состав его непостоянен, так как азот улетучивается быстрее кислорода. По мере удаления азота цвет жидкого воздуха изменяется от голубоватого до бледно-синего (цвет жидкого кислорода). До XIX века считали, что газы являются таковыми по самой своей природе, и вопрос о их сжижении даже не возникал. Лишь в 20-х годах XIX века, применяя значительные давления, удалось получить в жидком состоянии хлор, аммиак, диоксид углерода и ряд других веществ «газообразной природы». Однако оставались еще многие, в частности основные газы воздуха — кислород и азот, которые, несмотря на все усилия, не сжижались. На них перенесли то представление, которое раньше было общим и стали считать их «постоянными» газами. Только в 1877 г. впервые удалось получить в жидком состоянии один из этих «постоянных» газов — кислород. Вслед за тем были сжижены и все другие.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-04-05; просмотров: 63; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.147.81.214 (0.105 с.) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||