Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Наличия санитарно-показательных микроорганизмов.Стр 1 из 3Следующая ⇒
Санитарная микробиология Санитарная микробиология изучает микрофлору окружающей среды с целью исследования всех ее объектов (почвы, воды, воздуха, пищевых продуктов и др.) как возможных источников и факторов передачи инфекционных заболеваний. Она тесно связана с медицинской микробиологией, гигиеной, эпидемиологией, экологией. В ее задачи входят: гигиеническая оценка всех объектов внешней среды; разработка методов выявления и идентификации патогенных и условно-патогенных микроорганизмов; нормирование допустимого количества представителей различных родов и видов, контроль исполнения установленных нормативов. В функции санитарных врачей входит постоянное наблюдение за санитарным режимом лечебных учреждений, аптек и производственных предприятий различного профиля, разработка методов и средств оздоровления объектов окружающей среды и оценка их эффективности. Санитарное состояние объектов внешней среды определяют по двум основным показателям:
Микрофлора почвы и методы ее изучения Почва служит благоприятной средой для развития и накопления многих видов бактерий, грибов, вирусов, простейших и представляет собой трехфазную систему, включающую почвенный воздух, почвенную влагу, минеральные и органические вещества. Вода и вещества, растворенные в ней, образуют почвенный раствор, в котором развивается большая часть всех микроорганизмов. Представители почвенной микрофлоры обитают в водных и коллоидных пленках, обволакивающих почвенные частицы. Растительные и животные остатки, попавшие в почву, служат источником мертвых органических веществ, необходимых для питания почвенных микроорганизмов. В ризосфере (прикорневой зоне) и ризоплане (на поверхности корней), где также обитают микробы, между ними и растениями формируются особые взаимоотношения. Ряд веществ, продуцируемых растениями, а также живая масса корней представляют собой хороший питательный субстрат.
Из минеральных веществ в почве присутствуют нитраты и нитриты, карбонаты, бикарбонаты, сульфаты, хлориды, соединения железа, алюминия, марганца и др. Почвенные микроорганизмы осуществляют важнейшую функцию – минерализацию сложных органических соединений, превращая их в формы, доступные для растений, и при этом очищая внешнюю среду от отходов, поступающих в результате жизнедеятельности животных и людей. Одновременно с разложением органических остатков микроорганизмы-автотрофы синтезируют органические соединения собственных клеток и таким образом создают в почве запасы витаминов, аминокислот и др., которые попадают в оборотный капитал природы после их гибели. В почве формируются сообщества (ценозы) с разнообразным видовым и количественным составом микроорганизмов. В богатых органикой почвах количество бактерий может достигать нескольких миллиардов в 1г. Значительно меньше в почве актиномицетов, Их в 1г не более 10 млн. Грибы представлены в различных почвах в количестве от нескольких сотен тысяч до нескольких миллионов в 1г. Содержание простейших в том же объеме обычно не превышает нескольких тысяч. Наличие большого количества микроорганизмов в почве служит косвенным показателем ее плодородия. Наиболее заселенными являются черноземные, каштановые и сероземные почвы. Состав микрофлоры определяется климатическими, почвенно-географическими условиями и зависит от комплекса факторов – содержания источников питания, влажности, рН, аэрации, структуры почвы, способов обработки, взаимоотношений между микроорганизмами и др. . . Основную массу почвенных микроорганизмов составляют сапрофитные и лишь незначительное количество приходится на долю патогенных видов. Санитарное состояние почвы оценивают на основании нескольких показателей: 1 – содержания общего количества микроорганизмов (общее микробное число), Метод мембранных фильтров Этот метод применяют для определения БГКП. Почвенную суспензию, приготовленную так же, как в предыдущем исследовании, (см. определение общего количества микроорганизмов в почве), разводят от 1:10 до 1:1000 при исследовании чистых почв и от 1:1000 до 1:1000000 – при изучении загрязненных почв. Затем 5 или 10 мл полученных разведений фильтруют через мембранные фильтры с диаметром пор не более 0,45 мкм в аппарате Зейтца. Фильтры помещают на среду Эндо, в состав которой входят мясопептонный агар, лактоза и индикатор и инкубируют в термостате при температуре 37º С в течение 24 ч. При наличии бактерий группы кишечной палочки на фильтрах появляется рост колоний темно-красного цвета с металлическим блеском. Из колоний готовят мазки, окрашивают их по Граму, и микроскопируют. БГКП имеют палочковидную форму и при окраске приобретают красный цвет (т.е. являются грамотрицательными). Затем с культурой грамотрицательных лактозоположительных бактерий ставят оксидазный тест, который позволяет дифференцировать представителей семейства Enterobacteriaceae и Pseudomonadaceae. Для определения оксидазной активности часть исследуемой колонии переносят стерильной петлей на фильтровальную бумагу, пропитанную диметил -n-фенилендиамином и a-нафтолом. У микроорганизмов, продуцирующих оксидазу, цвет колонии становится сине-фиолетовым. Бактерии группы кишечной палочки являются оксидазоотрицательными и не изменяют своего цвета. Дополнительно проверяют способность исследуемой культуры ферментировать глюкозу и разлагать белки. Колонии, выросшие на фильтрах на среде Эндо, учитывают как БГКП, если они образованы грамотрицательными, оксидазонегативными палочками, ферментирующими глюкозу до кислоты и газа и не разлагающими белки.
Для определения общего количества БГКП в исследуемой почве, подсчитывают количество колоний, выросших на фильтре, через который был пропущен определенный объем разведения почвенной болтушки. Затем вычисляют, сколько бактерий группы кишечной палочки содержится в одном миллилитре этого разведения. Общее количество БГКП подсчитывают, умножая показатель содержания этих микроорганизмов в 1 мл на соответствующее разведение. Пример: Было профильтровано 10 мл из разведения 1:10000. На фильтре выросло 20 колоний. Составляем пропорцию: В 10 мл -20 бактерий, а в одном –х. Получаем результат: Х= (20 × 1): 10 = 5 бактерий. Поскольку проба для фильтрования была отобрана из разведения 1:10000, умножаем 5 на 10000. Окончательный итог – в 1 г. почвы содержатся 50000 БГКП.
Отбор проб воды Для взятия проб воды используют как многоразовую, так и одноразовую стерильную посуду. Многоразовая изготовляется из материалов, выдерживающих обработку сухим жаром и автоклавированием. Емкости для забора воды закрывают плотными пробками и защитным колпачком из фольги или плотной бумаги. Из открытых водоемов пробы берут обычно с глубины 10-15 см от поверхности, а из мелководных водоисточников - на уровне 10-15 см от дна. Для взятия проб используют также специальный аппарат – батометр (рис 2,3). Он состоит из металлического каркаса, в который вставляется бутылка для воды, закрывающаяся плотной пробкой с приспособлением для ее открывания. Этот аппарат укреплен на тросе, позволяющем опускать его на нужную глубину. Батометры часто используются при взятии глубинных проб воды из больших водоемов.
Рис. 2. Батометр Рис.3. Взятие проб воды с помощью батометра
Перед взятием проб из водопровода кран протирают тампоном, смоченным спиртом, и обжигают, после чего 10-15 мин сливают застоявшуюся в трубах воду и только затем отбирают образец для исследования. Анализ проводят сразу после взятия проб. При необходимости транспортировки воду сохраняют при температуре 1-5º С и анализируют не позднее чем через 2-6 ч с момента ее забора.
Таблица 1. Рекомендуемые для посева разведения воды в зависимости от степени ее загрязненности при определении общего микробного числа (объем каждого разведения для посева составляет 1 мл)
Определение бактерий группы кишечной палочки (БКГБ) Санитарно-показательными микроорганизмами в воде, также как и в почве, являются бактерии группы кишечной палочки (БГКП). Они также называются колиформными (от лат. Escherihia coli - кишечная палочка.) Эта группа объединяет факультативно анаэробных представителей семейства Enterobacteriaceae. Все они имеют палочковидную форму, не образуют спор, грамотрицательные, оксидазоотрицательные, разлагают лактозу до кислоты и газа. Следует обратить внимание на температуру, при которой наиболее активно проявляются сахаролитические свойства колиформных бактерий. Большинство из них сбраживает лактозу через 24-48 ч при температуре 37ºС. Такие бактерии относят к общим колиформным бактериям (ОКБ). Отличительной особенностью термотолерантных колиформных бактерий (ТКБ) является то, что они разлагают лактозу до кислоты и газа при более высокой температуре - 44ºС в течение более короткого времени – за 24 ч. Обнаружение термотолерантных колиформных бактерий (ТКБ) указывает на свежее фекальное загрязнение воды. Бактерии группы кишечной палочки выявляются различными методами. Наиболее распространенным является метод мембранных фильтров.
Таблица 2. Нормативы безопасности питьевой воды в эпидемическом отношении по микробиологическим и паразитологическим показателям (по методическим указаниям «Санитарно-микробиологический анализ питьевой воды» МУК 4.2.1018-01)
Примечание: 1 Трехкратно исследуют по 100 мл отобранной пробы воды. 2 Превышение норматива не допускается в 95 % проб, отбираемых в точках водоразбора наружной и внутренней водопроводной сети в течение 12 мес., при количестве исследуемых проб не менее 100 за год. 3 Определяют только в системах водоснабжения из поверхностных источников перед подачей воды в распределительную сеть. 4 Определение проводят при оценке эффективности технологии обработки воды.
Таблица № 4. Допустимые уровни микробной обсемененности воздуха помещений аптек (СанПиН 2.1.3.1375-03)
Вопросы для самоподготовки
Санитарная микробиология Санитарная микробиология изучает микрофлору окружающей среды с целью исследования всех ее объектов (почвы, воды, воздуха, пищевых продуктов и др.) как возможных источников и факторов передачи инфекционных заболеваний. Она тесно связана с медицинской микробиологией, гигиеной, эпидемиологией, экологией. В ее задачи входят: гигиеническая оценка всех объектов внешней среды; разработка методов выявления и идентификации патогенных и условно-патогенных микроорганизмов; нормирование допустимого количества представителей различных родов и видов, контроль исполнения установленных нормативов. В функции санитарных врачей входит постоянное наблюдение за санитарным режимом лечебных учреждений, аптек и производственных предприятий различного профиля, разработка методов и средств оздоровления объектов окружающей среды и оценка их эффективности. Санитарное состояние объектов внешней среды определяют по двум основным показателям:
Микрофлора почвы и методы ее изучения Почва служит благоприятной средой для развития и накопления многих видов бактерий, грибов, вирусов, простейших и представляет собой трехфазную систему, включающую почвенный воздух, почвенную влагу, минеральные и органические вещества. Вода и вещества, растворенные в ней, образуют почвенный раствор, в котором развивается большая часть всех микроорганизмов. Представители почвенной микрофлоры обитают в водных и коллоидных пленках, обволакивающих почвенные частицы. Растительные и животные остатки, попавшие в почву, служат источником мертвых органических веществ, необходимых для питания почвенных микроорганизмов. В ризосфере (прикорневой зоне) и ризоплане (на поверхности корней), где также обитают микробы, между ними и растениями формируются особые взаимоотношения. Ряд веществ, продуцируемых растениями, а также живая масса корней представляют собой хороший питательный субстрат. Из минеральных веществ в почве присутствуют нитраты и нитриты, карбонаты, бикарбонаты, сульфаты, хлориды, соединения железа, алюминия, марганца и др. Почвенные микроорганизмы осуществляют важнейшую функцию – минерализацию сложных органических соединений, превращая их в формы, доступные для растений, и при этом очищая внешнюю среду от отходов, поступающих в результате жизнедеятельности животных и людей. Одновременно с разложением органических остатков микроорганизмы-автотрофы синтезируют органические соединения собственных клеток и таким образом создают в почве запасы витаминов, аминокислот и др., которые попадают в оборотный капитал природы после их гибели. В почве формируются сообщества (ценозы) с разнообразным видовым и количественным составом микроорганизмов. В богатых органикой почвах количество бактерий может достигать нескольких миллиардов в 1г. Значительно меньше в почве актиномицетов, Их в 1г не более 10 млн. Грибы представлены в различных почвах в количестве от нескольких сотен тысяч до нескольких миллионов в 1г. Содержание простейших в том же объеме обычно не превышает нескольких тысяч. Наличие большого количества микроорганизмов в почве служит косвенным показателем ее плодородия. Наиболее заселенными являются черноземные, каштановые и сероземные почвы. Состав микрофлоры определяется климатическими, почвенно-географическими условиями и зависит от комплекса факторов – содержания источников питания, влажности, рН, аэрации, структуры почвы, способов обработки, взаимоотношений между микроорганизмами и др. . . Основную массу почвенных микроорганизмов составляют сапрофитные и лишь незначительное количество приходится на долю патогенных видов. Санитарное состояние почвы оценивают на основании нескольких показателей: 1 – содержания общего количества микроорганизмов (общее микробное число), наличия санитарно-показательных микроорганизмов. Для решения ряда агротехнических вопросов проводят определение общего количества микроорганизмов, участвующих в различных процессах превращения азота и углеродсодержащих веществ (аммонифицирующих, азотфиксирующих, целлюлозоразрушающих и др.). Например, перед внесением пестицидов обязательно определяют видовой и количественный состав почвенной микрофлоры. Для почвы санитарно-показательными организмами служат бактерии группы кишечной палочки (БГКП или колиформные), фекальные энтерококки, Clostridium perfringens, термофильные бактерии, Proteus spp. Патогенные микроорганизмы выявляют в объектах внешней среды чаще всего для того, чтобы оценить эпидемиологическую ситуацию и принять необходимые меры для ликвидации источников инфекции. Следует отметить, что неспорообразующие микроорганизмы относительно быстро погибают во внешней среде, не находя там подходящих условий для жизнедеятельности. Однако даже кратковременное их пребывание может стать причиной ряда инфекций. Так, возбудители брюшного тифа, лептоспироза и др., попадающие в почву с выделениями человека и животных, сохраняются в течение нескольких недель и даже месяцев. Шигеллы – возбудители бактериальной дизентерии не теряют патогенности, выживая в почве до 3-4 мес. Наибольшей устойчивостью во внешней среде обладают микроорганизмы, образующие споры, которые сохраняют жизнеспособность на протяжении десятилетий и даже столетий. Например, в зонах активного земледелия почву исследуют на содержание в ней спор возбудителей столбняка, чтобы провести своевременно профилактику лиц, работающих в земледелии. Санитарно-микробиологическое исследование почвы При изучении микрофлоры почвы необходимо принять во внимание то, что конечные количественные показатели в большей степени зависят от метода исследования. Так, при изучении микрофлоры методом прямого подсчета по Виноградскому результаты превышают фактическое содержание микроорганизмов. Это связано с тем, что при микроскопии окрашенных препаратов, приготовленных из разведений исследуемых почвенных проб, невозможно разграничить живые и убитые клетки микроорганизмов. Более реальную картину количества микроорганизмов демонстрирует метод количественного учета бактерий, выросших на мясопептонном агаре (МПА). Отбор проб. Почвенные пробы в количестве от 100 до 200 г берут с одинаковой глубины (от 10 до 30см) в 4-5 точках участка площадью 25 квадратных метров. Забор проб производят в стеклянные банки или в синтетические пакеты с помощью ножа, лопаты или совка. Из глубоких слоев почву берут буром. Если бура нет, то делают вертикальный надрез почвы до необходимой глубины и ножом или лопаткой берут несколько образцов с отвесной стороны разреза из нужного горизонта. Все приспособления и тара для почвенных образцов должны быть стерильными. Отобранные образцы почвы доставляют в лабораторию и проводят исследования. Анализы делают в тот же день. Допускается хранение почвы не дольше 24 ч в холодильнике при температуре 1 - 5º С.
Определение общего количества микроорганизмов в почве. 1. Метод учета на мясопептонном агаре.
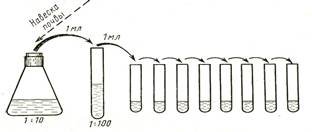
Образцы почвы, доставленные в лабораторию, освобождают от крупных примесей –стекол, камней, корней и др. Крупные комочки почвы измельчают, затем образцы пропускают через сито с диаметром отверстий не более 3 мм., объединяют и из этой смеси берут навеску 10г. Приготовленную навеску вносят в колбу с 90 мл стерильной дистиллированной воды и тщательно перемешивают взбалтыванием в течение 5-10 мин. Такая обработка необходима для того, чтобы извлечь микроорганизмы из комочков земли и с поверхности почвенных частиц. Полученную равномерную взвесь отстаивают 2 мин и затем готовят из нее ряд 10-кратных разведений, последовательно перенося стерильной пипеткой по 1 мл в пробирки с 9 мл стерильной дистиллированной воды. Схема последовательных разведений почвы представлена на рис. 1. При приготовлении разведений взвесь переносят в каждую последующую пробирку новой стерильной пипеткой. Таким образом, готовят разведения до 1:1000000 и более в зависимости от того, из каких почв были взяты пробы для исследования, и их предполагаемой заселенности микроорганизмами. Для посева используют не менее двух различных разведений (обычно используют два последних, максимальных). Из каждого выбранного разведения по 1 мл вносят в 2 стерильные чашки Петри (для получения средних показателей) и заливают 15-20 мл расплавленного и охлажденного до 45ºС МПА. Осторожно передвигая чашки по поверхности стола, перемешивают агар с внесенными в него разведениями почвы. После застывания питательной среды чашки инкубируют в термостате при температуре 30-35ºС в течение 24 - 48 ч. Количество микроорганизмов, содержащихся в 1г исследуемой почвы, определяют следующим образом. Подсчитывают количество колоний, выросших на каждой из двух чашек, суммируют полученные результаты и делят на 2, вычисляя среднеарифметический показатель, и умножают его на степень разведения. Для подсчета берут чашки, на которых выросло от 50 до 150 колоний. Пример. В чашках, засеянных почвенной суспензией, взятой из разведения 1: 10000, выросли в среднем 75 колоний. 75 умножаем на степень разведения - 10000 и получаем результат - 750000 бактерий. То есть такое количество микроорганизмов содержится в 1 г исследуемого образца почвы.
Рис. 1. Схема последовательных разведений почвы.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-04-05; просмотров: 123; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.22.171.136 (0.047 с.) |