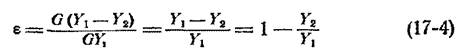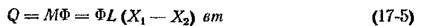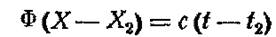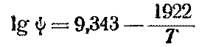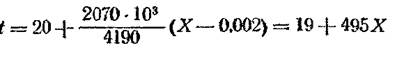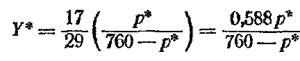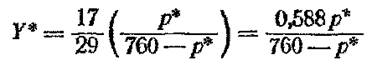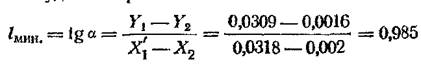Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Раздел 3 массообменные процессы и аппаратыСтр 1 из 4Следующая ⇒
ПиА НГ (2) Занятие № ___ РАЗДЕЛ 3 МАССООБМЕННЫЕ ПРОЦЕССЫ И АППАРАТЫ Тема 3.3 Абсорбция. Сущность абсорбции, применение. Равновесие. Закон Генри. Влияние температуры и давления на растворимость газов в жидкости. Требования к абсорбенту и выбор. (П. Г. Романков и др. с.324-326; А. А. Захарова и др. ПиАХТ с.275-278, 291-297; А. П. Плановский ПиАХТ с.590-591) Вопросы: Сущность абсорбции, применение. Равновесие. Закон Генри. Влияние температуры и давления на растворимость газов в жидкости. Требования к абсорбенту и выбор. Сущность абсорбции, применение. Абсорбцией называется процесс избирательного поглощения компонентов из газовых или парогазовых смесей жидкими поглотителями (абсорбентами). Обратный процесс — выделение поглощенного газа из поглотителя — называется десорбцией. При контактировании газовой смеси с жидким поглотителем один компонент (или несколько) переходит из одной фазы в другую Абсорбция подразделяется на два вида. Физическая абсорбция – поглощаемый компонент не взаимодействует химически с абсорбентом. Он только растворяется в абсорбенте. Процесс в большинстве случаев обратим. На этом свойстве основано выделение поглощённого компонента из раствора – десорбция. Химическая абсорбция (хемосорбция) – поглощаемый компонент с абсорбентом образует химическое соединение. В этом случае поглотитель представляет собой химически активный компонент или раствор химически активного компонента; вещество, в котором растворён химически активный компонент называется растворителем. В промышленности процесс абсорбции обычно сочетают с последующей десорбцией, что позволяет многократно использовать абсорбент. Экспериментально установлено, что процесс абсорбции всегда сопровождается выделением теплоты. Процессы абсорбции широко применяются в промышленности: - для разделения углеводородных газов на нефтеперерабатывающих установках; - для получения соляной и серной кислот, аммиачной воды; - для выделения из газовых смесей ценных компонентов из газов крекинга или пиролиза метана, извлечения из коксового газа аммиака, бензола и др., - для очистки технологических и горючих газов от вредных примесей (например, при очистке их от сероводорода),
2 - для санитарной очистки газов (например, отходящих газов от сернистого ангидрида) и т. д. В некоторых случаях десорбцию не проводят, если извлекаемый компонент и поглотитель являются дешевыми или отбросными продуктами или если в результате абсорбции получается готовый продукт (например, соляная кислота при абсорбции хлористого водорода водой). Растворимость газов в жидких поглотителях зависит: 1) от физических и химических свойств газовой и жидкой фаз; 2) от температуры; 3) от давления газа в смеси; чем оно выше, тем растворимость газа больше.
Требования к абсорбенту и выбор. Основные проблемы при осуществлении абсорбции связаны с подбором абсорбента и созданием рациональных условий контактирования газа и жидкости. При выборе абсорбента к нему предъявляются следующие требования: - селективность, т.е. способность избирательного поглощения целевого компонента при возможно малой растворимости в нём газа-носителя, что позволяет перевести в жидкую фазу только поглощаемый компонент (ПК), оставляя газ-носитель в газовой фазе; - большая поглотительная способность, т.е. высокая растворимость поглощаемого вещества в жидкой фазе в рабочих условиях; при этом уменьшаются затраты на подачу абсорбента, затраты теплоты на его нагрев при десорбции и т.д.; - возможно более низкая летучесть (в идеале – нулевая), т.е.малая упругость паров абсорбента при рабочей температуре во избежание его потерь с уходящим газом; - устойчивость в работе, т.е. абсорбент не должен подвергаться изменениям – разложению, окислению, осмолению и т.д.; - безопасность (удобство) в работе – нетоксичность, негорючесть, малое коррозионное воздействие на аппаратуру; - доступность и дешевизна; - лёгкая регенерируемость при десорбции или каком-либо другом процессе регенерации.
ПиА НГ (2) Занятие № 42 Тема 3.3 Абсорбция. А. П. Плановский ПиАХТ с.566-573) Вопросы: Материальный баланс. Тепловой баланс. Расход абсорбента.
Материальный баланс. Материальный баланс абсорбера характеризуется уравнением (16-14), в котором G — количество инертного газа, кг/сек L — количество поглотителя, кг/сек, У — содержание компонента в газовой фазе, кг/кг инертного газа; X — содержание компонента в жидкой фазе, кг/кг поглотителя. Величина l определяемая по уравнению (16-15), является удельным расходом поглотителя (кг/кг инертного газа). При полном извлечении компонента из газа его содержание в газовой фазе на выходе из абсорбера было бы У2 = 0, а количество поглощенного компонента составило бы GY1 Отношение количества фактически поглощенного компонента G(У1 — У2) к количеству, поглощаемому при полном извлечении, называется степенью извлечения:
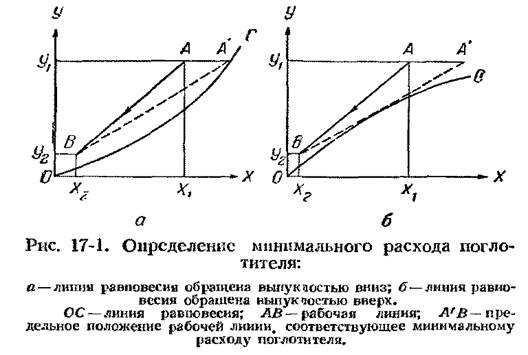
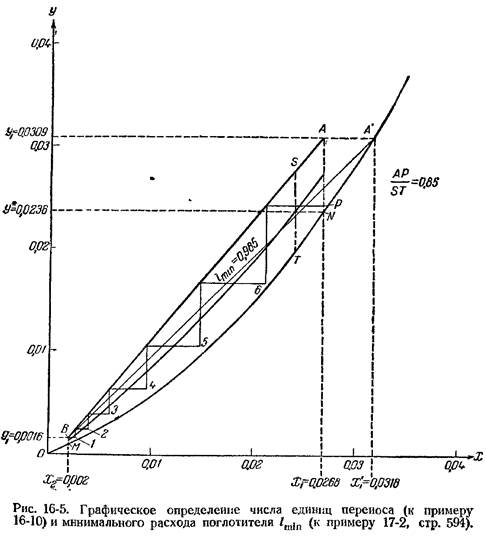
Рабочая линия процесса абсорбции описывается уравнением (16-16). На диаграмме Y — X она расположена выше линии равновесия, так как при абсорбции содержание компонента в газовой фазе больше равновесного. При десорбции, наоборот, рабочая линия лежит ниже линии равновесия. Чтобы построить рабочую линию, надо знать составы фаз на входе в абсорбер (Х2, Y1) и на выходе из него (Х1 Y2). По этим составам строят точки А и В (см. рис. 16-1), а расход поглотителя определяют по уравнению (16-15). Однако обычно заданы только начальные составы газа и жидкости (У1 Х2) и степень извлечения ε. Заданным условиям соответствует определенное значение Y2, которое можно найти по формуле (17-4) и таким образом построить точку В (рис.17-1). В зависимости от удельного расхода поглотителя рабочая линия будет поворачиваться около точки В, причем точка А будет перемещаться по горизонтали, соответствующей ординате У1 Положение А'В, когда точка А' лежит на линии равновесия (рис. 17-1, а) или когда рабочая линия касается линии равновесия (рис. 17-1,6), соответствует минимальному расходу поглотителяlmin. При минимальном расходе поглотителя движущая сила в точке касания рабочей линии и линии равновесия равна нулю, при этом требуется абсорбер бесконечно большой высоты.С увеличением удельного расхода поглотителя уменьшается требуемая высота абсорбера, но возрастают расходы на десорбцию, на перекачивание поглотителя и т. д. Наивыгоднейший удельный расход поглотителя можно найти технико-экономическим расчетом.
Тепловой баланс Если абсорбция ведется без отвода тепла или с неполным его отводом» температура повышается вследствие выделения тепла при растворении газа в жидкости. Повышение температуры ведет к повышению равновесного парциального давления компонента и к сдвигу линии равновесия вверх. Движущая сила при этом уменьшается и условия абсорбции ухудшаются. Количество выделяющегося, при абсорбции тепла составляет
где Ф— дифференциальная теплота растворения (в дж/кг), т. е. количество тепла, выделяющегося при поглощении 1 кг компонента в растворе данной концентрации; М — количество поглощенного компонента, кг/сек. Если абсорбция ведется без отвода тепла, можно считать, что все выделяющееся тепло идет на нагревание жидкости:
где с — удельная теплоемкость жидкости, дж1кг град, t1 и t2 — температуры жидкости на выходе из абсорбера и на входе в пего. Приравнивая правые части уравнений (17-5) и (17-6), получим уравнение теплового баланса абсорбера, работающего без отвода тепла:
Для части абсорбера, расположенной выше сечения, в котором состав жидкости равен X. а температура t, это уравнение примет вид
откуда температура жидкости в любом сечении абсорбера при составе жидкости X будет составлять.
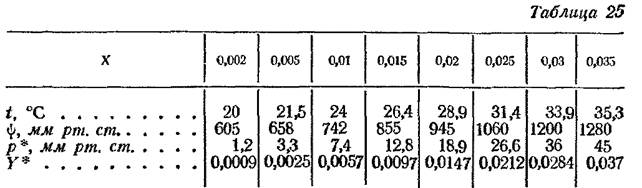
Значения Х в уравнении (17-8) принимаются произвольно, относительно изначально заданного значения содержания извлекаемого компонента в абсорбенте (см. пример 16-5 – Пл. с.569) – 0,002 относительной весовой единицы При построении линии равновесия для каждого значения X надо определить t по уравнению (17-8). а затем найти Y* для этих значений X и t но уравнению {17-2). Пример 17-1. (Пл. с.593) Построить линию равновесия процесса поглощения аммиака водой в условиях примера 16-5 {стр 569), если температура поступающей воды t2 — 20°С, а коэффициент φ в уравнении (17-1) для раствора аммиака в воде выражается формулой
где - φ — в мм pm. cm, Т — температура раствора, °К Дифференциальная теплота растворения NH3 в воде Ф — 2070 * I09 дж/кг (495 ккал(кг). Решение Принимая теплоемкость жидкости (воды) = с ~4190 дж/кг • град (1 ккал/кг - град), находим по формуле (17-8) температуру жидкости:
где 0,002 — содержание NH3 в воде, поступающей на абсорбцию (Х2), (см. пример 16-5, стр. 569). Задаваясь рядом значений Х, находим температуру t и рассчитываем соответствующие величины φ. (Для всех значений Х) Далее находим по уравнению (17-1, Пл с.590) значения парциальных давлений для всех значений Х
А далее определяем Y* по формуле (17-2) (тоже для всех значений Х):
где 17 и 29—молекулярные массы NH3 и воздуха. Результаты расчета сведены в табл. 25.
Расчет числа единиц переноса по найденным значениям Y* приведен в примере 16-10 (стр. 586). По рассчитанным данным (См. таблицу 25) Y* и принятым значениям Х строим линию равновесия – изогнутая линия на рис. 16-5
Пример 17-2. Определить минимальный удельный расход поглотителя при абсорбции аммиака водой в условиях примеров 16-5 (стр. 569) и 16-10 (стр. 586). Решение. На Y — X диаграмме (см. рис. 16-5, стр. 587) строим точку В с координатами (Х2 = 0,002, Y2 = 0,0016) и точку А’ на линии равновесия с ординатой Y1 = 0,0309. Абсцисса точки А' будет 0,0318. Минимальный удельный расход поглотителя составляет:
Принятый в примере 16-5 удельный расход поглотителя l = 1,18 больше lmin в-1,2 раза-
ПиА НГ (2) Занятие № ___ РАЗДЕЛ 3 МАССООБМЕННЫЕ ПРОЦЕССЫ И АППАРАТЫ Тема 3.3 Абсорбция.
Сущность абсорбции, применение. Равновесие. Закон Генри. Влияние температуры и давления на растворимость газов в жидкости. Требования к абсорбенту и выбор. (П. Г. Романков и др. с.324-326; А. А. Захарова и др. ПиАХТ с.275-278, 291-297; А. П. Плановский ПиАХТ с.590-591) Вопросы:
|
||||||||
|
Последнее изменение этой страницы: 2021-04-04; просмотров: 103; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.138.122.4 (0.033 с.) |