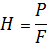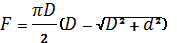Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Организация практических работСтр 1 из 9Следующая ⇒
Организация практических работ и практических занятий обучающихся при изучении учебной дисциплины «Материаловедение»
2017год Методические рекомендации для проведения практических работ и занятий учебной дисциплины материаловедение разработаны на основе Федерального государственного образовательного стандарта (далее – ФГОС) по специальностям среднего профессионального образования: 13.02.11 Техническая эксплуатация и обслуживание электрического и электромеханического оборудования (по отраслям).
Организация-разработчик: ОГАПОУ «Губкинский горно-политехнический колледж»
ОДОБРЕНО УТВЕРЖДАЮ Предметной цикловой комиссией заместитель директора по УПР Манукова Н.Ю. _____________ Согласовано Протокол №______ от _____________ заместитель директора по УМР председатель__________/ / Морозова Л.А. _____________
Разработчик: Красникова Н.Е. преподаватель материаловедения Пояснительная записка Развитие человеческого общества во многом определяется открытием и активным использованием материалов различного назначения. Достаточно вспомнить такие исторические этапы как каменный, бронзовый, железный века. Кстати, можно считать, что железный век, начавшийся более 2 тысяч лет назад, продолжается до сих пор, поскольку сплавы на основе железа (стали и чугуны) являются и, сейчас, основными конструкционными и инструментальными материалами промышленности. В настоящее время значение разработки новых и эффективного использования имеющихся материалов особенно велико в связи с острой необходимостью перехода от "сырьевого" к преимущественно инновационному пути развития производства. Очевидно, что с каждым годом роль науки о материалах и, соответственно, дисциплины "Материаловедение" будет неизбежно возрастать. Поэтому нет нужды рекламировать важность изучения этой дисциплины.
Общеинженерная дисциплина "Материаловедение" ограничивается изучением главным образом конструкционных и инструментальных материалов различного назначения. Номенклатура таких материалов, потребляемых промышленностью, чрезвычайно велика и разнообразна (только сталей выпускается более 2 тысяч марок). Поэтому освоение дисциплины "Материаловедение", содержащей большое количество новых понятий и терминов, а также фактических данных о строении и свойствах различных материалов, требует определенных усилий. Любой материал характеризуется химическим составом, структурой и свойствами. Материаловедение – это наука, изучающая связь между химическим составом, структурой и свойствами материалов и закономерности изменения этих свойств под влиянием внешних воздействий ( механических,термических, химических и др.), реализуемых в процессе производства, обработки и эксплуатации изделий из этих материалов Химический состав – это процентное содержание (обычно % по массе) химических элементов, присутствующих в данном материале. Понятие структура имеет очень широкий смысл, включающий все сведения о материале от электронного строения отдельных атомов до видимых невооруженным глазом макродефектов образцов (изделий). В практическом материаловедении (и данном пособии) под термином структура обычно подразумевается микроструктура материалов, изучаемая с помощью микроскопов (тип и относительное количество фаз, форма, размеры и взаимное расположение кристаллов этих фаз).
Для потребителя (в частности, студента) главным элементом приведенной на рис. 1 схемы являются свойства, поскольку имеющийся комплекс физических, механических и других свойств определяет возможность конкретного применения того или иного материала. Из множества свойств, присущих любому материалу, наиболее общими являются механические свойства (материалы, не обладающие, например, достаточной прочностью, не могут иметь широкого практического применения), они же и наиболее важны для конструкционных и инструментальных материалов, которые в основном и изучаются в данном курсе. Кроме того, механические свойства «структурно-чувствительны», то есть чутко реагируют на изменения в структуре материалов, поэтому позволяют наглядно продемонстрировать «красную нить» материаловедения:
Состав ® Структура ® Свойства Знание закономерностей, связывающих эти три С (см. рис.1), позволяет производить оптимальный выбор материалов и технологий их обработки для изделий различного назначения. Такой выбор должен обеспечивать технологичность изготовления изделия, его надежность и долговечность в условиях эксплуатации и быть экономически оправданным. Выработка такого умения является главной целью подготовки специалистов в области материаловедения. Практическая работа Цель работы 1. Изучить механизм и кинетику процесса кристаллизации. 2. Изучить макроструктуру металлических слитков. 3. Изучить влияние условий кристаллизации на структуру и механические свойства металла. Основные положения Кристаллизация – это процесс перехода вещества из жидкого состояния в твердое, кристаллическое. В расплавленном металле нет дальнего порядка: расстояния между атомами не являются постоянными, объемы с упорядоченным расположением атомов то возникают, то снова исчезают (рис. 1, а). В процессе кристаллизации устанавливается дальний порядок: атомы располагаются на определенных расстояниях по каждому пространственному направлению, образуя кристаллическую решетку (рис. 1, б). Такое упорядоченное расположение возникает за счет равновесия сил притяжения и отталкивания между атомами и соответствует минимуму энергии взаимодействия атомов в металле.
Рис. 1. Расположение атомов в жидком (а) и твердом (б) металле Процесс кристаллизации может идти самопроизвольно, а может вызываться какими-то искусственными причинами. Самопроизвольно идут только те термодинамические процессы, которые приводят к уменьшению свободной энергии системы. (Свободная энергия F – это изменяемая часть полной энергии системы.) С повышением температуры металла его свободная энергия как в жидком, так и в твердом состоянии снижается, но с разной скоростью: свободная энергия жидкого металла снижается быстрее (рис. 2). Поэтому кривые зависимости свободной энергии от температуры пересекаются при какой-то температуре TS. При любой температуре ниже TS меньшим уровнем свободной энергии обладает твердый металл, поэтому, если охладить расплав до температуры T 1 < TS, начнется кристаллизация. И наоборот, при температурах выше TS устойчиво жидкое состояние, поскольку жидкий металл имеет меньший уровень свободной энергии. Значит, нагрев до T 2 > TS приведет к плавлению.
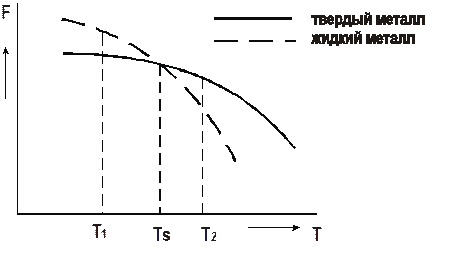
Рис. 2. Зависимости свободной энергии металла от температуры Температура TS, при которойсвободная энергия металла в твердом и жидком состоянии одинакова, называется теоретической температурой кристаллизации. При этой температуре жидкость и кристаллы находятся в равновесии, ни плавление, ни кристаллизация до конца не идут. Чтобы кристаллизация осуществилась, необходимо некоторое переохлаждение относительно теоретической температурой кристаллизации. В таком случае образование кристаллов дает выигрыш в свободной энергии, что и является стимулом процесса. Поэтому на самом деле кристаллизация всегда происходит при температуре ниже TS. Реальная температура кристаллизации T Р всегда меньше теоретической. Разность между теоретической и реальной температурой кристаллизации называется степенью переохлаждения Δ T:
Δ T = TS – T Р. Измеряя температуру металла в процессе кристаллизации, можно получить кривую охлаждения (рис. 3). Это график в координатах «температура – время». На этой кривой имеется горизонтальный участок, соответствующий переходу металла из жидкого состояния в твердое. Постоянная температура на этом участке поддерживается за счет выделения скрытой теплоты кристаллизации.
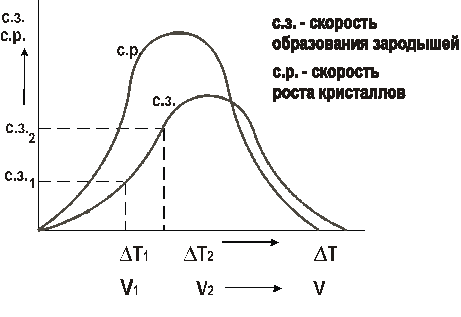
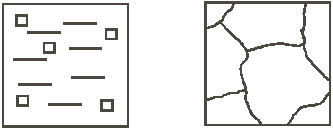
Рис. 3. Кривая охлаждения расплавленного металла Степень переохлаждения при кристаллизации не является постоянной величиной. Она увеличивается с увеличением скорости охлаждения металла. В реальных заводских условиях изготовления отливок степень переохлаждения обычно не превышает 20–30°, но для очень чистых металлов может достигать нескольких сотен градусов. Механизм процесса кристаллизации можно представить в виде двух элементарных процессов: 1) Образование в жидкости центров кристаллизации (зародышей, мельчайших твердых частиц). 2) Рост кристаллов из образовавшихся зародышей. Скорости этих элементарных процессов зависят от степени переохлаждения Δ T или скорости охлаждения металла V. Эта зависимость показана на рис. 4. Как уже говорилось, в большинстве случаев процессы кристаллизации металла на металлургических заводах, в литейных цехах происходят при сравнительно небольших степенях переохлаждения Из приведенной на рис. 4 зависимости видно, что при малых скоростях охлаждения и малых степенях переохлаждения (например, Δ T 1 и V 1) получается небольшая скорость образования зародышей (с.з.1). Следовательно, в кристаллизующейся жидкости образуется небольшое число центров кристаллизации и из них вырастает небольшое число кристаллов, что приводит к появлению крупнозернистой структуры после затвердевания металла. Схематически это показано на рис. 5.
Рис. 4. Зависимость скорости процесса кристаллизации от степени переохлаждения
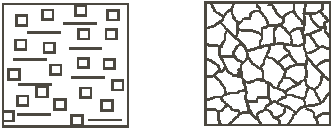
а б Рис. 5. Кристаллизация при медленном охлаждении: а – начало процесса; б – окончание процесса Если же кристаллизация происходит при больших скоростях охлаждения и больших степенях переохлаждения (Δ T 2 , V 2), то в жидкости образуется большое количество центров кристаллизации (с.з.2) и из них, соответственно, вырастает большое число кристаллов. Металл при этом получается мелкозернистый (рис. 6).
а б Рис. 6. Кристаллизация при быстром охлаждении: а – начало процесса; б – окончание процесса Столкновение растущих кристаллов приводит к потере ими правильной огранки. Такие потерявшие правильную форму кристаллы называются зернами. При очень маленькой скорости охлаждения (крайняя левая точка на При огромных скоростях охлаждения (крайняя правая точка на рис. 4) достигаются такие большие степени переохлаждения, что тепловое движение атомов в металле замедляется, атомы не успевают образовать дальний порядок, выстроиться в кристаллическую решетку. Жидкое, неупорядоченное состояние металла оказывается как бы «замороженным». Металл становится твердым, но не имеет кристаллического строения. Это аморфный металл или металлическое стекло. Аморфные металлы широко применяются в современной аудиотехнике благодаря уникальным магнитным свойствам. Поскольку структура металла определяет его свойства, рассмотренные закономерности кристаллизации могут быть использованы для формирования необходимых свойств металла при отливке деталей. Мелкозернистый металл обладает более высоким сопротивлением деформации и большей вязкостью. Дело в том, что границы зерен являются барьером для развития деформации и для роста трещины. В мелкозернистом металле суммарная поверхность зерен в единице объема больше, чем в крупнозернистом. Поэтому и сопротивление мелкозернистого металла деформированию и разрушению больше. Чтобы разрушить металл с мелким зерном требуется затратить больше энергии. Поэтому при отливке деталей, испытывающих значительные нагрузки при эксплуатации, целесообразно проводить процесс кристаллизации при высокой скорости охлаждения, чтобы получить мелкозернистую структуру. Если необходимую скорость кристаллизации обеспечить не удается (в отливках большой массы), то для измельчения зерна в жидкий металл вводят небольшие добавки примесей в виде мелких нерастворимых в расплаве частиц, увеличивая тем самым число центров кристаллизации. Такой процесс называется модифицированием, а вводимые добавки – модификаторами. В качестве модификаторов обычно применяются мелкие частицы карбидов, оксидов (Сr7С3, VC, ТiC, Al2О3 и др.) и некоторые вещества, облегчающие образование зародышей в жидкости (В, Mg и др.). Измельчению зерна способствует также вибрация кристаллизующегося металла.
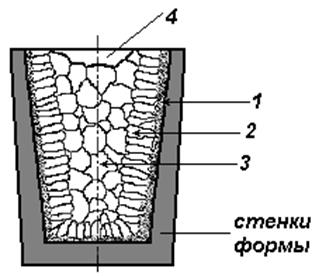
Следует иметь в виду, что при получении отливок затвердевание металла в форме происходит с разными скоростями охлаждения в различных ее частях. Скорость охлаждения уменьшается от стенки формы к центральной ее части, при этом меняется и направление теплоотвода в местах роста кристаллов. В результате полученный слиток имеет неодинаковое строение по сечению, а значит, и разные свойства (рис. 7). Поверхностный слой будет мелкозернистый (т.е., с высокими механическими свойствами), центральная часть слитка – крупнозернистая. Рис. 7. Характерные зоны слитка: 1 – корка (зона мелких по-разному ориентированных кристаллов); 2 – зона столбчатых кристаллов, растущих в направлении, обратном направлению теплоотвода; 3 – зона крупных, произвольно ориентированных кристаллов; 4 – усадочная раковина в верхней части слитка. Размер этих зон существенно меняется в зависимости от состава металла и условий кристаллизации. Порядок выполнения работы 1. Ознакомится с основными сведениями по теме работы. 2. С помощью биологического микроскопа проследить ход кристаллизации различных солей из пересыщенных водных растворов. Зарисовать начальную, промежуточную и конечную стадии кристаллизации, изобразить характерную форму кристаллов каждой соли. При этом обратить внимание, в каких местах капли раствора процесс кристаллизации начинается раньше и протекает интенсивнее. Описать и объяснить результаты наблюдений. Задание №1 Описать и зарисовать процесс кристаллизации на разных стадиях (начальном, промежуточном и завершающем) Задание №2 Вычертить графики изменения свободной энергии жидкого и твердого металла в зависимости от температуры и кривые охлаждения металла. Задание №3 Зарисовать дендритную форму кристалла. Описать, что такое дендрит и как он образуется. Задание №4 Изучить и зарисовать макроструктуру слитка металла. Указать на рисунке зоны кристаллизации, объяснить их образование. 4. Составить письменный отчет по работе.
Содержание отчета 1. Цель работы. 2. Основные положения по теме работы (кратко). 3. Описание отдельных стадий выполнения работы с указанием используемого оборудования с необходимыми пояснениями, цифровыми данными, зарисовками. 4. Анализ полученных результатов, выводы. Контрольные вопросы 1. Сформулируйте законы кристаллизации. 2. Как меняется энергия системы кристаллизации? 3. Что такое степень переохлаждения? 4. От каких факторов зависит процесс кристаллизации? 5. Что такое зародыш критического размера? 6. Что такое модифицирование? Практическая работа Порядок выполнения работы 1. Ознакомиться с устройством машины, на которой будет проводиться испытание. 2. Измерить диаметр образца и расчетную длину l0, отмеченную на образце рисками. 3. Закрепить образец в захватах машины. 4. Включить электродвигатель испытательной машины и наблюдать за процессом растяжения образца. 5. После разрушения образца выключить электродвигатель и вынуть из захватов машины обе части образца. 6. Записать значение наибольшей нагрузки Pпч по шкале силоизмерительного устройства. 7. Обе части разрушенного образца сложить вместе. 8. Замерить расстояние между рисками l1 и диаметр образца вместе. 9. По получению при испытании данным вычисляют механические характеристики материала. 10. Тип и наименование испытательной машины. Цена деления шкалы. 11. Эскиз и размеры образца до испытания.
Диаметр d=…мм. Расчетная длина l0=…мм. Начальная площадь поперечного сечения F0=..мм. Диаметр шейки d1=..мм. Длина расчетного участка после разрыва l1=..мм. 12.Вид и размер образца после разрушения. 13.Схема диаграммы растяжения (с указанием характерных точек). Предел текучести (физический) где PT – нагрузка, соответствующая площадке текучести, кгс(H); F0 – начальная площадь поперечного сечения образца, мм2. Предел точности
где Pпч - наибольшая нагрузка, предшествующая разрыву образца, кгс(H). Относительная остаточное удлинение где Масштаб диаграммы: удлинение Результаты испытания: предел текучести предел прочности = … кгс/мм2 (…Н/мм2) относительное остаточное удлинение относительное остаточное сужение Содержание отчета 1. Цель работы. 2. Основные положения по теме работы (кратко). 3. Описание отдельных стадий выполнения работы с указанием используемого оборудования с необходимыми пояснениями, цифровыми данными, зарисовками. 4. Анализ полученных результатов, выводы. Контрольные вопросы 1. Что называют пределом текучести и пределом прочности? 2. Какие механические свойства материала можно определить по диаграмме растяжения? 3. На какой испытательной машине выполняется работа? 4. Какой применяется образец? 5. Для какого участка диаграммы растяжения справедлив закон Гука?
Практическая работа Цель работы Ознакомиться с методами испытания электроизоляционных материалов на твердость, определить и сравнить величины твердости различных материалов Определение твердости металлов и сплавов по методу Бринелля, приобретение навыков определения твердости методом вдавливания в образец стального закаленного шарика. Общие положения Для определения твердости различных материалов (в том числе и электроизоляционных) существует несколько способов: вдавливания, царапанья и др. Наиболее распространенным является способ вдавливания шарика (способ Бринелля). Он заключается в том, что в установленный на стальной плите образец вдавливается на специальном прессе стальной закаленный и полированный шарик диаметром D, равным 5 мм. Образец берут шириной не менее 15 мм, толщиной не менее 5мм. Поверхность его должна быть гладкой. Усилие вдавливания повышает до наибольшего значения P в течение 30 с. Наибольшее усилие выдерживают в течении 1 мин, затем его плавно уменьшают. Твердость по Бринеллю HB, H/см2, определяют делением вдавливающего усилия P (H) на площадь F(см2) сферического отпечатка (лунки) в образце.
Порядок выполнения работы 1. Установить образец электроизоляционного материала на столик 2 пресса. 2. Ввести в соприкосновении образец и шарик. 3. Увеличить механическую нагрузку в течение 30 мин до заданной величины. Выдержать максимальную нагрузку, соответствующую твердости испытываемого материала, в течение 60 с, а затем плавно снять нагрузку. 4. Сняв нагрузку, измерить диаметр лунки d или ее глубину h и подсчитать твердость материала согласно формулам:
Для определения площади F измеряют диаметр лунки d или ее глубину h в миллиметрах и подчитывают площадь по формулам: Результаты измерений и вычислении записать в таблицу.
Содержание отчета 1. Цель работы. 2. Основные положения по теме работы (кратко). 3. Описание отдельных стадий выполнения работы с указанием используемого оборудования с необходимыми пояснениями, цифровыми данными, зарисовками. 4. Анализ полученных результатов, выводы. Контрольные вопросы 1. Что понимают под твердостью? 2. Сравнить твердость стали, алюминия, свинца, гетинакса, картона и стеклопластика. Какай из этих материалов самый твердый? 3. В каких единицах измеряют твердость материалов? 4. По каким формулам можно подсчитать твердость материала и площади лунки? Практическое занятие Анализ превращений по диаграмме состояния ЖЕЛЕЗО – ЦЕМЕНТИТ Цель занятия Ознакомление с методами практического использования диаграммы состояния железо – цементит для изучения структур сталей и чугунов при различных температурах нагрева и определение их применения. Задания: Ответить на вопросы, используя учебник Ю.П. Солнцев, С.А. Вологжанина «Материаловедение», тема: «диаграмма состояния системы железо– углерод» 1. Какими способами можно получить сплавы___________________________ 2. В чем разница между фазой и структурной составляющей сплава? 3. В сплавах возможно образование следующих фаз _____________________ 4. К каким типам сплавов относятся структуры: феррит, аустенит, ледебурит, цементит, перлит? Твердые растворы______________________________________________________________Химические соединения___________________________________________________________ Механические смеси_________________________________________________________________ 5. С какой целью строят диаграммы состояния сплавов? 6. В каких координатах строят диаграмму состояния железо– цементит? 7. Нанесите основные линии диаграммы состояния Fe – Fe 3 C. 8. Как влияют на механические свойства сплавов структуры: цементит, феррит, перлит, ледебурит? Данные занесите в таблицу: Таблица «Зависимость механических свойств сплавов от их структуры» Структура |
Механические свойства | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Прочность | Твердость НВ | Пластичность | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Феррит | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Цементит | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Перлит | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ледебурит | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
9. Укажите, при каком содержании углерода в %, стали являются доэвтектоидными?
10. Укажите, при каком содержании углерода в %, стали являются заэвтектоидными?
11. Укажите, при каком содержании углерода в %, сталь является эвтектоидной?
12. Какая линия на диаграмме состояния системы Fe – Fe3C соответствует началу кристаллизации и как она называется?
13. Какая линия на диаграмме состояния системы Fe – Fe3C соответствует окончанию кристаллизации сплава и как она называется?
14. Каково содержание углерода в чугуне.
15. Какие чугуны применяются в машиностроении: доэвтектические или заэвтектические?
16. Постройте кривые охлаждения сплавов согласно вариантов таблицы:
| № варианта | Сплав с содержанием углерода в % |
| 1. | 0,02 |
| 2. | 0,5 |
| 3. | 0,8 |
| 4. | 1,7 |
| 5. | 3,5 |
| 6. | 4,3 |
| 7. | 5,5 |
Опишите структурные превращения данного сплава при медленном охлаждении, используя критические точки диаграммы состояния Fe – Fe 3 C ( по следующему алгоритму):
Содержание отчета
1. Цель работы.
2. Основные положения по теме работы (кратко).
3. Описание отдельных стадий выполнения работы с указанием используемого оборудования с необходимыми пояснениями, цифровыми данными, зарисовками.
4. Анализ полученных результатов, выводы.
Практическое занятие
Общие положения
При изменении концентрации компонентов в металле двух и более компонентов системы, а так же в процессе их охлаждения или нагрева, в составляющих происходят фазовые и структурные изменения, которые отражают с помощью диаграммы состояния.
В двух компонентных системах по вертикали to, а по горизонтали - концентрация С(%) (рис. 1).
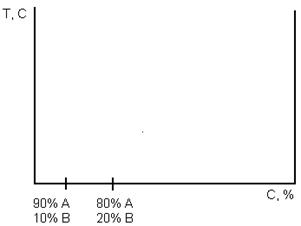
Рис 1. Пример построения диаграммы состояния
Каждая точка на оси абсцисс соответствует содержанию 1 и 2 компонентов в сплаве, с учётом того, что общее содержание их в каждой точке = 100%.
Крайние ординаты на диаграмме соответствуют чистым компонентам, а ординаты между ними - двойному сплаву.
Диаграмма состояния «железо - цементит».
На диаграмме состояния железо-цементит Fe - Fe3С (рис.2) приведен фазовый состав и структура сплавов с концентрацией углерода от чистого Fe (0% С) до цементита Fe3C (6,67% С). В интервале концентраций 0ч2,14% С находятся стали; 2,14ч6,67 % С - чугуны. Диаграмма на рис. 1б приведена в упрощенном варианте, а именно, исключена перитектическая реакция, обусловленная высокотемпературной модификацией Fe α(β). Линии диаграммы фиксируют начало и конец того или иного превращения. Каждая область включает одну или две фазы, которые образуют структурные составляющие. Любая точка диаграммы показывает химический состав, температуру, фазовый состав и структуру сплава.
В системе железо - цементит присутствуют фазы: жидкая и твердая (феррит, аустенит и цементит). Феррит (Ф) - твердый раствор внедрения углерода в Fеа с предельной растворимостью 0,02% С (точка Р). Феррит мягкий, пластичный с недостаточно прочной структурой и со свойствами: σв=250 МПа; σ0,2=120 МПа; δ=50%; ψ=80%; НВ 800ч900 МПа. Аустенит (А) - твердый раствор внедрения углерода в Fеγ; занимает область АЕSG; имеет предельную растворимость углерода 2,14% (точка Е). Аустенит немагнитен; обладает высокой пластичностью и низкой прочностью. Цементит (Ц) - это химическое соединение Fе3С - карбид железа. В цементите содержится 6,67% С, ему отвечает ордината DFKL. Цементит обладает очень низкой пластичностью и высокой твердостью до НV 1000.
Области жидкой фазы, феррита и аустенита однофазные, остальные - двухфазные. Структурное состояние сплавов может быть более сложным, чем фазовое. Так, в стали с содержанием углерода 0,8% (точка S) при температуре 727°С образуется эвтектоидная смесь феррита (Ф) и цементита (Ц), названная перлитом (П). Соответственно, сталь с содержанием углерода 0,8% является эвтектоидной и имеет структуру перлита (П); стали с содержанием С < 0,8% - доэвтектоидные со структурой перлита (П) и феррита (Ф); стали с содержанием углерода от 0,8% до 2,14% - заэвтектоидные со структурой П + Ц.
Чугун с содержанием углерода 4,3% (точка С) кристаллизуется при 1147°С с образованием эвтектической смеси ледебурит (Л). Ледебурит в интервале температур 1147ч727°С состоит из А + Ц(Л = А + Ц); при 727°С аустенит превращается в перлит (П); ниже 727°С ледебурит - это смесь П + Ц (Л = П + Ц). Превращение аустенита (727°С) в перлит (П) названо эвтектоидной реакцией. Чугун с содержанием С == 4,3% является эвтектическим, имеет структуру ледебурита (Л); с содержанием углерода от 2,14% до 4,3% - доэвтектическим, имеет в интервале температур 1147ч727°С структуру (А + Ц + Л), ниже 727°С (П + Ц + Л); с содержанием углерода от 4,3% до 6,67% - заэвтектическим, имеет структуру Л + Ц (П+Ц).
Превращения в сталях. Рассмотрим превращения, которые происходят при охлаждении стали состава I из жидкого состояния в твердое. Проводим на диаграмме (рис. 1б) вертикаль, соответствующую составу I (заэвтектоидная сталь). При пересечении линии ликвидус АСD при температуре t1 начинается первичная кристаллизация - выделяются кристаллы аустенита А; завершается кристаллизация при пересечении линии солидус АЕСF при температуре t2, в результате в интервале температур t1чt2 состояние сплава Ж + А. Таким образом, первичная кристаллизация сталей заканчивается образованием аустенита.
В интервале температур t2чt3 сохраняется структура аустенита, никаких превращений не происходит. В интервале температур t3чt4 вследствие уменьшения растворимости углерода (от 2,14 до 0,8%) в аустените по линии ЕS из аустенита выделяется цементит; структура - аустенит плюс цементит (А + Ц). При 727°С содержание углерода в аустените снижается до 0,8% (точки S на диаграмме) и в интервале времени t4чt41 происходит эвтектоидная реакция: А превращается в П (на кривой охлаждения рис. 1а -горизонталь).
Ниже 727°С структура П + Ц остается без изменений. железоуглеродистый сплав нагрев охлаждение
Для эвтектоидной стали (С = 0,8%) при температуре до 727°С сохраняется структура аустенита, а при температуре 727°С происходит эвтектоидная реакция - аустенит превращается в перлит; ниже 727°С структура П остается без изменений.
Для доэвтектоидных сталей (С < 0,8%) в интервале между линиями СS - РS происходит изменение кристаллической решетки железа Fеγ в Fеα: аустенит превращается в феррит (А→Ф). Содержание углерода в аустените и феррите повышается.
Процессы, происходящие при охлаждении (→) и нагреве (←) обратимы (←→). При нагреве стали состава I структура сплава до температуры 727°С представляет собой (П + Ц), при 727 °С (А←П) и структура в интервале температур t4чt3 (А + Ц); при повышении температуры от t4 до t3 цементит распадается, а образовавшийся углерод растворяется в аустените; при температуре t3 содержание углерода в аустените соответствует составу сплава I; в интервале температур t3чt2 изменений не происходит; в интервале температур t2чt1 происходит плавление (Ж ←А) и выше температуры t1 сохраняется жидкое агрегатное состояние.
Превращения в чугунах. Рассмотрим превращения, которые происходят при охлаждении чугуна состава II из жидкого состояния. На диаграмме (рис.1б) проводим вертикаль, соответствующую составу II. Кристаллизация начинается при температуре t7 с выделения аустенита, в интервале t7чt9 состав выделяющегося аустенита изменяется по линии солидус АЕ до состава АЕ, а состав остающейся жидкости - по линии ликвидус АС до состава Жc. При температуре 1147°С в интервале времени τ9 - τ91 происходит эвтектическая реакция, при которой жидкость превращается в ледебурит (АЕ+Ц=Л). На кривой рис.1в этому процессу соответствует горизонталь (процесс протекает при постоянной температуре). В интервале температур t9чt11 растворимость углерода в аустените уменьшается по линии ЕS от 2,14 до 0,8%С и из аустенита выделяется, в том числе и входящий в ледебурит, цементит.
Структура доэвтектического сплава в интервале температур t7чt9 (А+Ц+Л). При температуре 727°С в период времени τ11 - τ111 аустенит (А) по эвтектоидной реакции превращается в перлит (П), (на рис.1в этому процессу соответствует горизонталь) и структура сплава ниже температуры 727°С (линии РSК) - (Ц+П+Л).
Для эвтектического чугуна (4,3%С) кристаллизация происходит при постоянной температуре 1147°С по эвтектической реакции и завершается образованием ледебурита (Л).
Кристаллизация заэвтектических чугунов начинается на линии ликвидус СD с выделения цементита Ц и завершается при 1147°С эвтектической реакцией - образованием ледебурита (Л); структура сплава после кристаллизации - (Ц+Л). При нагреве происходят обратные (←) процессы.
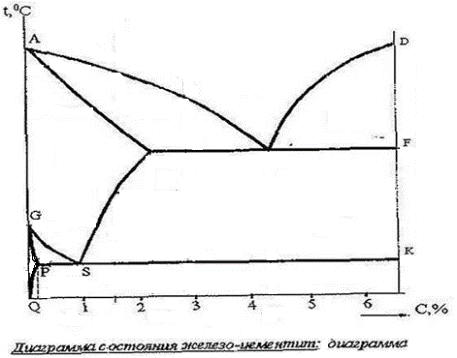
Рис 2. Диаграмма состояния железо-цементит
Задание:
Определение фазового состава, состава фаз и количественного соотношения фаз для двух заданных точек диаграммы. Построить термограммы охлаждения для заданных сплавов.
Первый сплав: С = 1,5 %, T = 900o.
Фазовый состав: А + Ц
Состав фаз: A: С = 1,2 % Fe = 98,8 %
Ц: С = 6,67 % Fe = 93,33 %
Соотношение фаз (см. рис. 2):

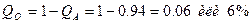
Второй сплав: С = 5 %, T = 1000o.
Фазовый состав: А + Ц
Состав фаз: A: С = 1,5 % Fe = 98,5 %
Ц: С = 6,67 % Fe = 93,33 %
Соотношение фаз (см. рис. 2):


Содержание отчета
1. Цель работы.
2. Основные положения по теме работы (кратко).
3. Описание отдельных стадий выполнения работы с необходимыми пояснениями, цифровыми данными, зарисовками.
4. Анализ полученных результатов, выводы.
Практическая работа
Цель работы
Закрепить знания по теме «Стали», научиться расшифровывать марки сталей согласно ГОСТам, используя схему-алгоритм маркировки сталей
Общие сведения
Назначение.
По назначению стали бывают:
Качество.
Степень раскисления.
 Рис.1. Структурная схема дисциплины «Материаловедение»
Рис.1. Структурная схема дисциплины «Материаловедение»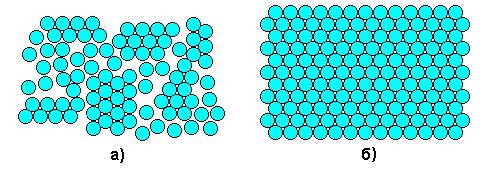

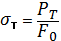
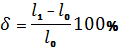
 – расчетная длина образца;
– расчетная длина образца; 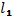 – длина расчетной части образца после разрыва.
– длина расчетной части образца после разрыва. 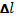 в 1 см …см, нагрузки P в 1 см …кгс. Нагрузка, соответствующая пределу точности, PT= … кгс. Наибольшая нагрузка, предшествующая разрушению образца, PПЧ=… кгс.
в 1 см …см, нагрузки P в 1 см …кгс. Нагрузка, соответствующая пределу точности, PT= … кгс. Наибольшая нагрузка, предшествующая разрушению образца, PПЧ=… кгс.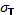 = … кгс/мм2 (… Н/мм2)
= … кгс/мм2 (… Н/мм2)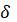 , %
, %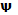 , %
, %