
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Истинное и кажущееся равновесие
Многие химические реакции не протекают до конца, то есть исходные реагенты не полностью превращаются в продукты. Такие реакции начинают протекать в одном направлении, затем за счет взаимодействия продуктов реакции идут в обратном направлении, то есть являются двусторонними. Их называют химически обратимыми.
Химические реакции могут быть практически необратимыми и совершенно необратимыми. Например, реакция Н2+½ О2 = Н2О
практически необратима; лишь при температурах в несколько тысяч градусов вода распадается на Н2 и О2. Примером совершенно необратимых реакций является разложение взрывчатых веществ, для которых
Pb(N3)2 ®Pb + 3N2.
Необратимости способствуют такие условия, при которых один из продуктов является малорастворимым и выпадает в осадок, либо образуется в виде газообразного вещества, удаляемого из системы, либо является слабодиссоциирующим в реакционной среде веществом. Любая реакция может протекать самопроизвольно только в направлении, которое приближает систему к состоянию равновесия, в котором силы, вызывающие процесс, уравновешиваются.
Химическим равновесием называют не изменяющееся во времени при постоянном давлении, объеме и температуре состояние системы, содержащей вещества, способные к взаимодействию. Как было показано, при некоторой температуре энтальпийный и энтропийный факторы уравниваются, то есть
В этом случае DG = 0,что является термодинамическим условием химического равновесия. Существуют различные виды равновесных состояний.
Истинное (устойчивое, термодинамическое) равновесие системы характеризуется неизменностью во времени. При этом система изменяет состояние соответственно внешним воздействиям и его характеристики (например, концентрации) не зависят от того, с какой стороны система подходит к равновесию.
Устойчивое равновесие является динамическим. Равновесное состояние сохраняется во времени не вследствие отсутствия или прекращения процесса, а вследствие протекания его одновременно в двух противоположных направлениях с одинаковой скоростью.
Кажущееся (метастабильное, заторможенное) равновесие отличается тем, что для него выполняется только один признак – неизменность во времени. Например, смесь Н2 и О2 может практически бесконечно находиться в неизменном, метастабильном состоянии. Однако это не истинное равновесие, так как, раз начавшись (от искры или действия платинового катализатора, который при этом химически не изменяется), процесс взаимодействия идет быстро и практически до конца с выделением тепла:
H2 (г) + 1/2О2(г) = H2О (г); DНo298= -241 кДж.
Константа равновесия
Количественной характеристикой равновесного состояния является величина, называемая константой равновесия (К). В состоянии равновесия состав системы не меняется, то есть концентрации реагентов и продуктов реакции остаются постоянными (они называются равновесными). В 1864 году норвежские ученые К. Гульдберг и П. Вааге сформулировали закон действующих масс (ЗДМ): отношение произведения равновесных концентраций продуктов реакции в степенях, равных стехиометрическим коэффициентам, к произведению равновесных концентраций исходных веществ (реагентов) в степенях, равных стехиометрическим коэффициентам, при Т = const, является величиной постоянной. Например, для обратимой реакции
закон действующих масс имеет вид
или, если вещества – газы,
где [A], [В] и т. д. – равновесные концентрации веществ (моль/л); РА, РВ и т.д... – парциальные давления газов.
закон действующих масс имеет вид
Если все реагенты газообразны и их поведение подчиняется законам идеальных газов, то связь между КР и КС можно выразить уравнением:
где Δn - изменение числа молей газов в результате реакции; так что для рассматриваемой реакции Δn = (1 + 3) - 2 = 2 и Константа равновесия обладает тем свойством, что она не зависит от концентрации реагентов и продуктов. Это значит, что увеличение концентрации одного из веществ приводит к такому изменению концентрации других веществ, что константа равновесия остается неизменной. Если увеличить [A], то [B] уменьшится, а [C] и [D] увеличатся. В то же время константа равновесия зависит от температуры: с увеличением температуры она увеличивается для эндотермических и уменьшается для экзотермических реакций.
В выражение ЗДМ включаются только концентрации растворов, концентрации или давления газов; конденсированные вещества в собственной фазе (Н2Ож, КСlт и т.п.) в формулу не включаются. Например, для реакции
Fe2O3 (т) + 3H2 (г) = 2Fe (т) + 3H2O (ж);
Так как Fe2O3 , Fe и H2O - конденсированные вещества, то равновесие реакции зависит только от концентрации Н2. Константа равновесия - важнейшая термодинамическая характеристика реакции. По величине константы равновесия (К) можно судить о степени протекания реакции. При очень большом значении К равновесие реакции сильно сдвинуто вправо (в сторону продуктов), а при очень низком значении К реакция протекает в очень незначительной степени и равновесная смесь содержит преимущественно реагенты. Кроме того, по величине К можно вычислять концентрации реагентов и продуктов при достижении равновесия и, как будет показано ниже, DG реакции.
|
||||||
|
Последнее изменение этой страницы: 2021-04-04; просмотров: 95; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.117.81.240 (0.006 с.) |
 аА + bВ сС + dD
аА + bВ сС + dD
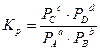 ,
, Например, для реакции 2СН4 (г) С2Н2 (г) + 3Н2 (г)
Например, для реакции 2СН4 (г) С2Н2 (г) + 3Н2 (г) или
или 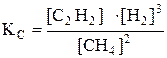 .
. ,
,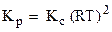 .
. .
.


