
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Расчет объемов воздуха и продуктов сгорания топлива.
Расчеты выполняются для теоретических условий горения (α=1) и для расчетных значений α в зависимости от типа горелочного устройства и вида сжигаемого топлива. Теоретически необходимый объем воздуха при α=1: - для твердого и жидкого топлива, м3/кг - для газообразного топлива, м3/ м3
где m и n - числа атомов углерода и водорода в химической формуле углеводородов, которые входят в состав топлива. Теоретические объемы продуктов сгорания при α = 1 в случае твердых и жидких топлив, м3/кг: - объем трехатомных газов - объем двухатомных газов - объем водяных паров Соответствующие формулы для случая газообразных топлив, м3/ м3:
где d в.тл .- влагосодержание топлива, отнесенное к 1 м3 сухого газа (г/м3). При температуре топлива 10 ºC можно принять d в.тл . = 10 г/м3. Объем продуктов сгорания топлива при α >1 определяется в таблице1. Таблица 1 - Характеристика продуктов сгорания в поверхностях нагрева
Энтальпии воздуха и продуктов сгорания.
Энтальпии теоретического объема воздуха и продуктов сгорания, отнесенные к 1 кг или 1 м3 сжигаемого топлива при текущей температуре q” оC, кДж/кг (кДж/ м³): I I
где (сt)в, (cq) Расчет по определению энтальпий теоретического объема воздуха и продуктов сгорания топлива сводят в таблицу 2. Таблица 2 - Энтальпии теоретического объема воздуха и продуктов сгорания топлива, кДж/м3
Энтальпию продуктов сгорания на 1 кг или 1 м3 топлива при α">1, кДж/кг (кДж/ м³), определяют по формуле:
I
Расчет по определению энтальпии продуктов сгорания топлива при разных температурах газов в разных газоходах ведется в таблице 3.
Таблица 3 - Энтальпии продуктов сгорания топлива в газоходах, кДж/кг(кДж/ м3)
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-04-05; просмотров: 49; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.226.169.94 (0.007 с.) |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
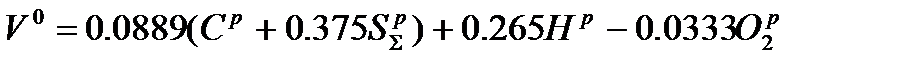 (2)
(2) [0.5СО + 0.5Н2 +1.5Н2S+S(m + 0.25n)CmHn – O2] (3)
[0.5СО + 0.5Н2 +1.5Н2S+S(m + 0.25n)CmHn – O2] (3) (4)
(4)
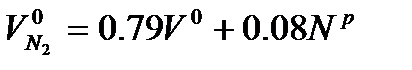 (5)
(5) (6)
(6) (7)
(7) (8)
(8) (9)
(9) = V N2/Vr;
-трехатомных газов rRO2 = V RO2/Vr;
- водяных паров r
= V N2/Vr;
-трехатомных газов rRO2 = V RO2/Vr;
- водяных паров r  = VH2O/Vr
= VH2O/Vr
 = Vо(сt)в (10)
= Vо(сt)в (10) =I
=I  +I
+I  +I
+I 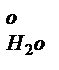 = V
= V  ·(cq)
·(cq)  + V
+ V  ·(cq)
·(cq) 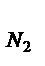 + V
+ V 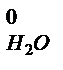 ·(cq)
·(cq) 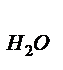 (11)
(11)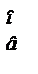
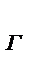 =I
=I  (12)
(12) 


