Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Способы разделения смесей, используемые в промышленности.
Способы разделения смесей, используемые в промышленности немногим отличаются от лабораторных способов, описанных выше. Для разделения нефти чаще всего используют ректификацию (перегонку). Более подробно этот процесс описан в теме "Переработка нефти". Самыми распространенными методами очистки и разделения веществ в промышленности являются отстаивание, фильтрация, сорбция и экстракция. Методы фильтрации и отстаивания проводятся аналогично лабораторным метода, с той разницей, что используются отстойники и фильтры больших объемов. Чаще всего, эти методы используются для очистки сточных вод. Поэтому рассмотрим подробнее методы экстракции и сорбции. Термин «экстракция» приложим к различным фазовым равновесиям (жидкость – жидкость, газ – жидкость, жидкость – твердое тело и т.д.), но чаще его применяют к системам жидкость – жидкость, поэтому чаще всего можно встретить такое определение: Определение Экстракция - метод разделения, очистки и выделения веществ, основанный на процессе распределения вещества между двумя несмешивающимися растворителями. Одним из несмешивающихся растворителей обычно является вода, вторым – органический растворитель, однако это не обязательно. Экстракционный метод отличается универсальностью, он пригоден для выделения почти всех элементов в различных концентрациях. Экстракция позволяет разделять сложные многокомпонентные смеси зачастую эффективнее и быстрее, чем другие методы. Выполнение экстракционного отделения или разделения не требует сложного и дорогостоящего оборудования. Процесс может быть автоматизирован, при необходимости им можно управлять на расстоянии. Определение Сорбция - метод выделения и очистки веществ, основанный на поглощении твердым телом (адсорбция) или жидкостью-сорбентом (абсорбция) различных веществ (сорбатов) из газовых или жидких смесей. Чаще всего в промышленности методы абсорбции используют для очистки газовоздушных выбросов от частиц пыли или дыма, а также токсичных газообразных веществ. В случае поглощения газообразных веществ, между сорбентом и растворенным веществом может протекать химическая реакция. Например, при поглощении газообразного аммиака NH3 раствором азотной кислоты образуется нитрат аммония NH4NO3 (аммиачная селитра), который можно использовать в качестве высокоэффективного азотного удобрения.
Определение Процесс, при котором происходит абсорбция растворенного вещества за счет протекания химической реакции, называется хемосорбцией. Адсорбцию также используют для очистки воды от химических растворимых примесей. Например, фильтры для питьевой воды работают на принципе адсорбции слоем активированного угля с ионами серебра. Помимо поглощения всем объемом жидкого сорбента (абсорбции), и поверхностным слоем сорбента (адсорбции), выделяют также сорбцию твердого тела или расплава (окклюзию). При сорбции паров твердыми веществами часто происходит капиллярная конденсация.
Массовая доля растворённого вещества это безразмерная величина, равная отношению массы растворённого вещества к общей массе раствора: ωв-ва=mв-ва/mр-ра(⋅100%) Объемная доля (для газов) Для характеристики газовой смеси используют похожую величину - объемную долю. Объемная доля равна отношению объема газа к общему объему газовой смеси. Выражается в % или является безразмерной величиной:
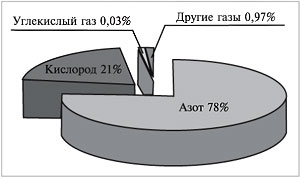
Самым распространенным примером газовой смеси можно смело назвать воздух. Если бы нам удалось разделить 100 л воздуха на отдельные газообразные компоненты, мы получили бы около 78 л азота, 21 л кислорода, 30 мл углекислого газа, в оставшемся объеме содержались бы так называемые благородные газы (главным образом аргон) и некоторые другие. Рассчитаем объемную долю каждого газа:
φ(N2)+φ(O2)+φ(CO2)+φ(др.газов)=78%+21%+0,03%+0,97%=100% Тот воздух, который мы выдыхаем, гораздо беднее кислородом (его объемная доля снижается до 16%), зато содержание углекислого газа возрастает до 4%. Такой воздух для дыхания уже непригоден. Вот почему помещение, в котором находится много людей, надо регулярно проветривать. Мольная доля Мольная доля растворенного вещества показывает, какую часть от суммарного количества всех веществ, входящих в состав раствора, составляет количество растворенного вещества В. Находят мольную долю растворенного вещества c как отношение числа моль растворенного вещества А к общему числу моль всех веществ в растворе:
η(A)= n(A) *100% n(A)+n(B) Молярная концентрация C показывает, сколько моль растворённого вещества содержится в 1 литре раствора. Cв-ва=nв-ва/V=mв-ва/Mв-ва ⋅V
где Mв-ва - молярная масса растворенного вещества г/моль. Молярная концентрация измеряется в моль/л и обозначается "M". Например, 2 M NaOH - двухмолярный раствор гидроксида натрия. Один литр такого раствора содержит 2 моль вещества или 80 г (M(NaOH) = 40 г/моль). Кроме перечисленных способов выражения концентрации вещества следует также отметить моляльность и нормальность раствора. В аналитической химии часто используют титр. Все перечисленные способы выражения концентрации обобщены в таблице:
НОРМАЛЬНАЯ КОНЦЕНТРАЦИЯ (нормальность раствора) Нормальность раствора обозначает число грамм-эквивалентов данного вещества в одном литре раствора или число миллиграмм-эквивалентов в одном миллилитре раствора. Cн=n(экв.)/V=C⋅z где z -число эквивалентности, C - молярная концентрация Определение Грамм - эквивалентом вещества называется количество граммов вещества, численно равное его эквиваленту. Для сложных веществ - это количество вещества, соответствующее прямо или косвенно при химических превращениях 1 грамму водорода или 8 граммам кислорода. z(основания) = М(основания) / число замещаемых в реакции гидроксильных групп z(кислоты) = М(кислоты) / число замещаемых в реакции атомов водорода z(соли) = М(соли) / произведение числа катионов на его заряд Величины нормальности обозначают буквой "Н". Например, децинормальный раствор серной кислоты обозначают "0,1 Н раствор H2SO4". Так как нормальность может быть определена только для данной реакции, то в разных реакциях величина нормальности одного и того же раствора может оказаться неодинаковой. Так, одномолярный раствор H2SO4 будет однонормальным, когда он предназначается для реакции со щёлочью с образованием гидросульфата NaHSO4, и двухнормальным в реакции с образованием Na2SO4. МОЛЯЛЬНАЯ КОНЦЕНТРАЦИЯ (моляльность раствора) Концентрацию раствора можно выразить количеством молей растворённого вещества в 1000 г растворителя. Такое выражение концентрации называют моляльностью раствора. Моляльная концентрация (моляльность) равна числу молей растворенного вещества в 1 килограмме (1000 г.) растворителя. Единица измерения - [моль/кг]: m=n(в-ва)/m(р-ра) ТИТР показывает, сколько граммов растворённого вещества X содержится в 1 мл или в 1 см3 раствора:
Т=m(в-ва)/V(р-ра)
|
||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-03-09; просмотров: 102; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.141.24.134 (0.011 с.) |