Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Приготовление нервно-мышечногоСтр 1 из 9Следующая ⇒
ПРИГОТОВЛЕНИЕ НЕРВНО-МЫШЕЧНОГО ПРЕПАРАТА И ПРЕПАРАТА ИЗОЛИРОВАННОЙ ИКРОНОЖНОЙ МЫШЦЫ ЛЯГУШКИ
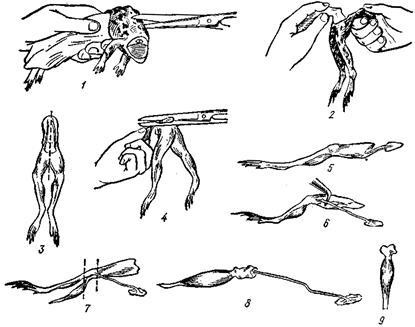
Выделенные из организма мышцы и нервные волокна при условиях орошения их физиологическим раствором могут длительное время сохранять свои физиологические свойства, что дает возможность на изолированных препаратах исследовать общие закономерности распространения возбуждения, механизмы синаптической передачи, мышечного сокращения и ряд других процессов. Для работы необходимы: набор препаровальных инструментов и материалов, раствор Рингера. Объект исследования – лягушка. Проведение работы. Обездвиживают лягушку. Ножницами перерезают позвоночник примерно посредине туловища (рис. 77, 1) и отделяют верхнюю половину тела. Удаляют остатки внутренностей пинцетом и ножницами. Захватив одной рукой через салфетку остаток позвоночника, а другой – край кожи со спины, снимают кожу с обеих лапок (рис.77, 2), получают препарат двух задних лапок лягушки (рис. 77, 3). Далее готовят препарат одной лапки. Для этого, держа препарат так, чтобы лапки висели вниз под прямым углом к позвоночнику, ножницами осторожно вырезают копчиковую кость – уростиль, который при таком положении препарата выдается кверху (рис. 77, 4). Затем, стараясь не задеть нервных стволиков крестцового сплетения, продольно разрезают по средней линии позвоночник и все другие ткани, чтобы отделить лапки друг от друга. Следующим этапом работы является препаровка икроножной мышцы и седалищного нерва. Подводят под ахиллово сухожилие браншу ножниц, отделяют сухожилие по всей длине и подрезают ниже сесамовидной косточки. Захватив сухожилие пинцетом, оттягивают мышцу в сторону, разрывая фасции, связывающие ее с другими тканями. Для препаровки нерва бедро располагают задней поверхностью вверх. Мышцы разводят и двумя стеклянными крючками отпрепаровывают лежащий в глубине седалищный нерв по всей его длине (рис. 77, 5, 6). Приподняв нерв, подрезают ножницами окружающие ткани. Перерезают лапку выше и ниже коленного сустава (рис. 77, 7,8, указано пунктиром) – получают нервно-мышечный препарат икроножной мышцы и седалищного нерва. До начала работы помещают его в чашку Петри, завернув в вату, смоченную раствором Рингера. На конце нерва рекомендуется сохранять небольшой участок позвоночника, поскольку за него удобно брать пинцетом, помещая нерв на электроды, и, кроме того, отсечение нерва от позвоночника наносит дополнительную травму. Для приготовления препарата изолированной мышцы нерв отсекают полностью у самой мышцы (рис. 77, 9).
Рис. 77. Приготовление нервно-мышечного препарата (икроножная мышца сседалищным нервом) и изолированной икроножной мышцы (пояснения в тексте) Р а б о т а 2 ИССЛЕДОВАНИЕ ЗАВИСИМОСТИ АМПЛИТУДЫ СОКРАЩЕНИЯ ИЗОЛИРОВАННОЙ МЫШЦЫ ОТ СИЛЫ РАЗДРАЖЕНИЯ
Скелетная мышца состоит из большого количества отдельных мышечных волокон, обладающих различной возбудимостью, поэтому минимальные по силе раздражители приводят к возбуждению и сокращению только тех мышечных волокон, которые характеризуются самым низким порогом, т. е. самой высокой возбудимостью. По мере увеличения амплитуды раздражающего тока в сократительный процесс вовлекаются мышечные волокна с меньшей возбудимостью. В конечном итоге при максимальном раздражении происходит сокращение всех мышечных волокон, входящих в состав данной мышцы. Дальнейшее увеличение силы стимула не приводит к увеличению амплитуды сокращения. Для работы необходимы: вертикальный миограф, стимулятор, кимограф, универсальный штатив, набор препаровальных инструментов, пипетка, вата, раствор Рингера. Объект исследования – лягушка. Проведение работы. Готовят препарат икроножной мышцы (см. работу 1). Фиксируют мышцу в вертикальном миографе (рис. 79). Клеммы вертикального миографа соединяют с вы-
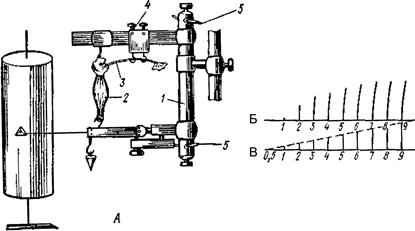
Рис. 79. Зависимость амплитуды сокращения икроножной мышцы лягушки от силы раздражения:
А – схема установки для закрепления и стимуляции мышцы: 1 – вертикальный миограф; 2 – мышца; 3 – нерв; 4 – электроды для стимуляции нерва; 5 – клеммы для подключения стимулятора; Б – запись мышечных сокращений: 1 – минимальное пороговое сокращение; 2–6 – субмаксимальные сокращения; 7 – 9 – максимальные сокращения: В – схема возрастания силы стимулов (от 0,5 до 9 усл. ед.); за единицу взята амплитуда порогового (1) стимула; 0,5 – подпороговый раздражитель; 1 – пороговый раздражитель; 2–6 – субмаксимальные раздражители; 7 – максимальный раздражитель; 8–9 – супермаксимальные раздражители
ходом стимулятора. Включают стимулятор в режиме периодического запуска импульсов с частотой 1 Гц и начинают плавно увеличивать амплитуду раздражающего стимула при неизменной длительности, равной 1 мс. Достигают пороговой величины стимула, при которой возникают минимальные по амплитуде сокращения мышцы. Далее продолжают увеличивать амплитуду стимула и убеждаются в том, что амплитуда сокращения пропорционально возрастает. В ходе эксперимента наступает момент, когда дальнейшее увеличение амплитуды раздражающего тока уже не приводит к увеличению амплитуды сокращения. Результаты работы и их оформление. Вклейте полученные миограммы в протокол. Сравните параметры раздражающих импульсов, при которых получают минимальные, средние и максимальные по амплитуде сокращения.
Р а б о т а 4 И СУММАЦИЯ
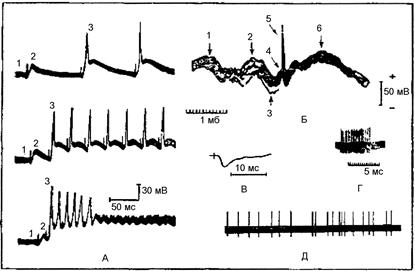
Одиночное мышечное сокращение – это реакция мышцы в ответ на одиночный пороговый или сверхпороговый стимул. При нанесении на мышцу во время одиночного сокращения второго раздражения наблюдается эффект суммации мышечных сокращений. Если второй стимул раздражает мышцу в фазу расслабления, то происходит неполная суммация, если он приходится на фазу сокращения – полная суммация. Для работы необходимы: фаль-аппарат, миограф, отметчик времени, универсальный штатив, набор препаровальных инструментов, пипетка, раствор Рингера, вата. Объект исследования – икроножная мышца лягушки. Проведение работы. Препарат икроножной мышцы лягушки закрепляют на крючках миографа. Фаль-аппарат (рис. 80, А) включают в сеть и устанавливают потенциометром Р1силу раз-
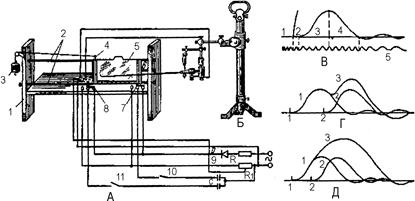
Рис. 80. Установка для записи развернутой кривой одиночного мышечного сокращения и суммации:
А – фаль-аппарат: 1 – рама; 2 – направляющие; 3 – груз для перемещения каретки; 4 – каретка; 5 – бумажная вставка для записи кривой; 6 – фиксатор каретки; 7, 8 – перекидные контакты; 9 – электрическая схема генерации одиночных стимулов (питание от сети); 10, 11 – выключатели; D – диод; R – сопротивление; Rt – переменное сопротивление; С – емкость; Б – штатив с вертикальным миографом и закрепленной мышцей; В – кривая одиночного мышечного сокращения: 1 – момент размыкания контактов; 2 – латентный период; 3 – фаза укорочения; 4 – фаза расслабления; 5 – отметка времени 10 мс; Г – неполная суммация; Д – полная суммация: 1, 2 – моменты стимуляции при замыкании первой и второй групп контактов и соответствующие развернутые кривые сокра- щения; 3 – кривая суммарного мышечного сокращения
дражения выше пороговой. Выключателем 10 замыкают контакты 7 первого раздражения. Снимают фиксатор с каретки фаль-аппарата и медленно перемещают ее рукой, при этом в момент замыкания контактов 7 на мышцу подается раздражение и она сокращается. Это сокращение из-за медленного движения каретки записывается в виде вертикальной линии, которая указывает момент нанесения раздражения (рис. 80, Б).Одновременно с этим записывается изолиния. Возвращают каретку в исходное положение. Отпускают фиксатор; каретка фаль-аппарата приводится в движение падающим грузом 3, при этом на бумаге записывается миограмма одиночного сокращения мышцы, под миограммой регистрируется отметка времени для расчета латентного периода 2, длительности фазы сокращения 3 и фазы расслабления 4 мышцы. Включают контакты второго раздражения 8 и устанавливают их в такое положение, чтобы это раздражение наносилось на мышцу во время ее расслабления. Записывают изолинию с двумя моментами нанесения раздражений при медленном перемещении рукой каретки фаль-аппарата. После этого последовательно регистрируют одиночные сокращения мышцы на первое и второе раздражения, соответственно замыкая контакты выключателей (сначала 10, потом 11), азатем сокращения мышцы на оба раздражения. Получают кривую неполной суммации мышечного сокращения (рис. 80, Г). Уменьшают расстояние между контактами, чтобы второе раздражение наносилось в фазу сокращения мышцы, и регистрируют сначала миограммы одиночных сокращений на первое и второе раздражения, а затем кривую полной суммации (рис. 80, Д).
Результаты работы и их оформление. Вклейте полученные кривые в тетрадь. Определите длительность латентного периода, фазы сокращения и фазы расслабления. Сравните амплитуду одиночного мышечного сокращения с амплитудами при неполной и полной суммации мышечных сокращений.
Р а б о т а 5 Гладкой мышцы Желудка лягушки (стрелкой указан момент нанесения одиночного стимула)
Для работы необходимы: вертикальный миограф, кимограф, стимулятор, набор препаровальных инструментов, пипетка, раствор Рингера. Объект исследования – лягушка. Проведение работы. Лягушку обездвиживают, разрушив головной и спиной мозг. Вскрывают брюшную полость и извлекают желудок. Из него вырезают кольцо шириной 4–5 мм. Кольцо в одном месте рассекают и с полоски снимают слизистую оболочку. Устанавливают горизонтальные штанги миографа в соответствии с длиной полоски. Если необходимо, полоску удлиняют с помощью лигатуры. Устанавливают наименьшую скорость вращения кимографа. Определяют с помощью стимулятора пороговую величину раздражения. Обычно используют импульсы длительностью 5–10 мс и амплитудой 30–50 В. Следует попытаться записать миограмму в ответ на одиночное раздражение. После этого в повторном опыте записывают миограмму в ответ на короткое ритмическое раздражение. Результаты работы и их оформление. Полученные кривые вклейте в тетрадь. Сравните величину порогового раздражителя, латентного периода начала сокращения и длительность фаз укорочения и расслабления гладкой мышцы с соответствующими показателями скелетной мышцы (см. работу 4).
Р а б о т а 7 ЯВЛЕНИЙ В ВОЗБУДИМЫХ ТКАНЯХ (ПЕРВЫЙ И ВТОРОЙ ОПЫТЫ Л. ГАЛЬВАНИ И ОПЫТ К. МАТТЕУЧИ)
Биоэлектрические явления в возбудимых тканях могут быть обнаружены как биологическим, так и физическим методом с помощью приборов. Хотя биологический метод в настоящее время утратил свое значение как метод исследования, для физиолога он всегда будет представлять интерес благодаря исключительной роли, какую он сыграл в истории открытия биоэлектрических явлений. Именно биологический метод позволил Гальвани впервые бесспорно доказать существование «животного электричества» и тем самым положить начало новому направлению в физиологии – учению об электрических процессах в организме.
Задача 1 Задача 2 Задача 3 МЫШЦЫ ЛЯГУШКИ
Если внутрь нервной или мышечной клетки ввести один электрод, а второй поместить в окружающем клетку растворе или ткани, то между электродами обнаруживается разность электрических потенциалов – мембранный потенциал покоя. Внутренняя область клетки при этом всегда электроотрицательна относительно наружной среды. Потенциал покоя измеряют как разность между потенциалами цитоплазмы и наружной среды клетки, поэтому он всегда обозначается со знаком минус. О существовании разности потенциалов свидетельствует скачок потенциала, возникающий в момент прокола электродом мембраны клетки. Если электроды соединены с помощью усилителя постоянного тока с осциллографом, то этот скачок потенциала вызывает резкое смещение луча осциллографа с изоэлектрической линии вниз (рис. 86). Для работы необходимы: лабораторный рН-метр (например, ЛПЧ-02), стеклянные микроэлектроды, заполненные ЗМ раствором КСl (диаметр кончика порядка 0,5–1 мкм), два серебряных электрода, микроманипулятор, камера из органического стекла для помещения и фик-
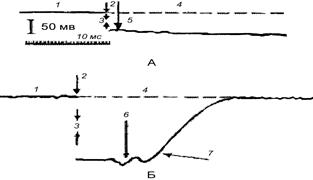
Рис. 86. Внутриклеточное отведение биопотенциалов от нервной (пирамидная клетка коры мозга – А) и мышечной клеток (поперечнополосатая мышца кошки – Б):
1 – внеклеточная запись; 2 – момент прокола мембраны и вхождения микроэлектрода в клетку; 3 – величина разности потенциалов между внутренней и наружной поверхностями мембраны (мембранный потенциал); 4 – линия; определяющая исходное (нулевое) значение потенциала; 5 – одиночный спонтанный разряд клетки; 6 – колебания, связанные с давлением микроэлектрода на внутреннюю поверхность мембраны мышечной клетки; 7 – момент прокола мембраны и выхода микроэлектрода из мышечной клетки
сации препарата, набор препаровальных инструментов, раствор Рин-гера. Объект исследования – лягушка. Проведение работы. Измерение мембранного потенциала мышечных волокон производят стеклянными микроэлектродами с помощью рН-метра, используемого как высокоомный милливольтметр. Необходимо включать в сеть рН-метр не менее чем за 1 ч до начала измерений. В работе используют портняжную мышцу лягушки. Лягушку обездвиживают. На сухожилие у колена накладывают лигатуру, а у сращения бедренных костей лигатуру накладывают на конец мышцы. Отпрепарированную мышцу укрепляют в камере из органического стекла внутренней стороной вверх, слегка растянув ее. Камеру заполняют раствором Рингера. Вскрывают оболочку мышцы, чтобы при введении не обламывался кончик микроэлектрода.
Камеру укрепляют на стеклянном столике от настольной лупы под бинокуляром. Стеклянный микроэлектрод, предварительно заполненный ЗМ раствором КСl, фиксируют в препаратоводителе, который укреплен на универсальном штативе над камерой для препарата. Препаратоводитель используют в качестве микроманипулятора для введения микроэлектрода в клетку. К входному кабелю рН-метра припаяны два серебряных электрода, которые непосредственно перед опытом хлорируются. Хлорирование проводят в 1%-ном растворе NaCl. Источником тока служит батарейка для карманного фонарика (4,5 В), анодом – оба серебряных электрода одновременно, катодом – графитовый стержень. Для регулирования силы пропускаемого тока в цепь включен реостат. Подбирают такую величину тока, чтобы за 2–3 с поверхность электрода покрылась ровным белым слоем AgCl. Затем один из серебряных электродов погружают в раствор КСl, который заполняет широкую часть микроэлектрода, а другой опускают в раствор Рингера, заполняющий камеру с мышцей. Перед началом введения микроэлектрода в мышцу ручку «Виды работ» рН-метра устанавливают в положение «рН». Переключатель «Пределы измерений» устанавливают в положение «2–6 рН», тогда шкала соответствует напряжению от 0 до 400 мВ с ценой деления 5 мВ. Опускают микроэлектрод в камеру с раствором Рингера и измеряют межэлектродный потенциал. После этого вводят микроэлектрод в мышечное волокно, медленно вращая микровинт препаратоводителя. О попадании электрода внутрь клетки судят по отклонению стрелки рН-метра. Измеряют мембранный потенциал у 10–15 мышечных волокон, причем перед каждым введением микроэлектрода сначала измеряют меж-электродный потенциал. Мембранный потенциал определяют как разность между потенциалом, возникшим при введении микроэлектрода в мышечное волокно, и межэлектродным потенциалом. Например, если межэлектродный потенциал равен +15 мВ, а после введения микроэлектрода стрелка рН-метра отклонилась на 95 мВ, то мембранный потенциал данного волокна равен 80 мВ. Результаты работы и их оформление. Вычислите среднее значение мембранного потенциала одиночного мышечного волокна скелетной мышцы лягушки. Обсудите природу мембранного потенциала.
Р а б о т а 9 СКЕЛЕТНОЙ МЫШЦЫ ЛЯГУШКИ
Возбуждение это сложный физико-химический процесс, в результате которого происходит кратковременное изменение электрического потенциала мембраны, которое называется потенциалом действия. Для внутриклеточных отведений потенциалов действия используют стеклянные микроэлектроды с диаметром кончика меньше микрона. Для работы необходимы: установка для микроэлектродных исследований, микроманипулятор, влажная камера, набор препаровальных инструментов, заранее заготовленные и заполненные ЗМ раствором КСl стеклянные микроэлектроды для внутриклеточных отведений. Объект исследования – лягушка. Проведение работы. Готовят нервно-мышечный препарат, помещают его во влажную камеру, фиксируя мышцу в растянутом состоянии. Закрепление микроэлектрода на катодном повторителе и введение электрода в одиночное волокно осуществляют так же, как описано в работе 8. Вводят микроэлектрод внутрь волокна, ориентируясь на возникновение скачка потенциала. После того как электрод будет введен в волокно, переводят осциллограф в ждущий режим работы (до этого момента осциллограф должен работать в непрерывном режиме при внутреннем запуске развертки). Все это необходимо для того, чтобы иметь возможность следить за появлением скачка потенциала при проколе микроэлектродом мембраны мышечного волокна. Подают импульс синхронизации от стимулятора на вход «внешнего запуска» осциллографа. Помещают двигательный нерв на стимулирующие электроды и подключают их к выходу стимулятора. Нанося на нерв вначале одиночные, а затем ритмические стимулы, подбирают их амплитуду и наблюдают на экране осциллографа возникающие потенциалы. Меняя частоту стимуляции, следят за характером наступающих при этом изменений. Результаты работы и их оформление. Запишите в протоколе опыта наблюдаемые на экране осциллографа изменения. По калибровочным отметкам измерьте амплитуду и длительность полученных потенциалов. Сравните наблюдаемые явления с записями, представленными на рис. 87, А.
Р а б о т а 10 ДЕЙСТВИЯ ОТ НЕЙРОНОВ КОРЫ БОЛЬШИХ ПОЛУШАРИЙ КРЫСЫ
Потенциалы действия можно зарегистрировать при внеклеточном отведении, когда отводящий электрод располагают вблизи от одиночной клетки или группы клеток. Для внекле-
Рис. 87. Внутриклеточные и внеклеточные отведения потенциалов мышечных и нервных клеток:
А – внутриклеточное отведение потенциалов от одиночного мышечного волокна поперечно-полосатой мышцы (по А. И. Шаповалову): 1 – артефакт раздражения; 2 – потенциал концевой пластинки; 3 – потенциал действия мышечного волокна (частота стимуляции увеличивается от верхней к нижней записи); Б – внутриклеточное отведение потенциалов от пирамидного нейрона V слоя коры головного мозга кошки: 1 – момент стимуляции седалищного нерва; 2 – деполяризация мембраны клетки; 3 – гиперполяризация мембраны клетки; 4 – возбуждающий постсинаптический потенциал; 5 – потенциал действия; 6 – следовой деполяризационный потенциал; В – тормозной постсинаптический потенциал нервной клетки; Г, Д – внеклеточные отведения ритмических разрядов нейронов коры больших полушарий головного мозга кошки
точного отведения можно использовать как металлические, так и стеклянные микроэлектроды диаметром около 5 мкм. Для усиления потенциалов применяют усилитель переменного тока, при этом отводящие электроды могут быть подключены непосредственно к входу усилителя (без катодного повторителя). Для работы необходимы: установка для микроэлектродных исследований, осциллограф, стереотаксический прибор с микроманипулятором, установка для искусственного дыхания, набор хирургических инструментов и материалов, микроэлектроды для внеклеточных отведений, 2%-ный раствор новокаина, миорелаксин. Объект исследования – крыса. Проведение работы. Перед началом эксперимента крысе внутримышечно вводят миорелаксин в дозе 5–7 мг/кг и немедленно переводят ее на искусственное дыхание. Обездвиженное животное фиксируют в стереотаксисе. Для обезболивания в мягкие ткани над черепом вводят 2%-ный раствор новокаина, затем удаляют мягкие ткани и надкостницу и производят трепанацию черепа в области сенсомоторной коры. Вскрывают твердую мозговую оболочку так, чтобы обнажить поверхность коры больших полушарий. С помощью микроманипулятора кремальерой грубого перемещения по вертикали подводят электрод к поверхности коры и начинают медленно погружать его в мозг, пользуясь кремальерой микрометрического механизма. При этом катодный осциллограф должен работать в режиме внутреннего запуска. В период поиска разряжающихся нейронов следует пользоваться медленной разверткой, а когда нейрон (или группа нейронов) будет найден, включать быструю развертку. Если в процессе однократного прохождения электродом коры на глубину 1–1,5 мм «работающий» нейрон не будет найден, всю процедуру следует повторить. Результаты работы и их оформление. Зарисуйте схему установки и опишите принцип ее действия. Проанализируйте качественные и количественные характеристики потенциала действия. Зарисуйте полученные кривые.
Р а б о т а 11 НЕРВНЫХ КЛЕТОК В УСЛОВИЯХ ПЕРЕЖИВАЮЩИХ СРЕЗОВ МОЗГА
Переживающий срез мозга млекопитающих – это клеточно-тканевая модель центральной нервной системы, сохраняющая основные нейрональные элементы и их связи такими же, как и в соответствующем отделе мозга. По истечении определенного периода инкубации в растворе, срез становится электрофизиологически активным и позволяет в течение нескольких часов изучать импульсную активность отдельных нейронов или нейрональных сетей под влиянием различных фармакологических агентов и биологически активных веществ, а также целого ряда экстремальных факторов: гипо-ксии, гипер- и гипотермии, лазерного и электромагнитного излучения. В настоящее время срезы мозга как экспериментальная модель широко используется в различных научных лабораториях мира для изучения функции отдельных нервных клеток в условиях их полной изоляции от интегрирующих влияний всего мозга и организма в целом. Как правило, используются срезы мозжечка, гиппокампа, коры больших полушарий, гипоталамуса, спинного мозга. Для работы необходимы: перфузионная камера с прозрачным дном (рис. 88, Б), вмонтированная в столик инвертированного микроскопа, усилитель биопотенциалов с катодным повторителем, осциллограф, частотный анализатор, самописец, микроманипулятор, стеклянные микропипетки, заполненные ЗМ раствором NаСl, с диаметром кончика 1–2 мкм и сопротивлением 7–20 мОм, термостатирующее устройство для подогрева перфузата до 35–36 оС, раствор Эрла (рН 7,3–7,4), карбоген (95% О2 и 5% СО2), эфир, препаровальный набор ин-струментов. Объект исследования – мыши, крысы.
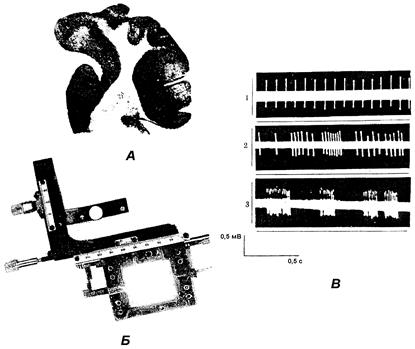
Рис. 88. Регистрация импульсной активности нейронов в срезе мозжечка крысы:
А – срез мозжечка крысы, 500 мкм. Проекция через фотоувеличитель; Б – перфузионная камера; В – типы импульсной активности нейронов мозжечка в срезе: 1 – непрерывный тип; 2 – непрерывно-пачечный; 3 – пачечный тип
Проведение работы. Под легким эфирным наркозом проводится препаровка кожи головы и костей черепа. Кусочком лезвия безопасной бритвы, фиксированным в зажиме Кохера в сагиттальной плоскости под визуальным контролем, готовят срезы мозжечка толщиной 300–500 мкм, включающие в себя кору мозжечка, подкорковые и вестибулярные ядра (см. рис. 88). Вся процедура приготовления срезов должна длиться не более 2–3 мин. В теменной области в той же плоскости готовят срезы коры больших полушарий. Для изготовления срезов гиппокампа глазным скальпелем снимают зрительную кору, после чего открывается доступ к гиппокампу. Срезы гипоталамуса берут в области проекции дорсомедиальных ядер. Затем срезы помещают в перфузионную камеру с прозрачным дном в тефлоновые кольца – ограничители с выемками для протока жидкости. Сосуд с перфузионной жидкостью (раствор Эрла) устанавливают на 1 м выше камеры со срезами и с помощью полиэтиленовых трубок соединяют с входом в перфузионную камеру. Отток жидкости производится через выходную трубку в сосуд, расположенный ниже камеры, в которую поступает уже подогретый до 35–36 °С с помощью устройства с регулируемым подогревом раствор, через который в течение всего эксперимента пропускается карбоген. В инкубационном растворе срезы мозжечка и гиппокампа находятся 40–60 мин, а срезы коры и гипоталамуса – 1,5 ч, после чего производится регистрация спонтанной импульсной активности нейронов, к которым с помощью микроманипулятора под визуальным контролем и контролем инвертированного микроскопа или лупы подводится стеклянный микроэлектрод. Для регистрации импульсной активности используется обычная электрофизиологическая установка. Импульсную активность можно наблюдать визуально на экране осциллографа, проводить фоторегистрацию или записывать гистограмму на чернильно-пишущем самописце. Результаты работы и их оформление. Проанализируйте полученные данные, укажите тип активности нейрона (непрерывный, пачечный или непрерывно-пачечный). Измерьте амплитуду импульсов и подсчитайте их частоту (типичные кривые см. на рис. 88, В).
Р а б о т а 12 ИЗУЧЕНИЕ ДЕЙСТВИЯ КУРАРЕ НА ОРГАНИЗМ ЖИВОТНОГО
Кураре представляет собой комплекс алкалоидов, способных блокировать передачу нервных импульсов в нервно-мышечных синапсах поперечно-полосатой мускулатуры. При поступлении в кровь кураре избирательно действует на постсинаптическую мембрану мионевральных синапсов скелетных мышц. Механизм действия кураре сводится к блокированию Н-холинорецепторов постсинаптической мембраны поперечно-полосатых мышц, поэтому выделяющийся в окончаниях двигательных нервных волокон ацетилхолин не вызывает развития деполяризационного постсинаптического потенциала на постсинаптической мембране поперечно-полосатого мышечного во-локна. Прямое раздражение мышцы или отдельного мышечного волокна вызывает сокращение и при действии кураре.
Задача 1 Задача 2 НЕРВНОГО СТВОЛА
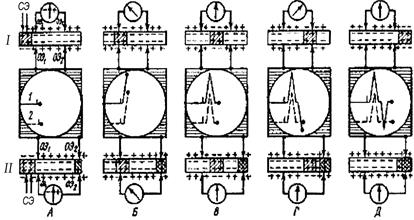
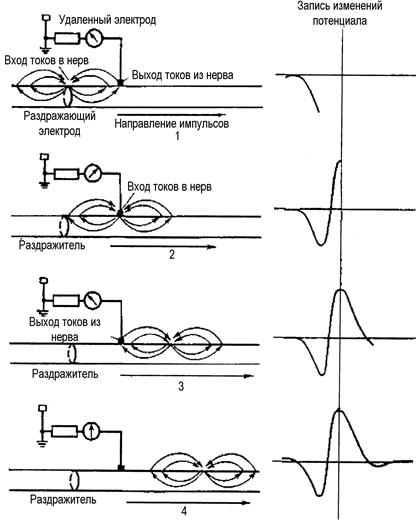
При внеклеточном отведении от нервного ствола регистрируют не изменение потенциала на мембране, а падение напряжения на внеклеточном межэлектродном участке, вызванное протеканием локальных токов вдоль наружной поверхности аксонов от покоящихся участков к активному. С этим связан рост амплитуды регистрируемого внеклеточного потенциала действия (ПД) при увеличении числа возбужденных аксонов. Характер кривой ПД нерва во многом определяется условиями его отведения. Известны два основных способа отведения ПД нерва: 1) если оба электрода располагаются на неповрежденной поверхности нерва (биполярное отведение), то в этом случае ПД регистрируется в виде двухфазного колебания (рис. 89, 1); 2) если один из отводящих электродов располагают на неповрежденном участке нерва, а другой – на умерщвленном участке или на какой-либо неактивной ткани (униполярное отведение). Регистрируемый при униполярном отведении ПД имеет вид однофазного колебания (рис. 89, 2). Представленная на рис. 89 схема поясняет механизм возникновения двух- и однофазного ПД. Под влиянием раздражения (рис. 89, А), наносимого с помощью стимулирующих электродов (СЭ), в нерве возникает возбуждение (деполяризация). Перемещаясь вдоль нерва, оно достигает первого из отводящих электродов (ОЭ1). Так как возбужденный участок по отношению к невозбужденному электроотрицателен, а также вследствие того, что второй из отводящих электродов (ОЭ2) расположен на покоящемся участке, между электродами ОЭ1 и
Рис. 89. Схема формирования кривой потенциала действия нерва в непроводящей среде при биполярном (I) и униполярном (II) способах отведения (пояснения в тексте)
и ОЭ2 возникает разность потенциалов. Под ее влиянием луч осциллографа будет отклоняться, регистрируя отрицательное колебание потенциала (рис. 89, Б). В зависимости от того, как подключены отводящие электроды к входу усилителя осциллографа, это колебание может быть направлено вверх или вниз от изолинии. Принято так подключать отводящие электроды, чтобы отрицательное колебание отклоняло луч вверх. Если к электродам подключен гальванометр, то в нем произойдет отклонение стрелки влево. При дальнейшем движении ПД возбужденный участок будет находиться между электродами, т. е. разности потенциалов между ОЭ1 и ОЭ2 не будет, в результате этого луч осциллографа вернется к изолинии (рис. 89, В). Когда возбужденный участок достигнет ОЭ2, этот электрод становится отрицательным к ОЭ1, что вызовет отклонение луча осциллографа вниз (рис. 89, Г). Когда возбужденный участок минует электрод ОЭ2, разности потенциалов между ОЭ2 и ОЭ1 не будет, и луч осциллографа вернется к изолинии (рис. 89, Д). Так формируется двухфазный потенциал действия. При униполярном отведении возбуждение под второй электрод не проводится (нерв под ним умерщвлен или проведение блокировано) – потенциал действия представлен однофазным отклонением луча осциллографа (см. рис. 89, 2). Приведенные схемы отражают механизм формирования потенциалов, когда нерв помещен в непроводящую среду. В естественных условиях, когда нерв окружен тканями, и в искусственных – при помещении его в электролит – процессы формирования потенциалов протекают более сложно. На рис. 90 приведены этапы формирования кривой ПД при униполярном способе отведения для тех случаев, когда нерв находится в проводящей среде, например во влажной камере. Индифферентный электрод располагают в отдаленной точке проводящей среды или помещают на неактивной ткани. При отведении в таких случаях приходится учитывать ряд факторов, не играющих роли при условии, что нерв окружен непроводящей средой: 1. Распространение потенциала по нерву связано не только с передвижением ионов через мембрану в отдельных волокнах, но и с перемещением их от неактивных участков к активным и обратно (анионы двигаются к покоящимся участкам, катионы – к возбужденным). 2. Распространение потенциала сопровождается возникновением местных токов между нервом и окружающими тканями. В фазу деполяризации мембран токи текут и по направлению к нерву, а в фазу реполяризации – в обратном направлении. Проходя через окружающие ткани, они вызывают появление вторичных полюсов, которые, в свою очередь, влияют на динамику местных потенциалов и на характер электрического поля, возникающего вокруг нерва.
Рис. 90. Этапы формирования кривой потенциала действия нерва (в проводящей среде или при отведении in situ ) ОПРЕДЕЛЕНИЕ СКОРОСТИ ДВУСТОРОННЕЕ ПРОВЕДЕНИЕ ВОЗБУЖДЕНИЯ ПО НЕРВУ
Ток действия, возникший в одном из участков отдельного нервного волокна, вызывает развитие возбуждения в соседнем участке и т. д. Возбуждение может распространяться по нервному волокну и по нерву в обоих направлениях от раздражаемого участка.
Задача 1 Возбуждения
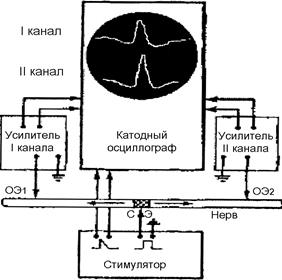
Доказать двустороннее распространение возбуждения по нерву от раздражаемого участка можно с помощью осиллографа, который регистрирует потенциал действия в разных участках раздражаемого нерва. Для работы необходимы: установка для регистрации ПД нервного ствола (два усилителя переменного тока, двухканальный катодный осциллограф, стимулятор), стимулирующие и отводящие электроды, нембутал, раствор Рингера. Объект исследования – кошка. Проведение работы. Проверяют готовность аппаратуры к работе. После наркотизации нембуталом (40 мг/кг) отпрепаровывают у кошки седалищный нерв одной из конечностей на максимальную длину, не нарушая его целостности. Две пары отводящих электродов располагают на проксимальном и дистальном концах обнаженного нерва, а раздражающий электрод – строго посередине между ними. Подключают раздражающий электрод к стимулятору, а отводящие электроды – к усилителям (рис. 92). При раздражении нерва ПД регистрируется по обе стороны от места стимуляции. Данную работу можно проводить, используя один усилитель и однолучевой осциллограф. В этом случае о двустороннем проведении возбуждения по нервному стволу будет свидетельствовать появление ПД в центральном конце седалищного нерва и сокращение мышц задней конечности, указывающее на возникновение возбуждения в периферическом конце нерва. Результаты работы и их оформление. Запишите опыт в протокол и зарисуйте схему установки. Отметьте конфигурацию потенциалов, регистрируемых от отводящих электродов по обе стороны от раздражающего электрода. Сравните параметры потенциалов действия и проанализируйте их.
Рис. 92. Схема установки для доказательства двустороннего проведения возбуждения по нерву (пояснения см. в тексте)
Задача 2 Возбуждения Двустороннее распространение возбуждения можно наблюдать и визуально, т. е. без использования приборов. Для работы необходимы: набор препаровальных инструментов, стимулятор, стимулирующие электроды, раствор Рингера. Объект исследования – лягушка. Проведение работы. Проверяют готовность стимулятора к работе. Обездвиживают лягушку, разрушив головной и спинной мозг. Снимают кожу с бедра и голени одной из лапок лягушки, отпрепаровывают икроножную мышцу и выделяют ахиллово сухожилие, не отрезая мышцу в области коленного сустава. Фиксируют лягушку на препаровальном столике с помощью булавок спинкой вверх. Раздвигают мышцы бедра и обнажают седалищный нерв. Стараясь минимально травмировать нерв, подводят под него лигатуру. Накладывают электроды на седалищный нерв. Через переключатель электроды соединяют с выходом стимулятора. Постепенно увеличивая амплитуду стимулирующих импульсов, определяют величину порогового раздражения для икроножной мышцы. Затем, постепенно увеличивая силу стимуляции, наблюдают сокращения мышц бедра, которые прилегают к нерву, и определяют порог их раздражения Результаты работы и их оформление. Зарисуйте схему эксп
|
|||||||||
|
Последнее изменение этой страницы: 2021-03-09; просмотров: 305; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.133.131.168 (0.136 с.) |