
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Нижегородский государственный техническийСтр 1 из 6Следующая ⇒
НИЖЕГОРОДСКИЙ ГОСУДАРСТВЕННЫЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ Кафедра "Общая и неорганическая химия" Э лементы химической термодинамики в курсе общей химии
Методические указания к практическим занятиям по курсу химии для химических и нехимических специальностей (Выпуск № 2) Нижний Новгород 2009 Составители: В.И.Наумов, Ж.В. Мацулевич, Г.А. Паничева, Т.В. Сазонтьева. УДК 54 (07) Элементы химической термодинамики в курсе общей химии: Метод. указания к практическим занятиям по курсу общей химии/ НГТУ; Сост.: В.И.Наумов, Ж.В. Мацулевич и др. Н.Новгород, 2009. 18 с. Предложены вопросы и задачи для домашних и практических занятий, а также описание лабораторных работ по теме " ТЕРМОХИМИЯ". Научный редактор Л.Н.Четырбок Редактор
Подп. к печ. Формат 60х84 1/16. Бумага газетная. Печать офсетная. Печ.л. 1,25. Уч.-изд.л.1,1.Тираж 2000 экз. Заказ 141.
© Нижегородский государственный технический университет, 2009
Теоретическая часть Химическая термодинамика изучает: 1. Переходы химической энергии в тепловую, электрическую, световую и обратно, а также устанавливает количественные законы этих переходов. 2. Энергетические эффекты, сопровождающие различные физические и химические процессы и зависимость их от условий протекания данных процессов; 3. Возможность, направление и пределы самопроизвольного протекания процессов в рассматриваемых условиях.
ОСНОВНЫЕ ПОНЯТИЯ ТЕРМОДИНАМИКИ Термодинамическая система – это часть пространства, заполненная веществом или веществами, находящимися между собой во взаимодействии, фактически или мысленно обособленная от окружающей среды. Изолированная система – система, которая не обменивается с окружающей средой ни веществом, ни энергией. Закрытая система – система, которая обменивается с окружающей средой энергией, но не обменивается веществом. Открытая система – система, которая обменивается с окружающей средой и веществом, и энергией. Энергия – это способность системы к совершению работы или переносу тепла. Это общая качественная мера движения и взаимодействия материи.
Формы перехода энергии от одной системы к другой могут быть разбиты на две группы. В первую группу входит перенос энергии за счет теплопроводности и излучения. Перенос энергии за счет теплопроводности совершается путем хаотических столкновений молекул двух соприкасающихся тел или сред (кристалл-кристалл, кристалл-жидкость, кристалл-газ, жидкость-газ).
3 Перенос энергии за счет излучения осуществляется путем облучения тела квантами света любого диапазона длин волн. Энергия квантов света передается поверхностным атомам или молекулам облучаемого кристалла, жидкой или газовой сред, в результате чего энергия этих атомов или молекул повышается и далее она передается за счет теплопроводности соприкасающимся или сталкивающимися с ними атомам или молекулам. И в первом и втором случаях мерой энергии, передаваемой за счет неупорядоченного движения частиц, является теплота. Во вторую группу включаются различные формы движения, общей чертой которых является направленное перемещение масс, охватывающих очень большие числа молекул под действием каких-либо сил. Сюда следует отнести: поднятие тел в поле тяготения, перенос некоторого количества электричества за счет разности потенциалов через электромотор, который, вращаясь, с помощью дополнительных устройств перемещает (поднимает) грузы, вращает гребной винт судна и т.д.. К этой же категории следует отнести расширение газа в двигателе внутреннего сгорания или паровой машине, который давит на поршень, перемещает его и совершает работу. Общей мерой передаваемого таким способом движения является работа – форма передачи энергии путём упорядоченного движения частиц. Работа всегда связана с перемещением масс (тела) против действия некоторых сил. Теплота и работа характеризуют качественно и количественно две различные формы передачи движения от одной части материи к другой. Теплота и работа не могут содержаться в теле. Теплота и работа возникают только тогда, когда возникает процесс, и характеризуют только этот процесс. В статических условиях теплота и работа не существуют.
Функция состояния - это функция, изменение которой не зависит от пути перехода из одного состояния в другое, а зависит только от начального и конечного состояний системы.
4 ПЕРВЫЙ ЗАКОН ТЕРМОДИНАМИКИ Этот закон является одной из форм закона сохранения энергии, который может быть сформулирован следующим образом: ЭНЕРГИЯ НЕ СОЗДАЕТСЯ ИЗ НИЧЕГО И НЕ УНИЧТОЖАЕТСЯ, ОНА ЛИШЬ ПЕРЕХОДИТ ИЗ ОДНОЙ ФОРМЫ ЭНЕРГИИ В ДРУГУЮ. Первое начало термодинамики представляет собой постулат – оно не может быть доказано логическим путем или выведено из каких-либо более общих положений. Истинность этого постулата подтверждается тем, что ни одно из его следствий не находится в противоречии с опытом. Первое начало термодинамики устанавливает соотношение между теплотой Q, работой А и изменением внутренней энергии системы ΔU. 5 Рассмотрим первое начало на примере работы паровой машины.
 F F
   ∆X ∆X
Q
Здесь Q– подводимоек паровому котлу тепло, которое расходуется на увеличение теплосодержания жидкости и на ее испарение. Генерируемый в котле пар давит на поршень и перемещает его на расстояние ∆ X, увеличивая при этом объем рабочей камеры паровой машины на величинуDV = ∆X × S. Здесь S– площадь поршня. Таким образом, с помощью поршня совершается работа против внешних сил F. Таким образом, тепло подводимое к системе расходуется на увеличение внутренней энергии системы и на совершение работы и в математической форме первый закон термодинамики можно записать в виде ур. 1. Q = D U + A (1) Здесь А = рDV, р – давление создаваемое паром в рабочей камере паровой машины, а DV – изменение ее объема. Рассмотрим первое начало термодинамики в приложении к различным условиям (мы будем рассматривать простейший случай – паровую машину). Изохорный процесс (V = const; ΔV = 0). Объем рабочей камеры машины в этом случае не меняется – поршень застопорен.
6
Поскольку работа расширения равна произведению давления на изменение объема рDV, а DV = 0, то для изохорного процесса получаем: D U = QV (2)
Как видно, в изохорных условиях (V = const), и все подведенное к системе тепло расходуется только на увеличение внутренней энергии системы: А=0; QV = ∆U. Изобарный процесс. При (Р = const) подводимое к системе тепло расходуется на увеличение внутренней энергии и на совершение работы расширения газа: Qp =U2 – U1 + P(V2 -V1) или Qp =U2 – U1 + А Это уравнение можно переписать в форме: Qp = (U2 + PV2) - (U1 + PV1); (3) Qp = ∆H = U + PDV Из уравнения (3) следует, что подводимая в изобарных условиях к системе теплота расходуется на приращение некоторой функции состояния, которая называется ЭНТАЛЬПИЕЙ или - знергией расширенной системы:
H = U + PV (кДж/моль). (4)
Таким образом, изменение энтальпии – это теплота, подведенная к системе при изобарном процессе (Qp = ∆H), которая расходуется на изменение внутренней энергии и на совершение работы. Условно считается, что энтальпии образования (про энтальпии образования веществ смотри ниже) простых газов или простых твердых веществ в одной из наиболее устойчивых аллотропных модификациях в стандартных условиях равны нулю. Например: С (графит) - (0 кДж/моль), алмаз - (1,828 кДж/моль); Sn (белое) - (0 кДж/моль), Sn (серое) - (-2,1 кДж/моль); Р (красный) - (-17,6 кДж/моль); Р (белый) - (0 кДж/моль) S (ромб) - (0 кДж/моль); S (моноклинич) - (0,38 кДж/моль) 7 Закон Гесса Первое начало термодинамики дает возможность рассчитать тепловой эффект химической реакции при различных условиях её проведения. Например, термохимическую реакцию окисления водорода в химической термодинамике записывают в виде: Н2(г) + 1/2 О2(г) ––> Н2О(ж) ± ∆H Тепловой эффект реакции связан с энтальпией соотношением ∆H = - Q. Тепловой эффект относят к числу молей вещества, участвующих в реакции в соответствии со стехиометрическими коэффициентами химической реакции. Для данной реакции тепловой эффект ∆H рассчитывают на 1 моль водорода, 1/2 моль кислорода или 1 моль воды. Стандартная энтальпия образования вещества – это энтальпия реакции образования 1 моль сложного вещества из простых веществ, взятых в наиболее устойчивой модификации при 298 К и Р = 105 Па (или 1 атм.). Как указывалось, энтальпия образования простых веществ в наиболее устойчивых аллотропных формах принимаются равными нулю. Рассмотрим энтальпии следующих реакций: А) ½ Н2(г) + ½ I2 (к) = HI (г) ∆ H0 = 26,04 кДж Б) Н2(г) + I2 (к) = 2HI (г) ∆ H0 = 52,08 кДж Первое уравнение описывает процесс образования 1 моль HI (∆ H0 обр)HI, так как здесь водород и йод взяты в наиболее устойчивых агрегатных состояниях. В случае реакции «Б» происходит образование 2-х молей HI, поэтому энтальпия этой реакции соответствует 2 (∆ H0 обр)HI. Рассмотрим еще один процесс: А) Са (к) + 3/2 О2(г) + С(графит) = СаСО3(к) Б) СаО(к) + СО2(г) = СаСО3(к) 8 Первое уравнение описывает процесс образования 1 моль СаСО3(к) (∆ H0 обр), так как здесь кальций и кислород взяты в наиболее устойчивых агрегатных состояниях при стандартных условиях и являются простыми веществами..
Энтальпия второй реакции не равна энтальпии образования, так как в данном случае образование 1 моль СаСО3 идет из сложных веществ СаО(к) и СО2(г). Энтальпия сгорания вещества – энтальпия реакции окисления 1 моль вещества в избытке кислорода до высших устойчивых оксидов. Например,для реакции С2Н2(г) + 5/2О2(г) = 2 СО2(г) + Н2О(ж) энтальпия сгорания соответствует (∆ H0 сгор) 1 моль ацетилена. Основным законом термохимии является закон Гесса, являющийся частным случаем первого начала термодинамики. Формулировка закона Гесса гласит: Тепловой эффект химической реакции зависит только от природы и начального и конечного состояния веществ и не зависит от пути реакции. Химические реакции, идущие с выделением теплоты, называются экзотермическими, а с поглощением – эндотермическими. Энергетические диаграммы экзотермической и эндотермической реакций приведены на рис.1.
кДж/ моль Qp< 0; ∆H >0
Н исх Нконеч
Экзотермический процесс Qp> 0; ∆H < 0
Нконеч
Координата реакции Х Рис.1. Энергетические диаграммы экзотермических и эндотермических реакций 9 Для определения энтальпий реакций пользуются 1-м и 2-м следствиями закона Гесса: 1-е следствие: Энтальпия химической реакции равна разности сумм энтальпий образования продуктов реакции и исходных веществ, умноженных на их стехиометрические коэффициенты.
D Н0хр = S (n i D Н0обр)прод - S (n i D Н0обр)исх (5)
Рассчитаем изменение энтальпии в ходе реакции при Р = const.: Cu(кр)+4HNO3(р) = 2NO2(г) + Cu(NO3)2(кр) +2 H2O(ж) DН0298 кДж/моль 0 -174 33 -305,3 -286 DН0х.р.= åDН0кон - åDН0исх = [2×33 + (-305) + 2×(-286)] – [4×(-174) + 0] = -115 кДж Видно, что DНхр отрицательна (реакция экзотермическая), идет с выделением тепла и при этом внутренняя энергия системы убывает (см. рис.1).
2-е следствие: Энтальпия химической реакции равен разности сумм энтальпий сгорания исходных веществ и продуктов реакции, умноженных на их стехиометрические коэффициенты. D Н0хр = S (n i D Н0сгор)исх - S (n i D Н0сгор)прод (6)
ВТОРОЙ ЗАКОН ТЕРМОДИНАМИКИ
Первый закон термодинамики позволяет рассчитать тепловой эффект процесса, однако не дает ответа на вопросы о направлении и глубине протекания процесса и будет ли процесс протекать самопроизвольно или для его протекания необходимо подвести энергию извне. Самопроизвольные процессы идут сами по себе и не требуют затрат внешней энергии. Второй закон термодинамики дает возможность определить, какой из процессов будет протекать самопроизвольно и какое количество работы может быть при этом получено, а также насколько глубоко будет протекать процесс. Подобно первому закону, второе начало термодинамики выведено непосредственно из опыта. Самопроизвольные процессы в конечном итоге всегда приходят к состоянию равновесия, т.е. к состоянию, когда переход в прямом направлении и обратном равновероятен. Суть обобщенных формулировок второго закона заключается в следующем: если некая реальная система получила от нагревателя определенное количество теплоты Q и совершила при этом работу А, то эта работа всегда меньше полученной теплоты, т.е. А<Q. Таким образом, можно принять, что внутренняя энергия системы состоит из двух составляющих: "свободной" X и "связанной" Y энергий, причем "свободная" энергия может быть переведена в работу, а "связанная" энергия рассеивается в окружающем пространстве в виде теплоты.
U = X + Y (10) Мерой связанной энергии является новая термодинамическая функция состояния, называемая энтропией.
13 Любой системе в данный момент времени соответствует множество микросостояний, которые реализуются во множестве элементарных объемов системы и меняются в каждый следующий момент времени. В каждом элементарном объеме все время меняются температура, давление, плотность, вязкость и т.д., что в жидкостях и газах связано с броуновским движением частиц (молекул, атомов, ионов). Если в микрообъеме частицы сталкиваются, то в нем повышаются давление, температура, плотность и т.д., если частицы разлетаются в разные стороны, то, наоборот, происходит уменьшение этих величин. В твердых телах микростояния меняются из-за тепловых колебаний частиц в узлах кристаллической решетки. На практике, измеряемые нами с помощью градусников, пирометров или манометров, температуры и давления являются средними величинами, складывающихся из температур и давлений в отдельных элементарных объемах системы. Появление того или конкретного микросостояния и их комбинаций в системе не предсказуемо и по этой причине, появление той или иной комбинации микросостояний, можно охарактеризовать только с позиций теории вероятности. Число возможных комбинаций, которые могут реализоваться в системе определяет ТЕРМОДИНАМИЧЕСКУЮ ВЕРОЯТНОСТЬ СОСТОЯНИЯ ВЕЩЕСТВА (W). Чем меньше число возможных микросостояний в системе, тем система более упорядочена, численные значения W малы и больше вероятность появления того или иного микросостояния. В пределе, в совершенном кристалле (без дефектов и без примесей), при температурах, близких к 0 К, мы имеем одну, не меняющуюся со временем комбинацию микросостояний. Картина статична, атомы в решетке не колеблются и W = 1. Наоборот, если число возможных состояний велико, то система неупорядочена и W → ∞. Таким образом, число возможных комбинаций микростояний в системе может меняться в широких пределах (1 ≤ W ≤ ∞). Как видно, число возможных микросостояний в системе может быть очень велико, так как во всех элементарных объемах системы (вещества) постоянно меняются координаты и импульсы частиц, давление, вязкость, плотность, температура и другие параметры, то охарактеризовать 14 термодинамическую вероятность состояния вещества W с помощью таких больших чисел крайне неудобно, а порой и невозможно. По этой причине, за меру числа микростояний, характеризующих неупорядоченность системы, приняли логарифмическую функцию, которую назвали энтропией: S = R ∙ ln W (Дж / моль. К) (11) Здесь R – газовая постоянная, W – число возможных микростояний системы. Таким образом, энтропия есть логарифмическая функция состояния, описывающая степень неупорядоченности системы. Энтропия возрастает с усложнением однотипных молекул, с увеличением числа частиц, с увеличением объема, Т оС и при растворении твердых веществ. Например: S(газ) S2 (газ) S, Дж/моль.К 168 228 UC12 UC13 UC14 UC15 S, Дж/моль.К 79 150 198 213 NO NO2 N2O3 N2O5 S, Дж/моль.К 211 240 307 356
Химическая реакция, связанная с увеличением объема, также характеризуется возрастанием энтропии: СаСО3(к) = СаО(к) + СО2(г) ∆S >0 ∆n >0 С(к) + О2(г) = СО2(г) ∆S ≈ 0 ∆n ≈ 0 MgO(к) + СО2(г) = MgCO3(к) DS <0 ∆n <0 Здесь ∆n – изменение числа молей газообразных веществ, которые и вносят наибольший вклад в изменение энтропии химической реакции. Чаще всего мы имеем дело с тремя состояниями вещества. Для большинства веществ характерны переходы: ТВ → ЖИДК → ГАЗ (вода, металлы, большинство твердых и газообразных металлоидов). Для них изменение энтропии с температурой имеет вид (рис.2). 15
жидк
тв
Рис. 2. Изменение энтропии в зависимости от температуры при наличии фазовых переходов твердое тело – жидкость - газ
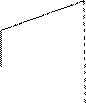
Для некоторых веществ промежуточное, жидкое состояние, отсутствует, и твердое вещество сразу же переходит в газовую фазу. Это процесс называется сублимацией. Такие переходы наблюдаются для J2ТВ → 2Jгаз; SТВ → S газ. Для этого случая изменение энтропии с температурой меняется согласно данным рис. 3.
газ
0 Тисп Т, К Рис. 3. Изменение энтропии в зависимости от температуры при наличии процесса сублимации вещества
16 Для фазовых переходов, происходящих в изобарно-изотермических условиях, изменение энтропии равно:
∆Sфп = ∆Нф.п./Tфп; (Р = const) (12)
Для фазовых переходов, происходящих в изохорно-изотермических условиях, изменение энтропии равно:
∆Sфп = ∆Uф.п./Tфп; (V=const) (13)
Изменение энтропии для реакции а А + вВ = сС + дД может быть рассчитано по уравнению: ∆ S0хр = [сS0 (С) + дS0(Д)] – [а S0 (А) + вS0(В)] (14) или D S0 хр = S (n i S0i) прод - S (n i S0i) исх (15)
ПОСТУЛАТ ПЛАНКА (Третий закон термодинамики)
В 1911 году М. Планк высказал постулат: Энтропия правильно сформированного кристалла чистого вещества при абсолютном нуле равна нулю. Следует подчеркнуть, что вещество в этом случае должно быть абсолютно чистым, а сам кристалл не должен иметь дефектов, так как все эти факторы увеличивают число микросостояний вещества, а значит и энтропию. Изменение энтропии при переходе от Т = 0 К к температуре 25 0С равно ∆S = S298 – S0 но S0 = 0 и поэтому энтропия при стандартных условиях и таблицах измеряется не как ∆S, а в значениях S298 .
17 G, кДж/моль
запрещена Прод.
Прод. ∆G < 0 самопроизвольный процесс
координата реакции Х
Рис. 5. Энергетические диаграммы термодинамически запрещенных, равновесных и самопроизвольных химических процессов Условиями термодинамического равновесия в закрытой системе при различных условиях ведения процесса являются: Изобарно-изотермические (P = const, T = const): ΔG = 0 Изохорно-изотермические (V = const, T = const): ΔF = 0 Таким образом, единственным критерием самопроизвольности химических процессов служит величина изменения свободной энергии Гиббса (или Гельмгольца), которая определяется двумя факторами: энтальпийным и энтропийным ∆G = ∆H - T∆S ΔF = ∆ U - T∆ S Для определения, какой из факторов энтальпийный или энтропийный являются определяющими, производят сравнение: ÷ ∆H ÷ > ÷ T∆S÷ – определяющим является энтальпийный фактор ÷ ∆H ÷ < ÷ T∆S÷ - определяющим является энтропийный фактор В химии наиболее часто используется энергия Гиббса, поскольку большинство химических и биологических процессов протекают в открытых (Р = Ратм) или закрытых сосудах (Р ¹ Ратм) при постоянном давлении и поэтому в дальнейшем, чтобы не повторяться в отношении величины ΔF, мы будем оперировать величиной ∆G. 19 Для химических процессов типа аА + вВ = сС + дД величину ΔGхр можно рассчитать, зная значения ΔHхр и ΔSхр соответствующих температуре протекания процесса, а для стандартных условий и по значениям ΔH0хр и DS0хр :
∆G0хр = ΔH0хр - TDS0хр (17)
Можно воспользоваться и таблицами стандартных термодинамических функций образования веществ ΔG°обр. В этом случае ΔG° реакции рассчитывается аналогично ΔН°хр по уравнению:
∆G0хр = [с ∆G0 (С) + д ∆G0 (Д)] – [а ∆G0 (А) + в ∆G0 (В)]
Таким образом, чтобы определить, возможен или нет химический процесс в данных условиях, необходимо определить, каким будет знак изменений энергий Гиббса или Гельмгольца. Часто требуется определить температуру, называемую температурой инверсии, выше или ниже которой реакция меняет свое направление на обратное. Температура инверсии определяется из условия равновесия реакции ∆Gхр = 0:
∆Gхр = ΔHхр - TDSхр = 0 (18) или Тинв = ΔHхр / DSхр (19)
ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ Задача 1. Рассмотрим равновесную реакцию: Si к + SiO2 к = SiOк и определим, какой из оксидов будет устойчив при температуре 100 оС. Решение. Для этого рассчитаем величину DG этой реакции. Воспользуемся табличными данными
20 Si SiO2 SiO ∆ H0,кДж/моль 0 -912 -438 S0,Дж/мольК 19 42 27
∆Н0хр = [2.(-438) –[-912+0]= +36 кДж/м = 36000 Дж/моль ∆ S0хр = [2.(27) –[42+19] = -7 Дж/моль.К ∆ Gхр = ∆H0хр - T∆S0хр =36 - 373×(-7)×10-3 = 38,6 кДж/моль
Видно, что величина ∆G положительна и при 373 К реакция в прямом направлении протекать не может. Для того, чтобы узнать возможен ли в принципе переход SiO2 в SiO при каких – либо других температурах, надо рассчитать температуру инверсии, при которой система находится в состоянии термодинамического равновесия, т.е. в условиях, когда ∆ G = 0 Тинв = ∆ Hхр /∆ Sхр = 36/(-7.10-3)= -5143 К Такой отрицательной температуры не существует и, следовательно, ни при каких условиях переход двуокиси кремния в окись кремния невозможен.
Задача 2. Рассчитать тепловой эффект реакции при получении 1 кг железа по уравнению Fe3O4(к) + 4H2(г) = 3Fe(к) + 4H2O(г)
∆Н°, кДж/моль -1118 0 0 -241,8 Энтальпии образования простых веществ H2(г) и Fe(к) равны нулю. Решение. В соответствии со следствием из закона Гесса изменение энтальпии процесса равно: ∆Н° = 4∆Н° (Н2О) – ∆Н° (Fe3O4) = 4(-241,8) – (-1118) = 150,8 кДж Изменение энтальпии реакции в данном случае рассчитано на 3 моль железа, т.е. на 3 ∙ 56 г = 168 г. Изменение энтальпии при получении 1кг железа определяется из соотношения:
21 168г Fe - 150,8 кДж 1000г Fe - ∆Н кДж Отсюда ∆Н = 897 кДж Задача 3 Определить верхний предел температуры при которой может протекать процесс образования пероксида бария по реакции 2BaO(к) + O2(г) = 2BaO2(к) Решение. Изменение энтальпии и энтропии реакции образования пероксида бария имеют следующие значения: ∆Н° = 2∆Н°ВаО2 - (2∆Н°ВаО + ∆Н°О2) ∆Н° = -634,7∙2 - (-553,9∙2 + 0) = -161,6 кДж ∆S° = 2S°ВаО2 – (2S°ВаО + S°О2) ∆S° = 77,5∙2 – (70,5∙2 + 206) = -191 Дж/К = - 0,191 кДж/К Свободная энергия этого процесса выразится уравнением ∆G° = -161,6 + 0,191×Т При стандартных условиях ∆G° = -161,6 + 0,191× 298 = -104,68 кДж. Реакция при стандартных условиях протекать может. Температуру инверсии можно найти из соотношения ∆G° = 0. Отсюда следует: ∆G° = -161,6 + 0,191Т = 0 Отсюда Т = - 161,6/- 0,191 = 846,07 К Выше температуры 846,07 К, процесс образования BaO2 может быть реализован.
Задача 4. Вычислить изменение энтропии при испарении 250 г воды при 25 °С, если мольная теплота испарения воды при этой температуре равна 44,08 кДж/моль. РЕШЕНИЕ. При испарении энтропия вещества возрастает на величину ∆Sисп= DН/Т 250 г воды составляют 250 г/18 г = 13,88 моль. Отсюда теплота испарения воды равна: 13,88 ∙ 44,08 = 611,83 кДж.
22 Изменение энтропии при испарении 250 г воды при Т = 25 + 273 = 298 К: ∆Sисп= 611,83/298 = 2,05 кДж
ЗАДАЧИ ДЛЯ САМОСТОЯТЕЛЬНОЙ РАБОТЫ 1. Пользуясь табличными данными, рассчитать ∆Н°298 реакции СО(г) + Н2О(г) = СО2(г) + Н2(г) Определить: а) ∆U°298 реакции; б) сколько граммов и сколько литров СО вступило в реакцию, если выделилось 14,66 кДж тепла (н.у.)? 2. Пользуясь табличными данными, рассчитать ∆Н°298 реакции СН4 + 2О2 = СО2 + 2H2О(ж) Определить; а) ∆U°298 реакции; б) сколько тепла выделится при сжигании 56 л метана (н.у)? З. Для реакции СО(Г) + С12(г) = COС12(г). пользуясь табличными данными, рассчитать ∆Н°298 реакции. Вычислить: а) ∆U°298 реакции; б) сколько литров СО вступило в реакцию, если выделилось 338,13 кДж тепла (н.у.)? 4. Пользуясь табличными данными, рассчитать ∆Н°298 реакции: 2НС1(Г} + Са(тв), = СаС12(тв) + H2(г). Рассчитать ∆U°298 реакции и сколько литров HCI (при н.у.) вступило в реакцию, если в результате выделилось 419 кДж тепла. 5. ∆Н°298 сгорания метана СН4 равно - 891,6 кДж/моль. Вычислить: а) сколько тепла выделится при сгорании 1г метана; б) сколько тепла выделится при сгорании 5л метана (н.у.)? 6. Для реакции 2Сu(тв) + 1/2О2(Г) = Сu2О(тв) ∆Н°298 которой составляет -167,6 кДж, рассчитать: а)сколько литров кислорода вступило в реакцию, если выделилось 335,2 кДж тепла? б) ∆U°298 реакции. 7. ∆Н°298 реакцииCd(тв) + 1/2О2(Г) = CdО(тв) составляет -256,43 кДж. 8. ∆Н°298 реакции 2Вi
|
|||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-02-07; просмотров: 68; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.117.227.194 (0.314 с.) |
 Нижегородский государственный технический университет. Типография НГТУ. 603S00, Н.Новгород, ул. Минина, 24.
Нижегородский государственный технический университет. Типография НГТУ. 603S00, Н.Новгород, ул. Минина, 24.





 Н, Эндотермический процесс
Н, Эндотермический процесс




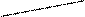 S, Дж/моль.К газ
S, Дж/моль.К газ


 0 Тпл Тисп Т, К
0 Тпл Тисп Т, К
 S, Дж/моль.К
S, Дж/моль.К 
 тв
тв 
 Прод. ∆G > 0
Прод. ∆G > 0
 термодинамически
термодинамически
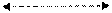

 Исх. равновесие ∆G = 0
Исх. равновесие ∆G = 0



