Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Электронная природа химических связей в органических соединениях ⇐ ПредыдущаяСтр 3 из 3
1. Все органические вещества содержат углерод. В молекулах органических веществ углерод переходит в возбуждённое состояние:
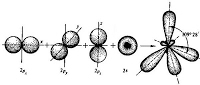
2. Органическим соединениям свойственны ковалентные связи. Ковалентная связь в молекулах характеризуется: энергией, длиной, насыщаемостью и пространственной направленностью. а) Из курса химии 8 класса вы знаете, что ковалентная связь образуется за счёт перекрывания электронных облаков, при этом выделяется энергия, чем больше перекрывание, тем больше выделяется энергии и тем прочнее связь. Типы перекрываний электронных облаков в порядке возрастания их прочности и энергии выделяемой при образовании: σ(s – s) < σ(s – p) < σ (p – p) б) Длина связи определяется расстоянием между центрами ядер связывающихся атомов и измеряется в нанометрах (1 нм = 10-9 м). С повышением кратности связи (одинарная, двойная, тройная) длина становится меньше, а энергия выше: (С – С) < (C = C) < (C ≡ C) в) Под насыщаемостью связи понимают способность образовывать строго определённое количество ковалентных связей. г) Направленность ковалентной связи определяется взаимным расположением электронных облаков, участвующих в образовании химической связи. Ковалентная связь образуется в направлении максимального перекрывания электронных орбиталей взаимодействующих атомов. Вы уже знаете, что атом углерода содержит на внешнем уровне четыре валентных электрона: 1 электрон на s – орбитали сферической формы 3 электрона на трёх p – орбиталях, орбитали имеют форму гантели и расположены под углом 90˚.
Рис. Атом углерода в возбуждённом состоянии (s1px1py1pz1)
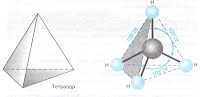
Таким образом можно предположить, что в молекуле метана CH4 атом углерода не может образовать 4 одинаковых связи с четырьмя атомами водорода (1 атом водорода имеет 1 электрон на s – орбитали сферической формы). Однако экспериментально доказано, что в молекуле метана все связи С – Н равноценны и направлены к вершинам правильного тетраэдра под углом 109˚28`. В 1931 г. американский учёный Л. Полинг доказал, что в молекуле метана в момент образования молекулы электронные облака смешиваются и образуют гибридные электронные облака, происходит процесс гибридизации. Гибридизация атомных орбиталей
Гибридизация – процесс смешения разных, но близких по энергии, орбиталей данного атома, с возникновением того же числа новых гибридных орбиталей, одинаковых по форме и энергии. В зависимости от числа вступивших в гибридизацию орбиталей атом углерода может находиться в одном их трёх состояний гибридизации: sp3, sp2, sp. Явление гибридизации 1) sp 3 – гибридизация Происходит смешение одной s и трёх p орбиталей. Образуются четыре одинаковые гибридные орбитали, расположенные относительно друг друга под тетраэдрическим углом 109˚28`. Образуются 4 ковалентные σ – связи. Анимация: “Основные типы гибридизации атома углерода. SP3-гибридизация” SP3 - Гибридизация
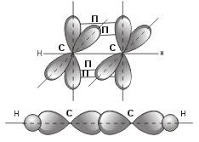
Рис. Строение молекулы метана СН4 (тетраэдрическое) 2) sp 2 – гибридизация: Происходит смешение одной s и двух p орбиталей. Образуются три одинаковые гибридные орбитали, они расположены относительно друг друга под углом 120˚, лежат в одной плоскости и стремятся к вершинам треугольника. Образуются 3 ковалентные σ – связи. Анимация: “SP2- гибридизация” sp2-Гибридизация
Оставшаяся одна негибридизованная орбиталь расположена перпендикулярно плоскости образования σ – связей и участвует в образовании П - связи.
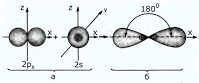
Рис. Строение молекулы этилена С2Н4 (плоское тригональное) 3 ) sp – гибридизация Происходит смешение одной s и одной p орбитали. Образуются две одинаковые гибридные орбитали, они расположены относительно друг друга под углом 180˚, лежат на одной линии. Образуются 2 ковалентные σ – связи. Анимация: “SP-гибридизация” SP - Гибридизация
Оставшиеся две негибридизованные орбитали расположены во взаимно перпендикулярных плоскостях и образуют две П - связи.
Рис. Строение молекулы ацетилена С2Н2 (линейное)
Направленность гибридных орбиталей в пространстве, а следовательно, и геометрическое строение молекул зависят от типа гибридизации. На форму молекулы в пространстве влияет направленность только σ – связей. Типы гибридизации
|
|||||
|
Последнее изменение этой страницы: 2021-02-07; просмотров: 337; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.138.122.4 (0.008 с.) |