Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Биосинтез триглицеридов и фосфолипидов.
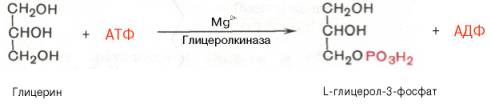
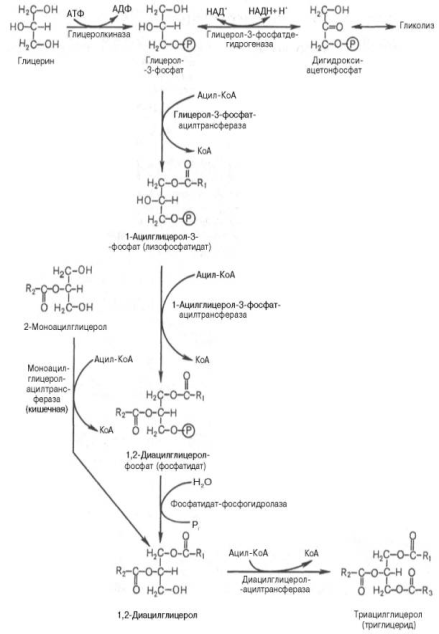
Синтез триглицеридов происходит из глицерина и жирных кислот (главным образом стеариновой, пальмитиновой и олеиновой). Путь биосинтеза триглицеридов в тканях протекает через образование α-глице-рофосфата (глицерол-3-фосфата) как промежуточного соединения. В почках, а также в стенке кишечника, где активность фермента глицеролкиназы высока, глицерин фосфорилируется за счет АТФ с образованием глицерол-3-фосфата:
в процессе гликолитического распада глюкозы образуется дигидроксиацетонфосфат. Последний в присутствии цитоплазматической глицерол-3-фос-фатдегидрогеназы способен превращаться в глицерол-3-фосфат:
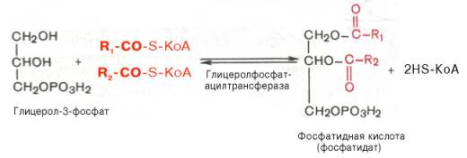
Образовавшийся тем или иным путем глицерол-3-фосфат последовательно ацилируется двумя молекулами КоА-производного жирной кислоты (т.е. «активными» формами жирной кислоты – ацил-КоА). В результате образуется фосфатидная к-та (фосфатидат):
Далее фосфатидная к-та гидролизуется фосфатидат-фосфогидро-лазой до 1,2-диглицерида (1,2-диацилглицерола):
Затем 1,2-диглицерид ацилируется третьей молекулой ацил-КоА и превращается в триглицерид (триацилглицерол). Эта реакция катализируется диацилглицерол-ацилтрансферазой:
Биосинтез триглицеридов (триацилглицеролов).
Переваривание белков в ЖКТ. В желудке имеются все условия для переваривания белков. Во-первых, в желудочном соке содержится активный фермент пепсин. Во-вторых, благодаря наличию в желудочном соке свободной соляной кислоты для действия пепсина создается оптимальная pH среды. Чистый желудочный сок имеет кислую среду (pH 0,9-1,6), а оптимум pH действия пепсина равен 1,5-2,5. Следует особо указать на существенную роль соляной кислоты в переваривании белков: она переводит неактивный пепсиноген в активный пепсин, создает оптимальную среду для действия пепсина, в присутствии свободной НС1 происходят набухание белков (увеличение поверхности соприкосновения фермента с субстратом), частичная денатурация и, возможно, гидролиз пищевых белков. Пепсин гидролизует преимущественно пептидные связи, образованные аминогруппами ароматических АМК (фенилаланин, тирозин). Он расщепляет практически все природные белки. Исключение составляют некоторые кератины, протамины, гистоны и мукопротеиды. Дальнейшее превращение белков пищи осуществляется в тонком кишечнике, где на белки действуют ферменты панкреатического и кишечного соков. В поджелудочной железе вырабатываются три белковых фермента: трипсин, химотрипсин и карбоксипептидаза. Первые два фермента действуют на белки аналогично пепсину, но в отличие от него они разрывают другие внутренние пептидные связи. Кроме того, они активны в слабощелочной среде (оптимум pH действия их составляет 7,2-7,8). Благодаря гидролитическому действию всех трех эндопептидаз (пепсина, трипсина, химотрипсина) на белки образуются различной длины пептиды и некоторое количество свободных АМК. Дальнейший гидролиз пептидов до свободных АМК осуществляется под влиянием группы ферментов - пептидаз.
Продукты гидролиза белков всасываются в желудочно-кишечном тракте в основном в виде свободных АМК. Кинетика всасывания АМК в кишечнике в опытах in vivo и in vitro свидетельствует о том, что АМКы, подобно глюкозе, всасываются свободно с ионами натрия. 71.Превращение АМК в толстом кишечнике. Гниение! Часть аминокислот не всасывается и подвергается процессам гниения с участием микрофлоры в толстом кишечнике. Продукты гниения аминокислот могут всасываться и попадают в печень, где подвергаются реакциям обезвреживания. За счет деятельности микрофлоры толстого кишечника АМК подвергаются гниению с образованием ядовитых продуктов: при распаде серусодержащих АМК (цистина, цистеина и метионина) образуются H2S и метилмеркаптан (CH3SH). Диаминокислоты, в частности орнитин и лизин, подвергаются декарбоксилированию с образованием протеиногенных аминов (трупных ядов).
При разрушении фенилаланина, тирозина, триптофана, образуются соответствующие биогенные амины: фенилэтиламин, триптамин, серотонин. При разрушении этих же аминокислот могут образовываться крезол, фенол, скатол, индол, бензол.
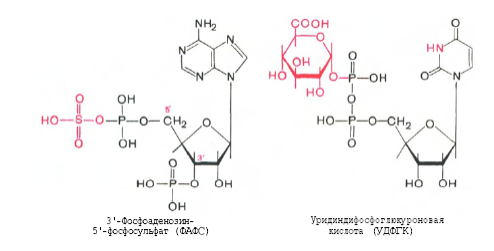
Происходит это так: в печени содержатся специфические ферменты - арилсульфотрансфераза и УДФ-глюкуронилтрансфераза, которые катализируют перенос остатка серной кислоты из ее связанной формы-ФАФС (фосфоаденозин-фосфосульфат) и остатка глюкуроновой кислоты из ее связанной формы-УДФГК (уридиндифосфоглюкуроновой кислоты) на любой из указанных выше продуктов. Продукты реакции нетоксичные так называемые парные кислоты (например, фенолсерная кислота, скатоксилсерная), выделяются с мочой.
Диагностическое значение индикана: он характеризует содержимое кишечника. Содержание индикана увеличивается при запорах, непроходимости кишечника, при перитонитах и парезах кишечника. В этих случаях индикан появляется в крови и выделяется с мочой в повышенных количествах. Увеличение его концентрации в крови наблюдается на ранних стадиях почечной недостаточности.
|
||||||||
|
Последнее изменение этой страницы: 2021-02-07; просмотров: 189; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.118.200.197 (0.012 с.) |



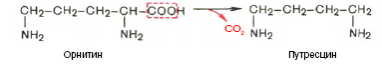
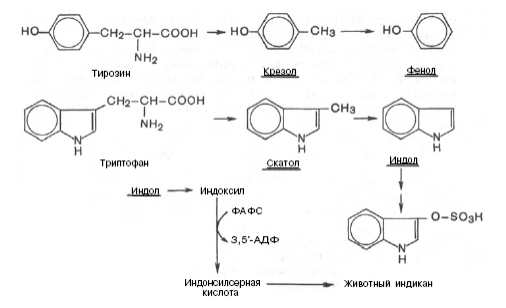
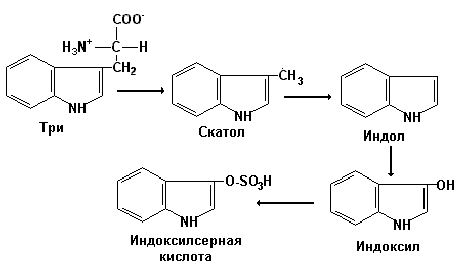 Все эти вещества гидрофобны и обладают мембранотропным действием (поражают мембраны клеток печени, эритроцитов, легких). Продукты распада аминокислот поступают в печень, где подвергаются детоксикации. В печени эти продукты обезвреживаются путем конъюгации с серной или глюкуроновой кислотой с образованием нетоксичных парных кислот (фенолсерная, скатоксилсерная).
Все эти вещества гидрофобны и обладают мембранотропным действием (поражают мембраны клеток печени, эритроцитов, легких). Продукты распада аминокислот поступают в печень, где подвергаются детоксикации. В печени эти продукты обезвреживаются путем конъюгации с серной или глюкуроновой кислотой с образованием нетоксичных парных кислот (фенолсерная, скатоксилсерная).