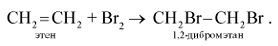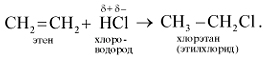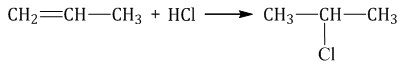Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Гидрирование бензола и его гомологов ⇐ ПредыдущаяСтр 4 из 4
При гидрировании бензола при нагревании и в присутствии катализатора образуется циклогексан:
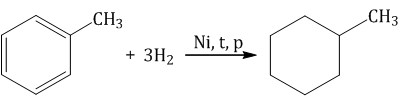
При гидрировании толуола образуется метилциклогексан:
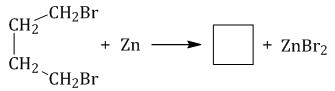
Этим способом можно получить только циклогексан и его гомологи с шестичленным кольцом. Дегалогенирование дигалогеналканов При действии активных металлов на дигалогеналканы, в которых между атомами галогенов находится три и более атомов углерода.
Таким образом можно синтезировать циклоалканы заданного строения, в том числе циклоалканы с малыми циклами (С3 и С4).
2.Строение и химические свойства этиленовых углеводородов.
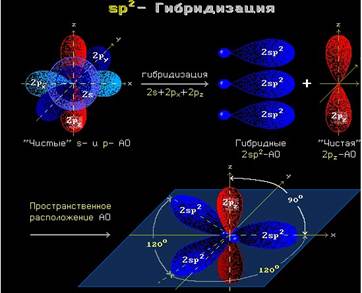
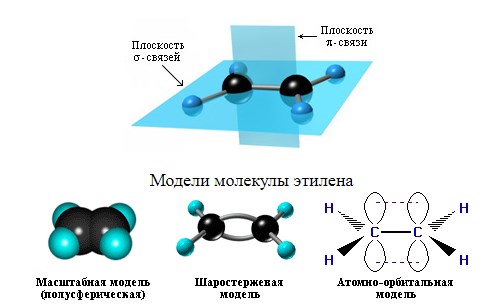
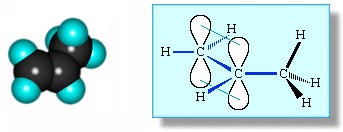
Общая формула этиленовых углеводородов СnH2n. Они составляют гомологический ряд, первым представителем которого является этилен СН2 = СН2. Строение алкенов. Рассмотрим особенности строения алкенов на примере этилена. В молекуле этилена присутствуют химические связи C–H и С=С. Связь C–H ковалентная слабополярная одинарная σ-связь. Связь С=С – двойная, ковалентная неполярная, одна из связей σ, вторая π-связь. Атомы углерода при двойной связи образуют по три σ-связи и одну π-связь. Следовательно, гибридизация атомов углерода при двойной связи в молекулах алкенов – sp2:
При образовании связи σ-связи между атомами углерода происходит перекрывание sp2-гибридных орбиталей атомов углерода:
При образовании π-связи между атомами углерода происходит перекрывание негибридных орбиталей атомов углерода:
Три sp2-гибридные орбитали атома углерода взаимно отталкиваются, и располагаются в пространстве так, чтобы угол между орбиталями был максимально возможным. Поэтому три гибридные орбитали атомов углерода при двойной связи в алкенах направлены в пространстве под углом 120 о друг к другу:
Это соответствует плоско-треугольному строению молекулы.
Молекулам линейных алкенов с большим числом атомов углерода соответствует пространственное строение.
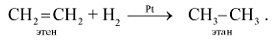
Химические свойства. По химическим свойствам этилен резко отличается от этана, что обусловлено электронным строением его молекулы. Имея в молекуле двойную связь, состоящую из • Способность к реакциям присоединения характерна для всех алкенов. 1. Присоединение водорода (реакция гидрирования):
2. Присоединение галогенов (реакция галогенирования):
При добавлении к алкену брома (в виде бромной воды) бурая окраска брома быстро исчезает. Эта реакция является качественной на двойную связь. 3. Присоединение галогеноводородов (реакция гидрогалогенирования):
Если исходный алкен несимметричен, то реакция протекает по правилу Марковникова.
Присоединение галогеноводородов к непредельным соединениям идет по ионному механизму. 4. Присоединение воды (реакция гидратации):
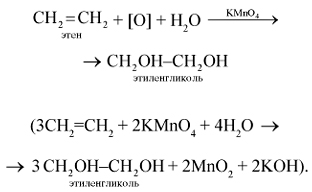
Этой реакцией пользуются для получения этилового спирта в промышленности. 5. Этилен легко окисляется уже при обычной температуре, например, при действии перманганата калия. Если этилен пропускать через водный раствор перманганата калия KMnO4, то характерная фиолетовая окраска последнего исчезает, происходит окисление этилена (реакция гидроксилирования) перманганатом калия (качественная реакция на двойную связь):
2. Этилен горит светящимся пламенем с образованием оксида углерода(IV) и воды: C2H4 + 3O2 —> 2CO2 + 2H2O. 3. Большое промышленное значение имеет частичное окисление этилена кислородом воздуха:
• Для этилена, как и для всех непредельных углеводородов, характерны реакции полимеризации. Они протекают при повышенной температуре, давлении и в присутствии катализаторов:
Полимеризация – это последовательное соединение одинаковых молекул в более крупные. Таким образом, для этилена и его гомологов характерны реакции присоединения, окисления и полимеризации. Получение. 1. Дегидрация спиртов (по правилу Зайцева)˸ C2H5OH CH2=CH2↑+H2O. Правило Зайцева˸ при дегидратации спиртов водород отщепляется от наименее гидрогенизированного атома углерода. 2. Из галогенпроизводных алканов˸ а) CH3-CH2-Cl+KOH=CH2=CH2↑+KCl+H2O; спиртовой раствор б) СН2Br-CH2Br+Zn=CH2=CH2↑+ZnBr2. 3. Дегидрирование алканов˸ CH3-CH3 CH2=CH2↑+H2. 4. Из газов крекинга нефти C4H10 C2H4+C2H6. алкен 5. Крекинг жидких нефтепродуктов˸ C16H34 C8H16 + C8H18. алкен C8H16 C4H8 + C4H10. алкен
|
|||||||||||
|
Последнее изменение этой страницы: 2021-02-07; просмотров: 220; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.188.241.82 (0.016 с.) |
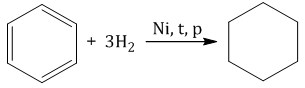

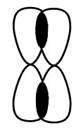
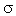 - и
- и  -связей, этилен способен присоединять два одновалентных атома или радикала за счет разрыва
-связей, этилен способен присоединять два одновалентных атома или радикала за счет разрыва