
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Плавка сульфидных медных концентратов на штейн в печи «айзасмелт»
3.4.1 Расчёт рационального состава концентрата Состав концентрата, % масс.: Cu – 26,08; Fe-27,95; S – 36,08; SiO2 – 1,63; CaO – 0,47; MgO – 0,4; Al2O3 – 0,4; Pb – 2,65; Zn-3,73; прочие – 0,71. Расчёт ведём на 100 кг концентрата. Принимаем, что в концентрате серу содержащими минералами являются халькопирит (CuFeS2), ковеллин (CuS) и пирит (FeS2). Содержание меди, железа и серы в минералах составляет:
CuFeS2: Cu – 34,62 %; S – 34,95 %; Fe – 30,43 %
CuS: Cu – 66,46 %; S – 33,54 %
FeS2: Fe – 46,6 %; S - 53,4 %
Обозначим через х кг массу халькопирита, y кг массу ковеллина и z кг массу пирита. С учётом этого составим балансовые уравнения по компонентам Сu, Fe и S:
Cu:
0,3462x + 0,6646y = 26,08 (1)
Fe:
0,3043x + 0,466z = 27,95 (2)
S:
0,3495x + 0,3354y + 0,534z = 36,08 (3)
Решая систему уравнений, получим
Комбинирование уравнений (2) и (3), исключим из этих уравнений z.
0,3043x + 0,466z = 27,95 × 0,534 0,3495x + 0,3354y + 0,534z = 36,08 × 0,466
Вычитая, получим:
х = 84,82кг; у = 5,44 кг; z = 17,62 кг.
Таким образом, в 100 кг концентрата содержится 64,82 кг CuFeS2, 5,44 кг CuS и 17,62 кг FeS2. В них содержится компонентов:
CuFeS2: Cu – 0,3462∙64,82 = 22,46 кг CuS: Cu – 0,6646∙5,44 = 3,62 кг Fe – 0,3043∙64,82 = 19,74 кг S – 0,3354∙5,44 = 1,82 кг S- 0,3495∙64,82 = 22,62 кг
FeS2: Fe – 0,466∙17,62 = 8,21 кг S – 0,534∙17,62 = 9,41 кг
Полученные расчётные данные сводим в таблицу.
Полученные расчётные данные сводим в таблицу.
Таблица 45 - Рациональный состав концентрата, % масс.
3.4.2 Расчёт десульфуризации за счёт процесса разложения высших сульфидов Десульфуризация в процессе плавки осуществляется как за счёт диссоциации высших сульфидов, так за счёт окисления сульфидов железа кислородом дутья. В процессе плавки минерал халькопирит разлагается по уравнению
4CuFeS2 = 2Cu2S + 4FeS + S2 (4)
При этом в газовую фазу переходит серы
При этом образуется
и
Ковеллин разлагается по уравнению
4CuS = 2Cu2S + S2 (5)
По этой реакции в газовую фазу переходит серы
При этом образуется
В процессе плавки пирит разлагается по реакции
2FeS2 = 2FeS + S2 (6)
При этом в газовую фазу переходит серы
и образуется
Количество сульфида железа FeS, которое образуется за счёт разложения высших сульфидов, составит
31,05 + 12,91 = 43,96 кг
Количество серы, которое перейдёт в газовую фазу в процессе плавки за счёт диссоциации высших сульфидов, составит:
5,66 + 4,71 + 0,91 = 11,28 кг
Окисление элементарной серы протекает по реакции
S2 + 2О2 = 2SО2
На окисление этой серы затрачивается кислорода
3.4.3 Расчёт количества и состава штейна и степени десульфуризации Принимаем содержание меди в штейне 60%. Извлечение меди в штейн в процессе Айзасмелт составляет порядка 95-98%. Принимаем извлечение меди в штейн 98%. Тогда в штейн перейдёт
26,08∙0,98 = 25,56 кг Cu.
Количество меди, перешедшей в шлак, составит
26,08 – 25,56 = 0,52 кг
Считаем, что медь в шлаке находится в виде Cu2S. Тогда в шлак вместе с медью перейдёт
Тогда масса штейна составит
В соответствии с правилом Мостовича, среднее содержание серы в штейне составляет 25%. Тогда масса серы в штейне составит
42,6∙0,25 = 10,56 кг
Вся медь в штейне связана с серой в виде Сu2S. Количество серы, связанной с медью в штейне, составит
Масса Cu2S в штейне составит
По данным заводской практики принимаем, что 50% PbS переходит в штейн, а 50% окисляется и переходит в шлак. Тогда масса свинца, переходящего в штейн, что составляет
2,65∙0,5 = 1,32 кг Pb
По данным заводской практики принимаем, что 30% ZnS переходит в штейн, а 70% окисляется и переходит в шлак. Масса цинка, переходящего в штейн составит
3,73∙0,3 = 1,12 кг Zn
В штейне растворяется определённое количество магнетита, который вносит в штейн кислород. Содержание растворённого в штейне кислорода зависит от содержания в нём меди (таблица 46)
Таблица 46 - Содержание кислорода в штейне, %.
Как видно из таблицы 2, содержание кислорода в штейне с содержанием 60% Сu, концентрация растворенного в штейне кислорода составляет 0,7%, что составляет
Количество магнетита, которое содержится в 49,92 кг штейна, составит
Количество железа, которое содержится в штейне в виде магнетита, составит
Принимаем содержание прочих в штейне 1%, что составляет
Тогда масса железа в штейне, связанного с FeS, составит
42,6 – 25,56 – 1,32 – 1,12 - 10,56 – 1,09 – 0,43 = 2,52 кг(2,52)
Тогда общее количество железа в штейне составит
2,52 + 0,79 = 3,31 кг(3,31)
Полученный штейн будет иметь следующий состав.
Таблица 3 - Состав медного штейна
Количество серы, удаляемое в процессе плавки из концентрата, составит
36,08 – 0,13 – 10,56 = 25,39 кг
Тогда степень десульфуризации в процессе плавки составит
3.4.4 Расчёт состава шлака Количество железа, переходящее в шлак составит
27,95 – 3,31 = 24,64 кг.(24,64)
В шлаке железо находится в виде FeO. Тогда количество кислорода в шлаке, связанное с FeO, составит
По условию 50% PbS окисляется по реакции
PbS + 1,5O2 = PbO + SO2 (7)
и PbO переходит в шлак. Тогда количество свинца, переходящее в шлак, составит
2,65∙0,5 = 1,33 кг
С ним связано кислорода
По условию 70% ZnS окисляется по реакции
ZnS + 1,5O2 = ZnO + SO2, (8)
а образующийся ZnO переходит в шлак. Тогда количество Zn, переходящее в шлак, составит
3,73∙0,7 = 2,61 кг
С ним связано кислорода
Тогда количество кислорода в шлаке составит
7,06 + 0,1 + 0,94 = 8,1 кг (8,1)
Считаем, что такие компоненты шлака, как SiO2, CaO, MgO и Al2O3 полностью переходят в шлак без изменений. Из прочих концентрата переходит в шлак
0,69- 0,43 = 0,26 кг.
На основании выполненных расчётов рассчитаем массу и состав шлака без добавления флюсов. (Таблица 47)
Таблица 47- Состав и количество шлака без добавления флюсов
Согласно технологическому регламенту, отношение основных компонентов в шлаке, поступающим из плавильной печи в электропечь составляет, %, масс.
Fe: SiO2: CaO = 36,48: 31,87: 3,52
В полученном шлаке это соотношение составляет
Fe: SiO2: CaO = 61,06: 4,02: 1,12
Из соотношения видно, что в полученном шлаке больше в избытке содержится железо. Рассчитаем по этому компоненту массу шлака, которая составит
Нехватку SiO2 и CaO компенсируем добавлением в шихту флюсов: кремнезёма и известняка
Состав сухих флюсов приведён в таблице 48.
Таблица 48- Состав флюсов
Количество СаО, которое должно содержаться в шлаке, составит
0,0352∙67,93 = 2,39 кг
Количество СаО, которого необходимо добавить в шлак, составит
2,39 – 0,47 = 1,92 кг
Тогда количество известняка, которое необходимо внести в шихту, составит
Вместе с известью в шлак перейдёт
SiO2 – 0,0123∙3,76 = 0,05 кг; Al2O3 – 0,0358∙3,76 = 0,13 кг;
MgO – 0,0045∙3,76 = 0,02 кг.
В известняке СаО находится в виде карбоната СаСО3, который в условиях плавки разлагается по уравнению
СаСО3 = СаО + СО2 (9)
В результате в газовую фазу перейдёт СО2
Считаем, что прочие в количестве
3,75– 1,62 – 0,02– 0,13 – 0,05 – 1,92 = 0,01 кг
перейдут в шлак.
Количество SiO2, которое должно содержаться в шлаке, составит
0,3187∙67,93 = 21,65 кг.
Количество SiO2, которое необходимо внести в шлак, составит
21,65 – 1,63 = 20,02 кг
Тогда количество кварцевой руды, которое необходимо внести в шихту, составит
Вместе с кварцевой рудой в шлак перейдут следующие компоненты в количествах:
Al2O3 – 0,0617∙23,94 = 1,48 кг; MgO- 0,0166∙23,94 = 0,40 кг;
FeO– 0,063∙23,94 =1,51 кг (1,17 кг Fe; 0,34 кг О2)
Принимаем, что прочие в количестве
0,0225∙23,94 = 0,54 кг
перейдут в шлак. С учётом добавления флюсов к шихте в шлаке будет содержаться
Fe -24,64 + 1,17 = 25,81 кг;(25,81) О – 8,1 + 0,34 = 8,44 кг; (8,44)
SiO2- 1,63 + 20,02 + 0,05 = 21,70 кг; Al2O3 – 0,4 + 0,13 + 1,48 = 2,01 кг;
СаО – 0,47 + 1,92 = 2,39 кг; MgO – 0,3 + 0,02 + 0,40 = 0,72 кг;
прочие – 0,26 + 0,01 + 0,54 = 0,81 кг.
Состав и количество шлака без добавления угля приведён в таблице 6.
Таблица 49 - Состав шлака
3.4.5 Расчёт дутья и состава газовой фазы Количество серы, переходящее в газ в процессе десульфуризации составляет 25,39 кг
На окисление этой серы расходуется кислорода
При этом образуется SO2
25,39 + 25,34 = 50,73 кг
или
Всего расходуется кислорода на плавку
0,3 + (8,44) + 25,34 = 34,08 кг
Объём расходуемого кислорода в нормальных условиях составит
Для поддержания нормального теплового режима плавки в шихту добавляется уголь в количестве 2,35 % от массы загружаемых в печь концентрата и флюсов. Уголь имеет следующйй состав, % (масс.): С- 73,5; Н-9,33;Al2O3-3,1; MgO – 0,25; SiO2 - 8,0; CaO -0,29; прочие -5,3. Влажность угля 13%.
Количество загружаемого в печь угля составляет
С учётом влажности масса загружаемого в печь угля составит
В угле содержится влаги
3,45 – 3,0 =0,45 кг или
Считаем, что сера в угле связана в виде H2S. Масса серы в угле составит
Количество H2S в угле составит
Масса водорода, связанного с H2S составит
0,016 -0,015 = 0,01 кг.
Всего водорода в угле содержится
Считаем, что остальная масса водорода в угле связана в виде CH4, которая составит
0,28-0,01 = 0,27 кг.
Тогда масса углерода связанная с CH4 составит
Масса метана в угле составит
0,27 + 0,91 = 1,18 кг
Общее количество углерода в угле составит
Количество свободного углерода в угле составит
2,21- 0,81 = 1,4 кг.
Сгорание сероводорода осуществляется по реакции
H2S + 1,5О2 = Н2О + SO2 (10)
На горение расходуется кислорода
При этом образуется SO2
и влаги
Горение метана осуществляется по реакции
СН4 + 2О2 = СО2 + 2Н2О (11)
На горение метана расходуется кислорода
При этом образуется СО2
и Н2О
Углерод угля сгорает по реакции
С + О2 = СО2 (12)
При этом расходуется кислорода
При этом образуется СО2
Таким образом, при сгорании угля расходуется
6,4 нм3 или
и при этом образуется 0,01 нм3 SO2, 3,91 нм3 СО2 и 4,36 нм3 Н2О.
В угле содержится
Al2O3 - 3∙0,031= 0,09 кг; MgO – 0,0025∙3 = 0,01 кг;
SiO2 – 0,08∙3 = 0,24 кг; СаО- 0,0029∙3= 0,01кг;
прочие – 0,053∙3= 0,15 кг.
Считаем, что эти компоненты переходят в шлак. Тогда количество и состав шлака, выпускаемого из плавильной печи в электропечь, составит (Таблица 50)
Таблица 50- Состав шлака, выпускаемого из плавильной печи в электропечь
В полученном шлаке имеют место соотношения между компонентами шлака
SiO2: Fe = 0,85 и SiO2: Са = 9,14.
В технологическом регламенте процесса плавки рекомендуется поддержание этих соотношений в пределах
если SiO2: Fe = 0,8: 0,9, то SiO2: Са = 7: 15.
Таким образом, полученный шлак отвечает технологическому регламенту плавки. Общее количество кислорода, расходуемое на плавку, составит
23,86 + 6,4 = 30,26 нм3
В процессе плавки используется дутьё, обогащённое кислородом до 55%. Тогда объём дутья на 100 кг концентрата составит
Объём азота в дутье составит
55,04 – 30,27 = 24,77нм3
Для дутья используется воздух и технический кислород, содержащий 95% O2 и 5% N2.Составим балансовые уравнения
Vт.к. + Vвоз. = 55,04
0,95∙Vт.к. + 0,21∙Vвоз = 30,27
Решая уравнения, получим
Vт.к. = 25,29 нм3 и Vвоз = 29,75 нм3
В воздушном дутье содержится азота
29,25∙0,79 = 23,11 нм3 N2 или 23,11∙1,2505 = 28,9 кг
и кислорода
29,25∙0,21 = 6,14 нм3 О2 или 6,14∙1,429 = 8,7кг
В техническом кислороде содержится
25,29∙0,05 = 1,26 нм3 N2 или 1,26∙1,251=1,58 кг
и кислорода
25,29∙0,95 = 24,03 нм3 О2 или 24,03∙1,429 = 34,3 кг
На плавку поступают материалы с влажностью: концентрат -8%, известняк -2,3%, кварцевая руда -6%. Тогда в печь поступает влажного концентрата
влажного известняка
и влажной кварцевой руды
С шихтовыми материалами в печь посупает влаги
8,7 + 1,53 + 0,09 = 11,32 кг, что составляет
С известняком в печь поступает 1,62 кг СО2, что составляет
Состав отходящих газов из плавильной печи, без учёта подсоса воздуха представлен в таблице 51.
Таблица 51 - Состав отходящих газов
3.4.6 Материальный баланс процесса плавки без учёта выноса пыли
На сновании выполненных расчётов составляем материальный баланс процесса плавки. Материальный баланс процесса плавки представлен в таблице 52. Таблица 52- Материальный баланс процесса плавки
Примечание: С*- находится в газовой фазе в виде СО2 Н* - находится в газовой фазе в виде Н2О
3.4.7 Материальный баланс плавки с учётом выноса из печи пыли.
Принимаем, вынос в пыли из печи шлакообразующих оксидов составляет количестве 5%. Тогда количество шакообразующих оксидов металлов в пыли составит:
SiO2– 21,94∙0,05 = 1,1 кг; Al2O3 – 2,1∙0,1 = 0,1 кг;
МgO – 0,74∙0,05 = 0,04 кг; СаО – 2,4∙0,05 = 0,1 кг
Принимаем, что из шлака в пыль переходит 7% Pb, 3% Zn, 3% Fe. Тогда в пыль переходит: 1,33∙0,05 = 0,07 кг Pb, с которым связано кислорода 2,61∙0,03 = 0,08 кг Zn, с которым связано кислорода 25,81∙ 0,03 = 0,77 кг Fe, с которым связано кислорода Принимаем, что из штейна в пыль переходит 3% Pb, 3% Zn, 3% Fe, 3%Сu.
Тогда в пыль переходит:
1,32∙0,03 = 0,04 кг Pb, с которым связано серы 1,12∙0,03 = 0,03 кг Zn, с которым связано серы 3,31∙0,03 = 0,1 кг Fe, с которым связано серы 24,56∙0,03 = 0,74 кг Cu, с которой связано серы Количество и состав пыли процесса плавки представлены и таблице 53
Таблица 53 - Количество и состав пыли процесса плавки
Составляем материальный баланс плавки с учётом выноса из печи продуктов плавки в виде пыли (Таблица 544)
Таблица 54 - Материальный баланс процесса плавки
Загружено | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Концентрат | 108,7 | 26,08 | 27,95 | 2,65 | 3,73 | 36,08 | 1,63 | 0,4 | 0,3 | 0,47 | 8,7 | 0,71 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Известняк | 3,84 | 0,05 | 0,13 | 0,02 | 1,92 | 0,09 | 1,62 | 0,01 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Кварцевая руда | 25,52 | 1,17 | 0,34 | 20,02 | 1,48 | 0,41 | 1,53 | 0,54 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Уголь | 3,45 | 0,01 | 0,24 | 0,09 | 0,01 | 0,01 | 2,21 | 0,28 | 0,45 | 0,15 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Воздух | 37,6 | 8,7 | 28,9 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Технический rислород | 35,9 | 34,3 | 1,6 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Итого | 215,01 | 26,08 | 29,12 | 2,65 | 3,73 | 43,34 | 36,09 | 21,94 | 2,1 | 0,74 | 2,4 | 30,5 | 2,21 | 0,28 | 10,77 | 2,65 | 1,41 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Получено | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Шлак | 64,44 | 0,50 | 25,04 | 1,26 | 2,53 | 8,19 | 0,12 | 20,84 | 2,0 | 0,70 | 2,3 | 0,96 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Штейн | 41,48 | 24,82 | 3,21 | 1,28 | 1,09 | 0,3 | 10,37 | 0,41 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Пыль плавки | 3,68 | 0,76 | 0,87 | 0,11 | 0,11 | 0,25 | 0,20 | 1,1 | 0,1 | 0,04 | 0,1 | 0,04 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Газы | 105,38 | 34,6 | 25,40 | 30,5 | 2,21 | 0,28 | 10,77 | 1,62 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Итого | 214,98 | 26,08 | 29,12 | 2,65 | 3,73 | 43,34 | 36,09 | 21,94 | 2,1 | 0,74 | 2,4 | 30.5 | 2,21 | 0,28 | 10,77 | 2,65 | 1,41 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
3.4.8 Тепловой баланс печи «Айзасмелт».
3.4.8.1 Исходные данные для расчёта
Принимаем теплоёмкости для компонентов плавки
Сшт. = 0,941 кДж/(кг∙град.)
Сшл.. = 1,42 кДж/(кг∙град.)
Сших. = 0,84 кДж/(кг∙град.)
ССО2 = 2,201 кДж/(нм3∙град.)
СSO2 = 2,234 кДж/(нм3∙град.)
СN2 = 1,389 кДж/(нм3∙град.)
СH2O(газ) = 1,724 кДж/(нм3∙град.)
СH2O(ж) = 4,186 кДж/(кг∙град.)
С02 = 1,308 = кДж/(нм3∙град.)
Своз. = 1,297 кДж/(нм3∙град.)
Теплота испарения воды-2300 кДж/кг.
Температура поступающих в печь материалов 25оС.
Температура выпускаемого штейна 1180оС.
Температура выпускаемого шлака 1180 оС.
Температура отходящих газов 1180оС.
Принимаем тепловые эффекты химических реакций [23]
2CuFeS2=Cu2S+2FeS+0,5S2 (13)
∆H 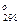 =50,2 кДж/(мольCuFeS2)=276,57 кДж/(кг CuFeS2)
=50,2 кДж/(мольCuFeS2)=276,57 кДж/(кг CuFeS2)
2CuS = Cu2S + 0,5S2 (14)
∆H 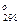 = 26,78 кДж/(моль CuS)= 140,06 кДж/(кг CuS)
= 26,78 кДж/(моль CuS)= 140,06 кДж/(кг CuS)
FeS2 = FeS + 0,5S2 (15)
∆H 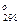 = 71,18 кДж/(моль FeS2)= 593,31кДж/(кг FeS2)
= 71,18 кДж/(моль FeS2)= 593,31кДж/(кг FeS2)
FeS + 3,5O2 = FeO + SO2 (16)
∆H 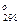 = - 461,33 кДж/(моль FeS)= -5247,75 кДж/(кг FeS)
= - 461,33 кДж/(моль FeS)= -5247,75 кДж/(кг FeS)
S2 + 2O2 = 2SO2 (17)
∆H 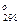 = - 593,8 кДж/(моль S2 = -9260,72 кДж/(кг S2)
= - 593,8 кДж/(моль S2 = -9260,72 кДж/(кг S2)
3FeS + 5O2 = Fe3O4 + 3SO2 (18)
∆H 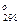 = - 568,86кДж/(моль FeS) = -6470,90 кДж/(кг FeS)
= - 568,86кДж/(моль FeS) = -6470,90 кДж/(кг FeS)
ZnS + 3,5O2 =ZnO + SO2 (19)
∆H 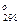 = - 439,33 кДж/(моль ZnS) = -4510,11 кДж/(кг ZnS)
= - 439,33 кДж/(моль ZnS) = -4510,11 кДж/(кг ZnS)
PbS + 3,5O2 = PbO +SO2 (20)
∆H 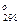 =-415,82 кДж/(моль PbS) =-1739,83 кДж/(кг PbS) (8)
=-415,82 кДж/(моль PbS) =-1739,83 кДж/(кг PbS) (8)
2FeO + SiO2 = 2FeO∙SiO2 (21)
∆H 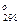 =- 17,15 кДж/(моль FeO) = -238,69 кДж/(кг FeO)
=- 17,15 кДж/(моль FeO) = -238,69 кДж/(кг FeO)
CaO + SiO2 = CaO∙SiO2 (22)
∆H 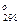 = - 37,54 кДж/(моль CaO) = -670,36 кДж/(кгCaO)
= - 37,54 кДж/(моль CaO) = -670,36 кДж/(кгCaO)
СН4 + О2 = СО2 + Н2О (23)
∆H 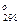 = - 560,81 кДж/(моль CH4) = -35050,58 кДж/(кг СН4)
= - 560,81 кДж/(моль CH4) = -35050,58 кДж/(кг СН4)
С + О2 = СО2 (24)
∆H 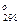 = - 393,51 кДж/(моль С) = -32792,5 кДж/(кг С)
= - 393,51 кДж/(моль С) = -32792,5 кДж/(кг С)
СаСО3 = СаО + СО2 (25)
∆H 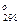 = 179,43 кДж/(моль СaCO3) = 1794,3 кДж/(кг СaCO3)
= 179,43 кДж/(моль СaCO3) = 1794,3 кДж/(кг СaCO3)
3.4.8.2 Приход тепла
 = 5,66 кг
= 5,66 кг = 28,11 кг Cu2S
= 28,11 кг Cu2S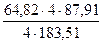 = 31,05 кг FeS.
= 31,05 кг FeS.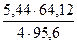 = 0,91 кг
= 0,91 кг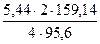 = 4,53 Cu2S
= 4,53 Cu2S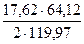 = 4,71кг
= 4,71кг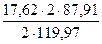 = 12,91 кг FeS
= 12,91 кг FeS = 11,26 кг
= 11,26 кг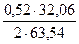 = 0,13 кг S.
= 0,13 кг S.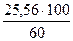 = 42,6 кг
= 42,6 кг = 6,45 кг. (6,45)
= 6,45 кг. (6,45) = 32,01 кг (32,01)
= 32,01 кг (32,01) = 0,3 кг
= 0,3 кг = 1,09 кг
= 1,09 кг = 0,79 кг
= 0,79 кг = 0,43кг
= 0,43кг = 69 %
= 69 %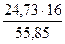 = 7,06 кг кг (7,06)
= 7,06 кг кг (7,06)
 = 0,1 кг
= 0,1 кг = 0,94 кг
= 0,94 кг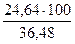 = 67,93 кг (24,64)
= 67,93 кг (24,64)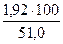 = 3,76 кг.
= 3,76 кг.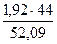 = 1,62 кг
= 1,62 кг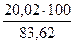 = 23,99 кг.
= 23,99 кг. = 25,34 кг
= 25,34 кг = 17,74 нм3
= 17,74 нм3 = (23,86) нм3
= (23,86) нм3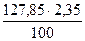 = 3 кг.
= 3 кг. = 3,45 кг
= 3,45 кг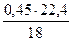 = 0,56 нм3.
= 0,56 нм3.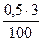 = 0,015 кг
= 0,015 кг = 0,016 кг
= 0,016 кг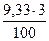 = 0,28 кг
= 0,28 кг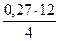 = 0,81 кг
= 0,81 кг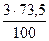 = 2,21 кг
= 2,21 кг  = 0,02 кг или
= 0,02 кг или  = 0,01нм3
= 0,01нм3 = 0,03 кг (0,015 кг S; 0,015 кг О2) или
= 0,03 кг (0,015 кг S; 0,015 кг О2) или 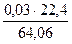 = 0,01 нм3 SO2
= 0,01 нм3 SO2 = 0,02 кг или
= 0,02 кг или  = 0,02 нм3
= 0,02 нм3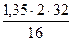 = 5,4 кг или
= 5,4 кг или 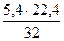 = 3,78 нм3
= 3,78 нм3 = 3,71 кг или
= 3,71 кг или  = 1,89 нм3
= 1,89 нм3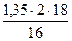 = 3,04 кг или
= 3,04 кг или 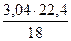 = 3,78 нм3.
= 3,78 нм3.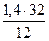 = 3,73 кг или
= 3,73 кг или 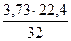 = 2,61 нм3.
= 2,61 нм3.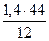 = 3,78 кг или
= 3,78 кг или 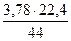 = 1,92 нм3.
= 1,92 нм3.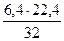 =9,13т кг О2
=9,13т кг О2 = 55,04 нм3
= 55,04 нм3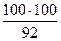 = 108,7 кг, в том числе влаги 8,7 кг
= 108,7 кг, в том числе влаги 8,7 кг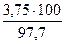 = 3,84 кг, в том числе влаги 0,09 кг
= 3,84 кг, в том числе влаги 0,09 кг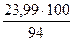 = 25,52 кг, в том числе влаги 1,53 кг.
= 25,52 кг, в том числе влаги 1,53 кг.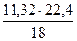 = 14,09 нм3
= 14,09 нм3 = 0,82 нм3.
= 0,82 нм3. = 0,01 кг;
= 0,01 кг;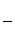
 = 0,02 кг
= 0,02 кг 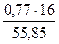 = 0,22 кг
= 0,22 кг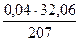 = 0,01 кг
= 0,01 кг = 0,01 кг
= 0,01 кг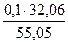 = 0,06 кг
= 0,06 кг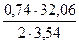 = 0,19 кг
= 0,19 кг


