
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Положение неметаллических элементов в периодической системе химических элементовСтр 1 из 6Следующая ⇒
Положение неметаллических элементов в периодической системе химических элементов
Как видно из таблицы, неметаллические элементы в основном расположены в правой верхней части периодической системы. Строение атомов неметаллов Характерной особенностью неметаллов является большее (по сравнению с металлами) число электронов на внешнем энергетическом уровне их атомов. Это определяет их большую способность к присоединению дополнительных электронов и проявлению более высокой окислительной активности, чем у металлов. Особенно сильные окислительные свойства, т. е. способность присоединять электроны, проявляют неметаллы, находящиеся во 2-ом и 3-м периодах VI-VII групп. Если сравнить расположение электронов по орбиталям в атомах фтора, хлора и других галогенов, то можно судить и об их отличительных свойствах. У атома фтора свободных орбиталей нет. Поэтому атомы фтора могут проявить только валентность I и степень окисления ― 1. Самым сильным окислителем является фтор. В атомах других галогенов, например в атоме хлора, на том же энергетическом уровне имеются свободные d-орбитали. Благодаря этому распаривание электронов может произойти тремя разными путями. В первом случае хлор может проявить степень окисления +3 и образовать хлористую кислоту HClO2, которой соответствуют соли ― хлориты, например хлорит калия KClO2. Во втором случае хлор может образовать соединения, в которых степень окисления хлора +5. К таким соединениям относятся хлорноватая кислота HClO3 и ее соли ― хлораты, например хлорат калия КClO3 (бертолетова соль). В третьем случае хлор проявляет степень окисления +7, например в хлорной кислоте HClO4 и в ее солях, ― перхлоратах (в перхлорате калия КClO4). Строения молекул неметаллов. Физические свойства неметаллов В газообразном состоянии при комнатной температуре находятся: · водород ― H2; · азот ― N2; · кислород ― O2; · фтор ― F2; · хлор ― CI2. И инертные газы: · гелий ― He; · неон ― Ne; · аргон ― Ar;
· криптон ― Kr; · ксенон ― Xe; · радон ― Rn). В жидком ― бром ― Br. В твердом: · бор ― B; · углерод ― C; · кремний ― Si; · фосфор ― P; · сера ― S; · мышьяк ― As; · селен ― Se; · теллур ― Te; · йод ― I; · астат ― At. Гораздо богаче у неметаллов и спектр цветов: красный ― у фосфора, бурый ― у брома, желтый ― у серы, желто-зеленый ― у хлора, фиолетовый ― у паров йода и т. д. Самые типичные неметаллы имеют молекулярное строение, а менее типичные ― немолекулярное. Этим и объясняется отличие их свойств. Виды соединений неметаллов
Общие формулы водородных соединений по группам периодической системы химических элементов приведены в таблицe:
С металлами водород образует (за некоторым исключением) нелетучие соединения, которые являются твердыми веществами немолекулярного строения. Поэтому их температуры плавления сравнительно высоки. С неметаллами водород образует летучие соединения молекулярного строения (например, фтороводород HF, сероводород H2S, аммиак NH3, метан CH4). В обычных условиях это газы или летучие жидкости. При растворении в воде водородные соединения галогенов, серы, селена и теллура образуют кислоты той же формулы, что и сами водородные соединения: HF, HCl, HBr, HI, H2S, H2Se, H2Te. При растворении в воде аммиака образуются аммиачная вода, обычно обозначаемая формулой NH4OH и называемая гидроксидом аммония. Ее также обозначают формулой NH3∙H2O и называют гидратом аммиака. С кислородом неметаллы образуют кислотные оксиды. В одних оксидах они проявляют максимальную степень окисления, равную номеру группы (например, SO2, N2O5), а других ― более низкую (например, SO2, N2O3). Кислотным оксидам соответствуют кислоты, причем из двух кислородных кислот одного неметалла сильнее та, в которой он проявляет более высокую степень окисления. Например, азотная кислота HNO3 сильнее азотистой HNO2, а серная кислота H2SO4 сильнее сернистой H2SO3. Характеристики кислородных соединений неметаллов 1. Свойства высших оксидов (т. е. оксидов, в состав которых входит элемент данной группы с высшей степенью окисления) в периодах слева направо постепенно изменяются от основных к кислотным.
2. В группах сверху вниз кислотные свойства высших оксидов постепенно ослабевают. Об этом можно судить по свойствам кислот, соответствующих этим оксидам. 3. Возрастание кислотных свойств высших оксидов соответствующих элементов в периодах слева направо объясняется постепенным возрастанием положительного заряда ионов этих элементов. 4. В главных подгруппах периодической системы химических элементов в направлении сверху вниз кислотные свойства высших оксидов неметаллов уменьшаются. Галогены. Строение атомов галогенов К галогенам относятся элементы VIII группы периодической системы, атомы этих элементов содержат на внешнем энергетическом уровне семь электронов и до его завершения им недостает только одного электрона, поэтому галогены проявляют яркие окислительные свойства. В подгруппе с увеличением порядкового номера эти свойства уменьшаются в связи с увеличением радиуса атомов: от фтора к астату ― и, соответственно, возрастают восстановительные свойства их. Аналогично уменьшается и значение относительной электроотрицательности галогенов. Как наиболее электроотрицательный элемент, фтор в соединениях с другими элементами проявляет постоянную степень окисления -1. Остальные галогены могут проявлять как эту степень окисления в соединениях с металлами, водородом и менее электроотрицательными элементами, так и положительные нечетные степени окисления от +1 до +7 в соединениях с более электроотрицательными элементами: кислородом, фтором. Подгруппа кислорода
Подгруппа азота
Важнейшие формы кислотных оксидов элементов этой подгруппы Э2О3 и Э2О5, им соответствуют кислоты НЭО2 или Н3ЭО3, и НЭО2 или Н3ЭО4: · N2+3O3 → HN+3O2 (азотистая кислота); · N2+5O5 → HN+5O3 (азотная кислота); · · Элементы подгруппы азота образуют газообразные водородные соединения (NH3 ― аммиак, РН3 ― фосфин). Водные растворы аммиака и фосфина представляют собой слабые основания:
NH3 + Н2О ↔ NH4ОН ↔ NH4+ + ОН – (гидроксид аммония); РH3 + Н2О ↔ РH4ОН ↔ РH4+ + ОН- (гидроксид фосфония). Подгруппа углерода
Летучие водородные соединения, образуемые элементами подгруппы углерода, имеют общую формулу ЭН4. Среди них только метан СН4 является устойчивым соединением. Силан SiН4 малоустойчив и самовоспламеняется на воздухе. Еще менее устойчивы GeН4, SnН4, PbН4. Низшие оксиды углерода и кремния СО и SiO являются несолеобразующими оксидами, а оксиды двухвалентных германия, олова и свинца GeО, SnО, PbО ― амфотерными оксидами. Высшие оксиды углерода и кремния СО2 и SiO2 являются кислотными оксидами, которым соответствуют гидроксиды, проявляющие слабокислотные свойства ― угольная кислота Н2СО3 и кремниевая кислота Н2SiО3. Амфотерным оксидам ― GeО2, SnО2, PbО2 ― соответствуют амфотерные гидроксиды, причем при переходе от гидроксида германия Ge(ОН)4 к гидроксиду свинца Pb(ОН)4 кислотные свойства ослабляются, а основные усиливаются. Положение неметаллических элементов в периодической системе химических элементов
Как видно из таблицы, неметаллические элементы в основном расположены в правой верхней части периодической системы. Строение атомов неметаллов Характерной особенностью неметаллов является большее (по сравнению с металлами) число электронов на внешнем энергетическом уровне их атомов. Это определяет их большую способность к присоединению дополнительных электронов и проявлению более высокой окислительной активности, чем у металлов. Особенно сильные окислительные свойства, т. е. способность присоединять электроны, проявляют неметаллы, находящиеся во 2-ом и 3-м периодах VI-VII групп. Если сравнить расположение электронов по орбиталям в атомах фтора, хлора и других галогенов, то можно судить и об их отличительных свойствах. У атома фтора свободных орбиталей нет. Поэтому атомы фтора могут проявить только валентность I и степень окисления ― 1. Самым сильным окислителем является фтор. В атомах других галогенов, например в атоме хлора, на том же энергетическом уровне имеются свободные d-орбитали. Благодаря этому распаривание электронов может произойти тремя разными путями. В первом случае хлор может проявить степень окисления +3 и образовать хлористую кислоту HClO2, которой соответствуют соли ― хлориты, например хлорит калия KClO2. Во втором случае хлор может образовать соединения, в которых степень окисления хлора +5. К таким соединениям относятся хлорноватая кислота HClO3 и ее соли ― хлораты, например хлорат калия КClO3 (бертолетова соль). В третьем случае хлор проявляет степень окисления +7, например в хлорной кислоте HClO4 и в ее солях, ― перхлоратах (в перхлорате калия КClO4).
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-02-07; просмотров: 78; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 13.58.137.218 (0.017 с.) |

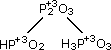 (фосфористые кислоты);
(фосфористые кислоты);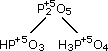 (фосфорная кислота).
(фосфорная кислота).


