
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Определение теплоты растворения солиСтр 1 из 3Следующая ⇒
Мартынова Оформление результатов эксперимента и обработка экспериментальных данных Для точного определения ∆T было бы идеально, если бы перед началом исследуемого процесса и по его завершении температура в калометрическом стакане оставалась постоянной: Весь опыт делят на три периода: 1) предварительный, продолжающийся не менее 5 минут; 2) главный – время протекания исследуемого процесса, с продолжительностью 2-3 минуты; 3) заключительный, продолжающийся также не менее 5 минут. По экспериментальным данным строят график зависимости измерения температуры во времени (рис.4)
С некоторым допущением можно принять, что теплообмен, характеризуемый участком АВ, продолжается в ходе изучаемого процесса от его начала до середины, а от середины до конца процесса теплообмен протекал со скоростью, характеризуемой участком ДЕ. Продолжив отрезки АВ и ДЕ до пересечения с перпендикуляром КК’, восстановленным из середины отрезка B’Д’, который отражает продолжительность главного процесса, находят поправки, обусловленные влиянием внешнего теплообмена на изучаемый процесс. Таким образом, находят ∆Т = КК’. Постоянную калориметрическую установки рассчитывают по уравнению:
где Лабораторная работа №1 Определение теплоты растворения соли Цель работы – определение интегральной теплоты растворения соли в воде. Приборы и реактивы: калориметрическая установка: аналитические весы; мерный цилиндр на 250 см3 ; секундомер; хлорид калия;исследуемая соль: KCL3 , KNCS, K2SO4 , NH4NO3 (по указанию преподавателя); дистиллированная вода.
Порядок выполнения работы 1. Определение постоянной калориметрической установки. Определяют константу калориметрической установки по теплоте растворения KCL,методика эксперимента описана выше. Освобождают калориметр от содержимого и подготавливают к следующему опыту. 2. Определение интегральной теплоты растворения. Проводят калориметрический опыт как при определении постоянной калориметрической установки, только вместо KCL в калориметрический стакан всыпают взятую ранее точную навеску сухой и тщательно измельченной исследуемой соли (m = 1-2 г). Лабораторная работа №2 Порядок выполнения работы 1. Определение теплоёмкости калориметрической установки. Определяют теплоёмкость калориметрической установки 2. Определение суммарной теплоты процессов, протекающих в калориметре 3. Определение теплоты процесса разбавления кислоты щёлочью
4. Определение теплоты процесса разбавления щёлочи водным раствором кислоты
Лабораторная работа №3 Порядок выполнения работы. В данной работе предлагается определить теплоту нейтрализации уксусной кислоты раствором гидроксида калия. Последовательность выполнения работы та же, что и в работе 2. Обработка экспериментальных данных. Обработка экспериментальных данных трех калориметрических опытов аналогична описанной работе 2 (п. 1-6). Теплоту нейтрализации слабой кислоты сильным основанием необходимо рассчитать по формуле
Теплоту диссоциации уксусной кислоты следует рассчитать по уравнению(2.58). Форма отчета. Отчет должен содержать название и цель работы, краткие теоретические положения, порядок выполнения работы, таблицы экспериментальных данных, графики изменения температуры во времени, результаты расчета, выводы о проделанной работе.
Лабораторная работа №4 Определение теплоты образования кристаллогидрата Цель работы – определение теплоты образования CuSO4·5H2O из CuSO4 и H2O. Приборы и реактивы - калориметрическая установка; - аналитические весы; - мерный цилиндр на 250 см3; - секундомер; - сушильный шкаф; - эксикатор; - фарфоровая ступка; - фарфоровая чашка; - пробирка с резиновой пробкой; - KCl; - CuSO4·5H2O; - дистиллированная вода. Порядок выполнения работы. 1. Получение безводного сульфата меди. Навески безводной соли и кристаллогидрата подбирают так, чтобы концентрации соли в образующихся растворах были одинаковыми. Для этого берут две точечные навески по 2 г растертого в порошок кристаллогидрата CuSO4·5H2O. Одну навеску нагревают в сушильном шкафу при t =240-250oC до постоянной массы (m=1,28 г) и перехода голубой окраски CuSO4·5H2Oв белую, характерную для безводного CuSO4. По окончании процесса гидратации безводныйCuSO4 охлаждают и хранят в эксикаторе либо в пробирке, закрытой с помощью резиновой пробки. 2. Определение константы калориметрической установки. Определяют константу калориметрической установки CK по теплоте растворения KCl.(методика эксперимента описана перед работой 1). Освобождают калориметрическую установку и подготавливают к следующему опыту. 3.Определение интегральной теплоты растворения кристаллогидрата. Наливают в калориметрический стакан 150 см3 дистиллированной воды и проводят калориметрический опыт как при определении постоянной калориметрической установки, всыпая вместо KCl взятую ранее точную навеску CuSO4·5H2O массой 2 г. По окончании опыта освобождают калориметрическую установку и подготавливают к следующему опыту. 4.Определение интегральной теплоты растворения безводной соли. Наливают в калориметрический стакан 150 см3 дистиллированной воды и точно так же проводят калориметрический опыт, всыпая заранее полученный безводный сульфат меди массой 1,28 г. Операцию внесения CuSO4 в воду необходимо провести как можно скорее, чтобы соль не поглотила влагу из воздуха. Вопросы и задачи для самоконтроля 1На какую величину различаются:
а) энтальпия от внутренней энергии; б) изохорно–изотермический потенциал от внутренней энергии; в) изобарно–изотермический потенциал от изохорно–изотермического потенциала; г) изобарно–изотермический потенциал от энтальпии; д) тепловые эффекты при постоянном давлении и постоянном объеме? 2Какой смысл имеют знаки «плюс» или «минус» перед термодинамическими функциями: теплотой, работой, изменением внутренней энергии? 3Какие выводы можно сделать о конкретной химической реакции, если изменение следующих термодинамических функций отрицательно: а) энтальпии; б) энтропии; в) свободной энергии Гиббса? 4 Изменением какой термодинамической функции определяется возможность самопроизвольного протекания процесса: а) при постоянных давлении и температуре; б) при постоянных объеме и температуре; в) в изолированной системе? 5Напишите следующие уравнения: а) уравнение первого начала термодинамики для макро– и микропроцессов; б) уравнение первого начала термодинамики для изохорного, изобарного, изотермического и адиабатического процессов; в) уравнение Кирхгофа в дифференциальной и интегральной формах. Какую зависимость выражает каждое из написанных уравнений?
Мартынова Оформление результатов эксперимента и обработка экспериментальных данных Для точного определения ∆T было бы идеально, если бы перед началом исследуемого процесса и по его завершении температура в калометрическом стакане оставалась постоянной: Весь опыт делят на три периода: 1) предварительный, продолжающийся не менее 5 минут; 2) главный – время протекания исследуемого процесса, с продолжительностью 2-3 минуты; 3) заключительный, продолжающийся также не менее 5 минут. По экспериментальным данным строят график зависимости измерения температуры во времени (рис.4)
С некоторым допущением можно принять, что теплообмен, характеризуемый участком АВ, продолжается в ходе изучаемого процесса от его начала до середины, а от середины до конца процесса теплообмен протекал со скоростью, характеризуемой участком ДЕ. Продолжив отрезки АВ и ДЕ до пересечения с перпендикуляром КК’, восстановленным из середины отрезка B’Д’, который отражает продолжительность главного процесса, находят поправки, обусловленные влиянием внешнего теплообмена на изучаемый процесс. Таким образом, находят ∆Т = КК’. Постоянную калориметрическую установки рассчитывают по уравнению:
где Лабораторная работа №1 Определение теплоты растворения соли Цель работы – определение интегральной теплоты растворения соли в воде. Приборы и реактивы: калориметрическая установка: аналитические весы; мерный цилиндр на 250 см3 ; секундомер; хлорид калия;исследуемая соль: KCL3 , KNCS, K2SO4 , NH4NO3 (по указанию преподавателя); дистиллированная вода.
|
||||||||
|
Последнее изменение этой страницы: 2021-03-09; просмотров: 776; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.119.105.239 (0.023 с.) |
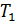 до процесса и
до процесса и  после него. В реальных условиях температура калориметрической системы непрерывно изменяется как до, так и после процесса вследствие теплообмена с окружающей средой. Таким образом, при определении ∆Tнеобходимо внести поправку на теплообмен.
после него. В реальных условиях температура калориметрической системы непрерывно изменяется как до, так и после процесса вследствие теплообмена с окружающей средой. Таким образом, при определении ∆Tнеобходимо внести поправку на теплообмен.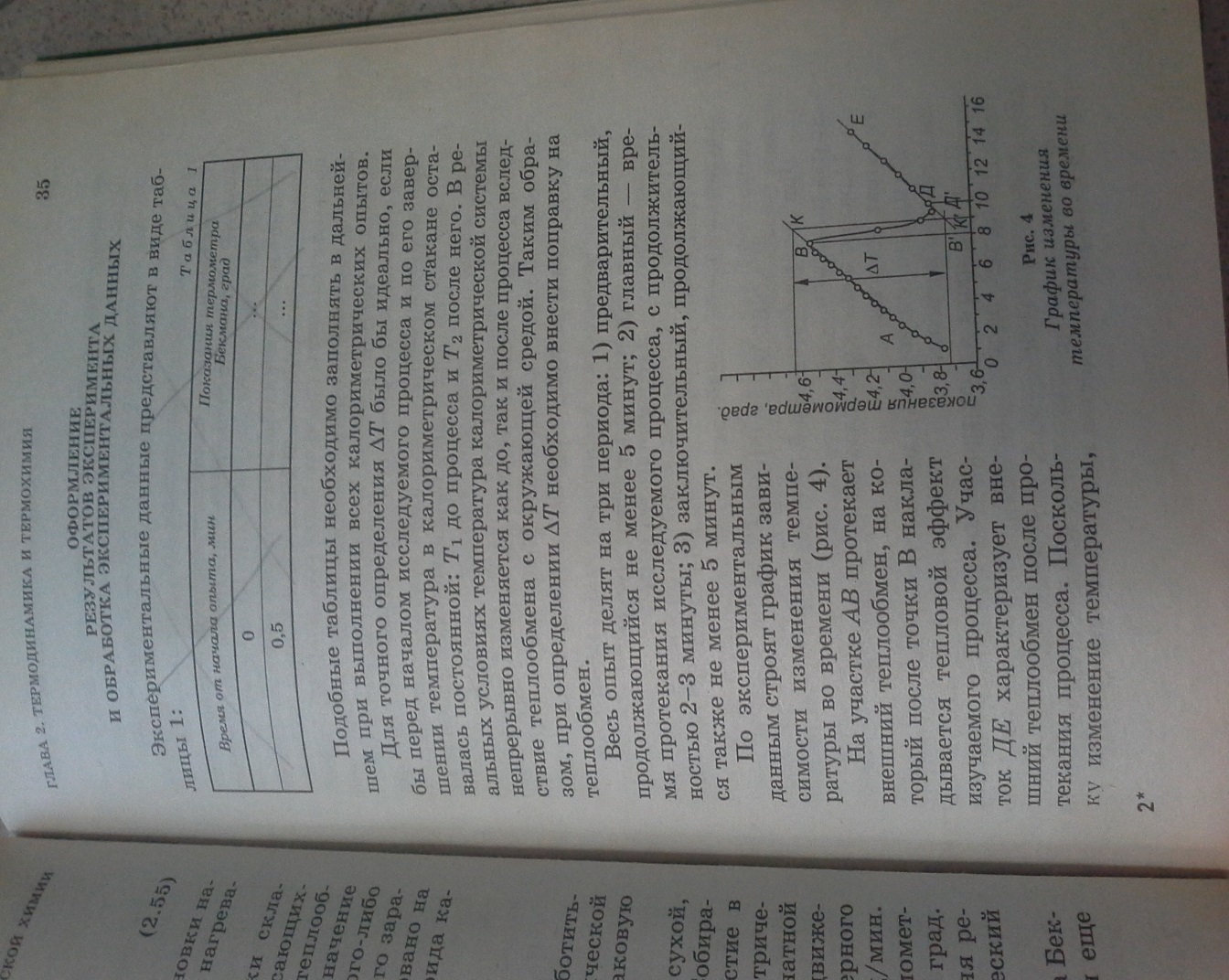 На участке ABпротекает внешний теплообмен, на который после точки B накладывается тепловой эффект изучаемого процесса. Участок ДЕ характеризует внешний теплообмен после протекания процесса. Поскольку изменение температуры, вызванное теплообменом, линейно, то точка Д, где кривая ВД сопрягается с прямой ДЕ, указывает на прекращение влияния изучаемого процесса на внешний теплообмен.
На участке ABпротекает внешний теплообмен, на который после точки B накладывается тепловой эффект изучаемого процесса. Участок ДЕ характеризует внешний теплообмен после протекания процесса. Поскольку изменение температуры, вызванное теплообменом, линейно, то точка Д, где кривая ВД сопрягается с прямой ДЕ, указывает на прекращение влияния изучаемого процесса на внешний теплообмен.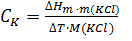 ,
,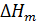 –интегральная теплота растворения KClв воде, значение которой приводится в Приложении (табл.4); m(KCl) –навеска KCl, г;M(KCl)- молярная массаKCl
–интегральная теплота растворения KClв воде, значение которой приводится в Приложении (табл.4); m(KCl) –навеска KCl, г;M(KCl)- молярная массаKCl по теплоте растворения KCL в воде.
по теплоте растворения KCL в воде. Мерным цилиндром отмеряют и заливают в калориметрический стакан 150
Мерным цилиндром отмеряют и заливают в калориметрический стакан 150  0,1 моль/
0,1 моль/ 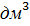 раствора щёлочи. Собирают калориметрическую установку. Перемешивая раствор мешалкой,дожидаются замедления движения столбика ртути и приступают к отсчётам температуры через каждые 30 секунд. Производят 10-12 отсчётов и на тридцатой секунде последнего отсчёта с помощью мерной пипетки осторожно вливают в калориметрический стакан 5
раствора щёлочи. Собирают калориметрическую установку. Перемешивая раствор мешалкой,дожидаются замедления движения столбика ртути и приступают к отсчётам температуры через каждые 30 секунд. Производят 10-12 отсчётов и на тридцатой секунде последнего отсчёта с помощью мерной пипетки осторожно вливают в калориметрический стакан 5  .При проведении калориметрического опыта 5
.При проведении калориметрического опыта 5  раствора кислоты вливают в 150
раствора кислоты вливают в 150  только вместо раствора щёлочи в калориметрический стакан заливается 150
только вместо раствора щёлочи в калориметрический стакан заливается 150  .Так как объём щёлочи велик и мало изменяется при вливании в него кислоты, величиной
.Так как объём щёлочи велик и мало изменяется при вливании в него кислоты, величиной  =
= 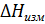 -
- 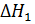 .
.


