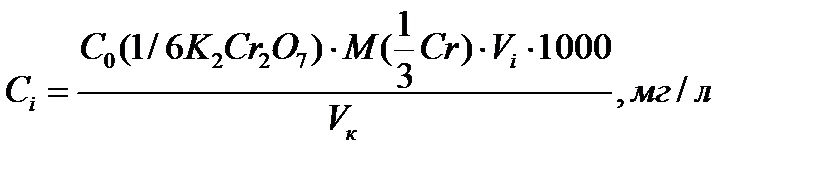Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Работа 4. Определение хрома (VI) дифенилкарбазидом
Определение малых количеств хрома (VI) в растворе основано на способности дихромат-ионов в кислой среде образовывать с дифенилкарбазидом растворимое соединение красно-фиолетового цвета. Предполагают, что дихромат-ионы окисляют дифенилкарбазид до дифенилкарбазона:
Продукты окислительно-восстановительной реакции Cr(III) и дифенилкарбазон образуют комплексное соединение, интенсивность окраски которого пропорциональна содержанию Cr(VI) в растворе. Чистота реактивов и кислотность раствора оказывают существенное влияние на интенсивность окраски. Оптимальной является кислотность 0,05-0,1 М по серной кислоте. Интенсивная полоса в спектре поглощения продукта реакции наблюдается при λ ~ 540 нм (ελ . = 4,3 . 104). Метод характеризуется высокой чувствительностью и избирательностью к ионам хрома(Vl) и обычно его используют для определения следовых количеств хрома.
Цель работы: Определение содержания ионов хрома (VI) дифенилкарбазидом в сточных водах методом прямой фотометрии с использованием градуировочного графика; оценка правильности и воспроизводимости результатов определения.
Реактивы, посуда, приборы Стандартный раствор дихромата калия, С (1/6 K2Cr2O7) = 0,1000 моль/л. Дифенилкарбазид, 0,1%-й спиртовой раствор. Серная кислота, 1М раствор. Мерные колбы вместимостью 50,00 мл; 100,0 мл. Пипетки вместимостью 1,00 мл, 5,00 мл и 10,00 мл. Спектрофотометр. Кюветы l = 5см.
Выполнение работы
Приготовление стандартных растворов K 2 Cr 2 O 7. Стандартные растворы дихромата калия используют для построения градуировочного графика. 1. Рабочий раствор дихромата калия с С (1/6K2Cr2O7) = 0,01000 моль/л (раствор №1) готовят разбавлением стандартного 0,1000 М раствора K2Cr2O7 в 10 раз. Для этого в мерную колбу вместимостью 100,0 мл пипеткой переносят 10,00 мл раствора С (1/6K2Cr2O7) = 0,1000 моль/л и доводят объем раствора до метки дистиллированной водой. 2. Рабочий раствор дихромата калия с С (1/6K2Cr2O7) = 0,5 . 10–3 моль/л (раствор №2) готовят разбавлением раствора №1 в 20 раз в мерной колбе вместимостью 100,0 мл. В 1мл полученного раствора содержится 8,66 мг Cr6+. 3. Приготовление серии стандартных растворов Cr(VI). В 5 мерных колб вместимостью 50,00 мл пипеткой переносят 1,00; 2,00; 3,00; 4,00; 5,00 мл стандартного раствора № 2 с С (1/6K2Cr2O7) = 0,5 . 10–3 моль/л. В каждую колбу прибавляют 1 мл 1 М раствора H2SO4, 1 мл раствора дифенилкарбазида, доводят до метки дистиллированной водой и перемешивают.
Рассчитывают концентрацию Cr(VI) в каждой колбе по формуле
где С 0(1/6K2Cr2O7) – концентрация стандартного раствора дихромата калия (раствор №2), моль/л; Vi – объем стандартного раствора K2Cr2O7, мл; V к – вместимость мерной колбы, мл. Одновременно готовят раствор сравнения (холостая проба). В мерную колбу вместимостью 50,00 мл прибавляют 1 мл 1 М раствора H2SO4, 1 мл раствора дифенилкарбазида, доводят до метки водой и перемешивают. Через 10 минут после приготовления измеряют оптическую плотность стандартных растворов относительно раствора сравнения. Все последующие этапы работы (выбор длины волны, толщины кюветы, построение градуировочного графика, проверка его стабильности во времени) проводят в соответствии с задачами исследования (раздел 2.1.2) и порядком выполнения работ, указанном в начале раздела 2.1.3. Определение концентрации хрома (VI) в анализируемой воде. Для определения Cr(VI) в анализируемом растворе аликвоту этого раствора помещают в мерную колбу вместимостью 50,0 мл, прибавляют 1 мл 1М раствора H2SO4, 1 мл дифенилкарбазида, доводят до метки водой, перемешивают. Через 10 минут измеряют оптическую плотность раствора относительно раствора сравнения. Измерения проводят при тех же условиях (длина волны, толщина кюветы, раствор сравнения), при которых фотометрировали стандартные растворы. Проводят от 4 до 6 параллельных определений для последующей оценки воспроизводимости и правильности результатов. Содержание ионов Cr(VI) в фотометрируемом растворе находят по уравнению градуировочного графика. Для одного из параллельных измерений оптической плотности содержание ионов хрома (VI) определяют по графику. При расчете концентрации в анализируемом растворе учитывают его разбавление.
|
|||||
|
Последнее изменение этой страницы: 2021-03-09; просмотров: 1086; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.15.237.255 (0.006 с.) |