Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Общая характеристика лантаноидовСтр 1 из 5Следующая ⇒
ЛИТЕРАТУРНЫЙ ОБЗОР Общая характеристика лантаноидов
.1.1 Строение атомов Электронная конфигурация атомов лантаноидов может быть выражена общей формулой 4f2-145s25p65d0-16s2. В основе электронной структуры атомов РЗЭ лежит электронная структура ксенона, сверх которой, начиная с церия, происходит заполнение 4f-орбитали, а также имеется два или три валентных электрона (6s1 или 5d16s2). В соответствии с положением в периодической системе все электроны, имеющиеся в лантаноидах, делят на четыре группы: 1. внутренняя замкнутая оболочка ксенона (от 1s1 до 4d10); . некомпенсированная “магнитная” 4f-оболочка; . экранирующая 5s25p6-оболочка; . электроны проводимости 5d16s2. У лантаноидов электроны 4f-орбитали связаны значительно прочнее, чем электроны 5d- и 6s- орбиталей, которые связаны примерно одинаково. Валентности лантаноидов определяются числом электронов проводимости. Поэтому лантан (La), гадолиний (Gd), лютеций (Lu) - трехвалентны, остальные лантаноиды могут быть трехвалентными за счет f-d переходов, вероятность которых и определяет их валентность. Трехвалентное состояние наиболее устойчиво для лантаноидов (его называют характеристическим) [3,4].
.1.2 Особенности комплексообразования ионов РЗЭ Первым описанным в литературе внутрикомплексным соединением РЗЭ был ацетилацетонат лантана, полученный Урбеном в начале CC в. Однако его комплексная природа не была вскрыта, и сведения о комплексах РЗЭ ограничивались данными о двойных солях - нитратах, сульфатах и др. В настоящее время известно большое число устойчивых комплексов РЗЭ, образованных полидентатными лигандами [5]. Особеннности электронного строения f-элементов объясняют ряд специфических особенностей их комплексообразования: . Природа связи в комплексах РЗЭ носит преимущественно ионный характер, что объясняется сравнительно большим ионным радиусом и наличием замкнутой электронной оболочки, экранирующей 4f-орбитали и препятствующей их перекрыванию с орбиталями лигандов. . Достаточно большой размер ионов РЗЭ и наличие доступных вакантных 5d-орбиталей делает их сильными льюисовыми кислотами. Только совсем недавно установлено, что координационное число (КЧ) в комплексах РЗЭ в подавляющем большинстве случаев больше шести. Еще до 1966г. Все работающие в этой области исследователи предполагали по аналогии с другими трехзарядными ионами (например Al3+), что КЧ ионов РЗЭ всегда 6. Сейчас доказано, что КЧ может быть 7,8,9,10 и даже 12. Количество молекул координационно связанного лиганда, как правило, зависит от способа выделения комплекса из раствора. Высокая комплексообразующая способность соединений РЗЭ обуславливается, прежде всего, наличием у металлов незаполненной 5dz2-орбитали [6].
. Наблюдается сильное взаимное влияние однородных и разнородных лигандов во внутренней координационной сфере и взаимное ослабление связей центрального иона РЗЭ с каждым из лигандов по мере последовательного вхождения нескольких лигандов в координационную сферу [7]. . Лабильность комплексов РЗЭ и способность ионов РЗЭ образовывать комплексы с переменными и высокими координационными числами приводит к тому, что в растворе существует смесь комплексов РЗЭ различного состава и строения. В твердом состоянии из раствора выделяется трудноразделяемая смесь с различным соотношением Ln-L. ПРАКТИЧЕСКАЯ ЧАСТЬ Реактивы
· Неодим (металлический); · Тербий (металлический); · Ацетилацетон; · Ацетонитрил; · Хлорид лития, безводный; · Насыщенный хлорсеребряный электрод с электролитным мостом, заполненным неводным раствором LiCl; · 0,2 М серная кислота; · 0,1%ный раствор ксиленолового оранжевого; · Соляная кислота; · Уротропин (сухой); · 0,1 н ЭДТА.
Методика синтеза
Электросинтез безводных ацетилацетонатов редкоземельных элементов проводят следующим образом. Составляется электрическая цепь, содержащая в качестве источника тока регулируемый понижающий трансформатор (ЛАТР) на 220 В, электролизер, включенный последовательно выпрямительный диод (например, серии кд 202), амперметр на 100 mА, вольтметр на 1-10 В и выключатель тока. Электролизер составляют из стеклянного сосуда (химический стакан), в который помещены два электрода: один из металлического редкоземельного элемента, другой из графита. В сосуд заливается электролит, состоящий из раствора ацетилацетона и хлорида лития в ацетонитриле в соотношении соответственно (1-10):1:500.Трансформатор устанавливают в положение минимального выходного напряжения, включают в цепь переменного тока на 220 B, 50 Гц, замыкают выключатель тока и регулируют таким образом, чтобы вольтметр показал напряжение между электродами 1-5 В, проходящий через электролизер ток при этом должен соответствовать анодной плотности тока 10-50 mA/см2 на амперметре. Реакцию проводят при комнатной температуре. Электролиз при таких параметрах ведут 1-2 ч. Полученный твердый продукт в виде осадка на дне сосуда декантируют, промывают абсолютным спиртом и сушат под вакуумом или в атмосфере аргона над Р2О5.
Механизм протекания электросинтеза заключается в анодном растворении металла, вводимого в состав координационного соединения. Образующийся катион металла присоединяет лиганд, образуя комплексные соединения.
K: HAA + ē → AA‒ + ½ H2 H2O +ē → OH‒ + ½ H2;: Ln 0 - 3ē → Ln 3+, Ln 3+ + 3AA‒ → [Ln(AA)3]
где Ln - металл, участвующий в реакции анодного синтеза (Nd, Tb); AA- лиганд, вступающий в реакцию синтеза с металлом (ацетилацетон); e - электрон. 2.4.1 Ацетилацетонат неодима Анод из металлического неодима со степенью чистоты 99,99%. Соотношение компонентов раствора 5:1:500, потенциал анода -0,5 В. Сушку осуществляли в эксикаторе в атмосфере аргона над Р2О5.
2.4.2 Ацетилацетонат тербия Реакцию проводят при комнатной температуре. Анод из металлического тербия со степенью чистоты 99,99%. Соотношение компонентов раствора 10:1:500, потенциал -0,202 В. Сушку осуществляли в вакуумном эксикаторе при 1-10 мм рт. ст. над СаО. Условия проведения синтеза указаны в таблице 1.
Таблица 1 - Условия электрохимического синтеза комплексных соединений
Выводы
По итогам данной работы можно сделать следующие выводы: . На основе анализа сравнительных вольтамперометрических данных для электрохимических систем, содержащих и не содержащих лиганд, обнаружено смещение потенциала полуволны реакции анодной ионизации неодима с -1,5 до -1 вольта и тербия с -1,02 до -0,502 вольт; . Проведен электрохимический синтез ацетилацетонатов неодима и тербия в трехэлектродной ячейке при контролируемом потенциале на 0,3-0,5 вольта больше, чем потенциал полярографического максимума; . Состав соединений по данным анализа соответствует безводным несольватированным трис-ацетилацетонатам неодима и тербия, что согласуется с литературными данными по аналогичным соединениям, синтезированным электрохимически при неконтролируемом высоком электродном потенциале; . Сравнение электрохимической эффективности синтеза показывает увеличение выхода по току для синтеза при контролируемом потенциале на 4% по сравнению с неконтролируемым синтезом.
ПРИЛОЖЕНИЯ
ПРИЛОЖЕНИЕ А
ИК-спектры
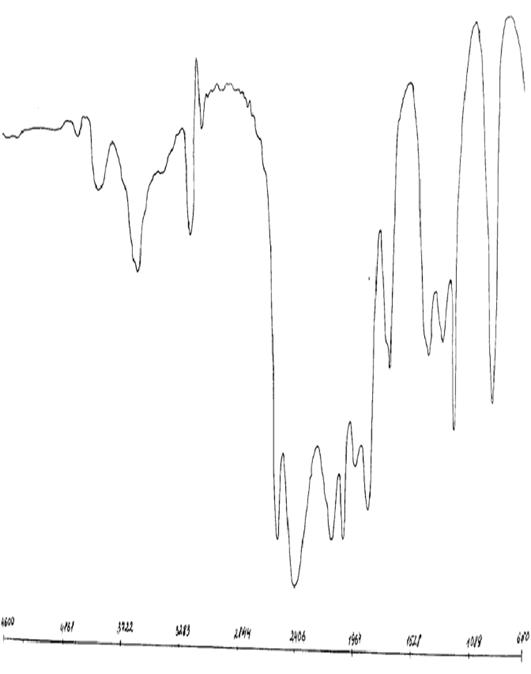
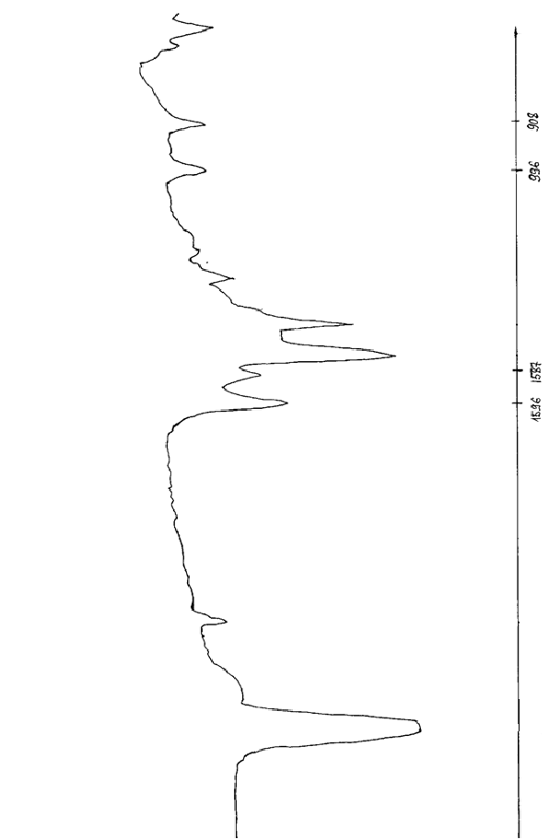
Рисунок А.1 - ИК-спектр ацетилацетона
Рисунок А.2 - ИК-спектр ацетилацетоната неодима
Рисунок А.3 - ИК-спектр ацетилацетоната тербия ЛИТЕРАТУРНЫЙ ОБЗОР Общая характеристика лантаноидов
.1.1 Строение атомов Электронная конфигурация атомов лантаноидов может быть выражена общей формулой 4f2-145s25p65d0-16s2. В основе электронной структуры атомов РЗЭ лежит электронная структура ксенона, сверх которой, начиная с церия, происходит заполнение 4f-орбитали, а также имеется два или три валентных электрона (6s1 или 5d16s2). В соответствии с положением в периодической системе все электроны, имеющиеся в лантаноидах, делят на четыре группы: 1. внутренняя замкнутая оболочка ксенона (от 1s1 до 4d10); . некомпенсированная “магнитная” 4f-оболочка; . экранирующая 5s25p6-оболочка; . электроны проводимости 5d16s2. У лантаноидов электроны 4f-орбитали связаны значительно прочнее, чем электроны 5d- и 6s- орбиталей, которые связаны примерно одинаково. Валентности лантаноидов определяются числом электронов проводимости. Поэтому лантан (La), гадолиний (Gd), лютеций (Lu) - трехвалентны, остальные лантаноиды могут быть трехвалентными за счет f-d переходов, вероятность которых и определяет их валентность. Трехвалентное состояние наиболее устойчиво для лантаноидов (его называют характеристическим) [3,4].
.1.2 Особенности комплексообразования ионов РЗЭ Первым описанным в литературе внутрикомплексным соединением РЗЭ был ацетилацетонат лантана, полученный Урбеном в начале CC в. Однако его комплексная природа не была вскрыта, и сведения о комплексах РЗЭ ограничивались данными о двойных солях - нитратах, сульфатах и др. В настоящее время известно большое число устойчивых комплексов РЗЭ, образованных полидентатными лигандами [5]. Особеннности электронного строения f-элементов объясняют ряд специфических особенностей их комплексообразования: . Природа связи в комплексах РЗЭ носит преимущественно ионный характер, что объясняется сравнительно большим ионным радиусом и наличием замкнутой электронной оболочки, экранирующей 4f-орбитали и препятствующей их перекрыванию с орбиталями лигандов. . Достаточно большой размер ионов РЗЭ и наличие доступных вакантных 5d-орбиталей делает их сильными льюисовыми кислотами. Только совсем недавно установлено, что координационное число (КЧ) в комплексах РЗЭ в подавляющем большинстве случаев больше шести. Еще до 1966г. Все работающие в этой области исследователи предполагали по аналогии с другими трехзарядными ионами (например Al3+), что КЧ ионов РЗЭ всегда 6. Сейчас доказано, что КЧ может быть 7,8,9,10 и даже 12. Количество молекул координационно связанного лиганда, как правило, зависит от способа выделения комплекса из раствора. Высокая комплексообразующая способность соединений РЗЭ обуславливается, прежде всего, наличием у металлов незаполненной 5dz2-орбитали [6].
. Наблюдается сильное взаимное влияние однородных и разнородных лигандов во внутренней координационной сфере и взаимное ослабление связей центрального иона РЗЭ с каждым из лигандов по мере последовательного вхождения нескольких лигандов в координационную сферу [7]. . Лабильность комплексов РЗЭ и способность ионов РЗЭ образовывать комплексы с переменными и высокими координационными числами приводит к тому, что в растворе существует смесь комплексов РЗЭ различного состава и строения. В твердом состоянии из раствора выделяется трудноразделяемая смесь с различным соотношением Ln-L.
|
||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-01-14; просмотров: 310; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.218.55.14 (0.027 с.) |