Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Механизмы переноса веществ через мембрану:
Простая диффузия Небольшие нейтральные молекулы типа Н20, С02, 02, NH3 (но не NH4+), мочевина, этанол, а также гидрофобные низкомолекулярные органические вещества могут диффундировать через мембрану без участия каких-либо специальных механизмов. Если существует трансмембранный градиент концентраций вещества, то скорость диффузии в сторону меньшей концентрации будет больше, чем в обратном направлении, и перенос веществ будет происходить, пока сохраняется градиент концентрации. Активный транспорт перенос вещества совершается против градиента концентра-ции. Таким способом проис-ходит перенос многих мине-ральных ионов из межкле-точной жидкости в клетку или в обратном направлении, пе-ренос аминокислот из про-света кишечника в клетки Ки-шечника, перенос глюкозы из первичной мочи через клетки канальцев почки в кровь. Транспорт против градиента концентрации — несамопро-извольный процесс: он связан с расходованием энергии. Источником энергии может быть или гидролиз АТФ (первично-активный транспорт), или одновремен-ный перенос другого вещества, которое движется по градиенту своей концентра-ции (вторично-активный транспорт). Ионные насосы — это белковые устройства, способ-ные избирательно присое-динять переносимый ион и гидролизовать АТФ Na, K -АТФаза и Кальциевый насос (Са-АТФаза) 97. Биологическое окисле-ние определяется как савокуп-ность реакций окисления субстратов в живых клетках, основная функция которых – энергетическое обеспечение метаболизма. В организме протекает при относительно низкой температуре в присут-ствии воды, и его сворость регулируется обменом вещ-в. 98. Эндергонические и экзергонические р-и в жи-вой клетке: Человек получает энергию за счет разложения органических веществ пищи. Самопроиз-вольные процессы — это экзергонические процессы, т. е. они сопровождаются умень-шением свободной энергии (-дельтаG), и поэтому могут служить источниками энергии для функционирования живой клетки. В результате самопроизвольного образуют-ся термодинамически стабиль-ные продукты: диоксид углерода и вода (мочевина служит для выведения избытка азота). Термо-динамически нестабильные вещества – глюкоза. В углеводах, жирах и белках (аминокислотах) содержание кислорода меньше, чем в конечных продуктах их распада. Иначе говоря, катаболизм этих веществ связан с потреблением кислорода и реакциями окисления.
Энергия, освобождающаяся при реакциях гидролиза разных веществ, обычно невелика. Если она превышает 30 кДж/моль, то гидролизуемую связь называют высокоэнергетической (макроэргической). 99. Окислительное декарбо-ксилирование пировиног-радной кислотыВ результате окислительного декарбоксилирования пирува-та образуются ацетил-КоА, восстановленный НАД и диоксид углерода. процесс, катализируется сложной ферментной системой — пируватдегидрогеназным комплексом. Комплекс содержит три фермента: пируватдекарбоксила-зу, ацетилтрансферазу и дегидрогеназу дигидролипоевой кислоты. Кроме того, в реакциях участвуют пять коферментов: НАД, ФАД, тиаминдифосфат, липоевая кислота и кофермент А (КоА).На I стадии этого процесса пируват (рис. 10.8) теряет свою карбоксильную группу в результате взаимодействия с тиаминпирофосфатом (ТПФ) в составе активного центра фермента пируватдегидрогеназы (E1). На II стадии оксиэтильная группа комплекса E1–ТПФ–СНОН–СН3 окисляется с образованием ацетильной группы, которая одновременно переносится на амид липоевой кислоты (кофермент), связанной с ферментом дигидроли-поилацетилтрансферазой (Е2). Этот фермент катализирует III стадию – перенос ацетильной группы на коэнзим КоА (HS-KoA) с образованием конечного продукта ацетил-КоА, который является высокоэнергетическим (макроэргическим) соединением. На IV стадии регенерируется окисленная форма липоамида из восстановленного комплекса дигидролипоамид–Е2. При участии фермента дигидролипоилдегидрогеназы (Е3) осуществляется перенос атомов водорода от восстановленных сульфгидрильных групп дигидролипоамида на ФАД, который выполняет роль простетической группы данного фермента и прочно с ним связан. На V стадии восстановленный ФАДН2 дигидро-липоилдегидрогеназы передает водород на кофермент НАД с образованием НАДН + Н+. Суммарную реакцию, катализируемую пируватдегидрогеназным комплексом, можно представить следующим образом: Пируват + НАД+ + HS-KoA –> Ацетил-КоА + НАДН + Н+ + СO2.
Образовавшийся в процессе окислительного декарбоксилирования аце-тил-КоА подвергается дальнейшему окислению с образованием СО2 и Н2О. Полное окисление ацетил-КоА происходит в цикле трикарбоновых кислот (цикл Кребса). 100.Цикл Кребса: 101.Строение митохондрий: Митохондрии обычно имеют форму цилиндра с закруглен-ными концами, длиной 1-4 мкм и поперечником 0,3-0,7 мкм. Однако в разных клетках размеры и форма митох различны. Количество митох в разных клетках также различно; гепатоцит содержит около 2000 митох. Митохи имеют внешнюю (свободно проницаема для молекул с молекулярной масс-сой примерно до 5000) и внутреннюю(образует складки — кристы,, проницаемость ограничена и избирательна) мембраны. Содержимое пространства, ограничиваемо-го внутренней мембраной, называют матриксом. Согласно хемиосмотической концепции, движение электро-нов по дыхательной цепи является источником энергии для транслокации протонов через митохондриальную мем-брану. Возникающая при этом разность электрохимических потенциалов (дельта мю H) приводит в действие АТФ-синтазу, катализирующую ре-акцию АДФ + Р = АТФ. (3) В дыхательной цепи есть только 3 участка, где перенос электронов сопряжен с нако-плением энергии, достаточ-ным для образования АТФ, на других этапах возникающая разность потенциалов для этого процесса недостаточна. Максимальная величина коэф-фициента фосфорилирования, таким образом, составляет 3, если реакция окисления идет с участием НАД, и 2, если окис-ление субстрата протекает через флавиновые дегидроге-назы. Теоретически еще одну молекулу АТФ можно получить в трансгидрогеназ-ной реакции (если процесс начинается с восстановлен-ного НАДФ): НАДФН + НАД = НАДФ + НАДН + 30 кДж/моль. (4) Функция дыхательной цепи – утилизация восстановленных дыхательных переносчиков, образующихся в реакциях ме-таболического окисления субстратов. Каждая окисли-тельная реакция в соответ-ствии с величиной высвобож-даемой энергии «обслужи-вается» соответствующим дыхательным переносчиком: НАДФ, НАД или ФАД. Соответственно своим окис-лительно-восстановительным потенциалам эти соединения в восстановленной форме под-ключаются к дыхательной цепи. В дыхательной цепи происходит дискриминация протонов и электронов: в то время как протоны перено-сятся через мембрану,создавая дельта рН. электроны дви-жутся по цепи переносчиков от убихинола к цитохро-моксидазе, генерируя разность электрических потенциалов, необходимую для образования АТФ протонной АТФ-син-тазой. Таким образом, ткане-вое дыхание «заряжает» мито-хондриальную мембрану, а окислительное фосфорилиро-вание «разряжает» ее. Эффективность окислитель-ного фосфорилирования в ми-тохондриях определяется как отношение величины образо-вавшегося АТФ к поглощен-ному кислороду: АТФ/О или Р/О (коэффициент фосфо-рилирования). 102.Трансмембранный электро-химический потенциал: Ферменты цепи переноса электронов фиксированы в митохондриальной мембране их действие векторно, т. е. характеризуется не только ве-личиной скорости реакции, но и пространственной направ-ленностью, подобно действию транспортных АТФаз. Основ-ным проявлением векторности в дыхательной цепи является перенос ионов водорода со стороны матрикса в межмем-бранное простраство.В дыха-тельной цепи есть три пункта, связанные с перекачкой про-тонов: комплексы I, III и IV.
Кофермент Q при участии НАДН-дегидрогеназы (ком-плекс I) присоединяет элек-троны от компонентов дыха-тельной цепи с матриксной стороны мембраны, а осво-бождаются электроны и про-тоны на противоположной стороне мембраны, причем электроны акцептируются очередным компонентом дыхательной цепи, а протоны уходят в межмембранное пространство. Такой механизм называют Q-циклом. Сходным образом действует и цито-хром-с-редуктаза (комплекс III). В области цитохром-оксидазы (комплекс IV) в перекачке протонов, воз-можно, участвуют ионы Сu2. Перенос двух электронов че-рез каждый комплекс обеспе-чивает перекачку четырех протонов.,т.о. цепь переноса электронов работает как протонный насос, перекачивая ионы водорода из матрикса на наружную сторону мембраны. В результате по сторонам мембраны возникает разность концентраций протонов и одновременно разность элек-трических потенциалов со знаком «плюс» на наружной поверхности. Иначе говоря, энергия разности окисли-тельно-восстановительных по-тенциалов веществ трансфор-мируется в энергию протон-ного электрохимического по-тенциала дельта мю Н+. Электрохимический потенци-ал понуждает протоны дви-гаться с наружной поверхно-сти внутрь, но мембрана не-проницаема для них, за иск-лючением участков, с фермен-том Н+АТФ-синтетаза, ката-лизирующим такую реакцию: АДФ + Н3Р04 -> АТФ + Н20 АТФ-синтетаза —крупный олигомерный белок, в кото-ром выделяют три части: выступающую в матрикс митохи (F1), построенную из трех пар димеров альфа бета; трансмембранную (F0), обра-зующую гидрофильный канал, и промежуточную область FA. F1 содержит активные цен-тры, синтезирующие АТФ. Протоны движутся через кА-нал АТФ-синтазы, и энергия этого движения используется для образования АТФ. Меха-низмы трансформации элек-трохимического потенциала в энергию макроэргической свя-зи АТФ, все еще не вполне ясны.Образующаяся АТФ при участии АДФ-АТФ-трансло-казы транспортируется из матрикса на наружную сторону мембр и попадает в цитозоль. Одновременно та же транслоказа переносит АДФ в обратном направлении, из цитозоля в матрикс митохи. 103. Дыхательная цепь митох. Согласно хемиосмотической концепции, движение электро-нов по дыхательной цепи является источником энергии для транслокации протонов через митохондриальную мем-брану. Возникающая при этом разность электрохимических потенциалов (дельта мю H) приводит в действие АТФ-синтазу, катализирующую ре-акцию АДФ + Р = АТФ. (3)
В дыхательной цепи есть только 3 участка, где перенос электронов сопряжен с нако-плением энергии, достаточ-ным для образования АТФ, на других этапах возникающая разность потенциалов для этого процесса недостаточна. Максимальная величина коэф-фициента фосфорилирования, таким образом, составляет 3, если реакция окисления идет с участием НАД, и 2, если окис-ление субстрата протекает через флавиновые дегидроге-назы. Теоретически еще одну молекулу АТФ можно получить в трансгидрогеназ-ной реакции (если процесс начинается с восстановлен-ного НАДФ): НАДФН + НАД = НАДФ + НАДН + 30 кДж/моль. (4) Функция дыхательной цепи – утилизация восстановленных дыхательных переносчиков, образующихся в реакциях ме-таболического окисления субстратов. Каждая окисли-тельная реакция в соответ-ствии с величиной высвобож-даемой энергии «обслужи-вается» соответствующим дыхательным переносчиком: НАДФ, НАД или ФАД. Соответственно своим окис-лительно-восстановительным потенциалам эти соединения в восстановленной форме под-ключаются к дыхательной цепи. В дыхательной цепи происходит дискриминация протонов и электронов: в то время как протоны перено-сятся через мембрану,создавая дельта рН. электроны дви-жутся по цепи переносчиков от убихинола к цитохро-моксидазе, генерируя разность электрических потенциалов, необходимую для образования АТФ протонной АТФ-син-тазой. Таким образом, ткане-вое дыхание «заряжает» мито-хондриальную мембрану, а окислительное фосфорилиро-вание «разряжает» ее. 104. Глицин является единственной из всех входящих в состав белков аминок-т, в молекуле которой нет ассиметричного атома углерода. Г.незаменим в синтезе в боразовании белков,париновых нуклеотидов, гемма гемоглобина, парных желчных кислот, креатина, глутатиона.
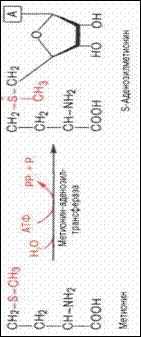
Серин легко превращается в пируват под действием сериндегидратазы. В связи с этим в тканях имеются условия для превращения глицина (через серин) в пируват. Этим путем осуществляется участие глицина в обмене углеводов. Роль тирозина в метаболизме чел. И жив.: Молек тирозина уч-ют в биосинтезе гормонов щит.железы, также является предшественником меланинов, в биологическом процессе обеспечивающем пигментацию кожи, глаз, волос. 105.Аргинин и его роль в обмене в-в участвует в орнитиновом цикле синтеза мочевины, он является донором амидиновой группы в процессе синтеза креатина (уч-ют также глицин и метионин), А. служит источником для образования пролина(через орнитин и глутаминовую кислоту) S-аденозилметионин, Фактическим донором метильных групп в реакциях трансметилирования является не свободный метионин, а так называемый активный метионин – S-аденозилметионин, который образуется в процессе АТФ-зависимой реакции, катализируемой метионин-аденозилтрансферазой.
. Своеобразие данной реакции заключается в том, что СН3-группа ме-тионина активируется под действием положительного заряда соседнего атома серы. S-аденозилметионин участвует во всех реакциях, где метильная группа используется в биосинтетических реакциях: например, в синтезе адреналина, креатинина, тимина, фосфатидилхолина, бетаина и др. Распад пуриновых оснований Конечные продукты: мочевая кислота, СО2, Н2О,фосфаты, аммиак. 108. Распад пиримидин. Осн.: Продукты распада:аммиак, СО2, Н2О,фосфаты Обезвреживание аммиака. Основная масса аммиака обезвреживается в печени с образованием мочвины и в почках с образованием аммонийных солей. Мочевина и соли аммония это конечные продукты азотистого обмена, они выводятся почками. Способы: _основной реакцией выведения аммиака является синтез глутамина под действием глутаминсинтетазы. Глутамат+NН3+АТФ->Глутамин +АДФ+Pi. Глутаминсинтетаза обладает высоким сродством к аммиаку и благодаря этой реакции в крови и в тканях поддерживается низкая концентрация NН3. Глутамин явл транспортной формой аммиака т.к. представляет собой нейтральную амино к-ту, способную протекать через клеточные мембраны путем облегченной диффузии.Образовавшийся в тканях глутамин транспортируется в почки и кишечник. В клетках киш от глутамина отщепляется амидная группа в виде NН3, образовавшийся глутамат трансаминируется с образованием аммиака: Глутамин+Н2О à глутамат+ NН3 Глутамат +пируватà альфа-кетоглутамат=аланин. Первая р-я катализируется глутаминазой, вторая - АЛТ -н.сист: аммиак выводится при помощи восстановительного аминирования, альфа-кетоглутарата под действием глутаматдегидрогеназы, Глутамат в дальн-м может превращаться в глутамин. NН3 Альфа-кетоглутара à глутамат NН3 ГД à глутамин Глутаминсинтетаза
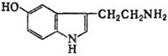
-из мышц избыток азота выводится в виде аланина. Аланин получается из ПВК трансаминированием. Источником ПВК в м-цах является глю и также распадающиеся аминокислоты. Аланин из мышц поступает в печень, где из него непрямым дезаминированием получается амиак и ПВК. Аммиак обезвреживается, а ПВК включается в глюконеогенез, образовавшаяся в результате глюконеогенеза глю из печени поступает в ткани, а там окисляется до пирувата. 110.Синтез серотонина В организме человека и животных С. синтезируется во мн. тканях из триптофана путем его гидроксилирования (фермент триптофангидрок-силаза) с образованием 5-гид-рокси-триптофана, кот. затем под действием декарбокси-лазы ароматич. L-аминокислот превращается в С. Играет важную роль в деятельности центр. и периферич. нервной системы в качестве медиатора (передатчика) нервных импульсов. 111. гормоны задней доли гипофиза: Вазопрессин(В) и окситоцин(О) синтезируются в рибосомах. В гипоталамусе синтезируются белки нейрофизин I, II и III способные связывать В иО и транспортировать их в нейросекреторные гранулы гипоталамуса, из ядер гипоталамуса мигрируют вдоль аксона и достигают задней доли гипофиза – резерв гормонов Химич.строние:О: S----------------------------S Н-Цис-Тир-Иле-Глн-Асн-Цис-Про-Лей-Гли-СО-NН2 S---------------------------S Н-Цис-Тир-Иле-Глн-Асн-Цис-Про-Арг-Гли-СО-NН2 Физиолог.значение: О: сокращение гладких мышц матки и циркулярных параальвеолярных мыш волокон мол.желез. В: стимуляция сокращения гл.мышечн.волокон сосудов, регуляция водного обмена. 112. Гормоны передней доли гипофиза: Гормон роста(СТГ), кортикотро-пин, тиротропин, пролактин, фолликулостимулирующий, лютеинизирующий СТГ под его действием усиливается синтез белка, ДНК, РНК и гликогена, мобилизация жиров из депо и распад высших жирных кислот и глюкозы в тканях. + обладает лактогенной активностью. Кортикотропин:: стимуляция синтеза и секреции гомонов коры надпочечников. Пролактин: стимуляция развития мол.желез и лактации Тиротропин: контролирование развития и функции щит.жел, регуляция и синтез в кровь тиреоидных гормонов..
|
|||||||||
|
Последнее изменение этой страницы: 2021-01-09; просмотров: 65; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.140.198.173 (0.042 с.) |