
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Термохимическое разрушение стеклопластиков.
Понятие стеклопластикиохватывает довольно широкий класс композиционных материалов, сосотоящих из различных стеклотканей (волокон) и различных смол. Наиболее теплоэрозионностойкими из них являются стеклопластики на основе кварцевого стекла (SiO2) и фенолформальдегидных смол. Разрушение такого материала при нагреве в окислительной среде происходит по-разному в зависимости от соотношения углерода и двуокиси кремния, так как эти вещества реагируют между собой. Здесь рассматривается случай, соответствующий избытку двуокиси кремния в такой реакции (рис. 5.12). Так же как в углепластиках массовую долю связующего вещества (смолы) в стеклопластиках обозначим через Деструкция связующего вещества – это первое превращение, происходящее в стеклопластике; заметное разложение происходит уже при 500…600 К, взаимодействие двуокиси кремния с углеродом в этом диапазоне температур еще не появляется. Поэтому процесс термодеструкции связующего описывается независимо и определяется теми же уравнениями, что и для углепластика:
Здесь В процессе термодеструкции часть массы связующего c газифицируется. Газообразные продукты деструкции фильтруются сквозь прококсованный слой к поверхности и уходят из материала. Твердый остаток связующего практически полностью состоит из углерода (коксовый остаток). На основании сказанного состав материала за фронтом деструкции до начала взаимодействия углерода с SiO2 можно описать соотношениями:
Рис. 5.12.
При этом составе и температуре ~ 1400… 1500 К в пористом материале начинается взаимодействие углерода с двуокисью кремния. По мнению многих авторов это взаимодействие можно описать реакцией: C + SiO2 ® CO + SiO Продуктами реакции являются газообразные вещества, они фильтруются к поверхности и уходят из материала. В зоне реагирования двуокись кремния может находиться как в твердом, так и в расплавленном состоянии. В зоне твердого состояния вещества в процессе реагирования образуются новые поры. Реакция может протекать до тех пор, пока не закончится один из реагентов. В целом процесс взаимодействия углерода с двуокисью кремния также описывается кинетическим уравнением типа закона Аррениуса:
где При определенном нагреве двуокись кремния, являясь аморфным веществом, размягчается и становится все менее вязкой и более текучей. Для построения математической модели можно принять, что по достижении температуры плавления SiO2 переходит в расплав. Фронт плавления движется со скоростью V пл, определяемой разностью удельных тепловых потоков:
где
В процессе плавления поры в материале исчезают, материал уменьшается в объеме. Изменение толщины жидкой пленки определяется соотношением:
За время dt поверхность материала за счет сжатия при плавлении переместится на величину
Здесь Кинетическое уравнение взаимодействия двуокиси кремния с углеродом в жидкой пленке при уменьшении объема из-за плавления записывается в виде:
Расход газообразных продуктов через жидкую пленку теперь складывается из продуктов деструкции, продуктов реакции SiO2+C в жидкой и твердой фазе. Здесь m – масса прореагировавшего вещества в единице объема пленки. Из-за ухода массы из объема пленки ее поверхность будет дополнительно перемещаться. Углерод, вышедший на поверхность материала, может реагировать с окисляющими компонентами газового потока. Это взаимодействие можно описать аналогично углепластикам, но с учетом доли поверхности, занятой углеродом:
Однако такая скорость уноса может быть реализована, только если частицы углерода успевают обнажаться в процессе испарения двуокиси кремния:
Течение и испарение пленки SiO2 обычно невелики и могут быть учтены, используя подходы, изложенные в монографии [5.16].
|
||||||
|
Последнее изменение этой страницы: 2021-01-08; просмотров: 120; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.117.183.172 (0.006 с.) |
 , тогда доля двуокиси кремния (стеклоткань, стекловолокно) составит
, тогда доля двуокиси кремния (стеклоткань, стекловолокно) составит  в предположении, что материал состоит только из связующего и двуокиси кремния.
в предположении, что материал состоит только из связующего и двуокиси кремния. ;
;  ; (5.22)
; (5.22) .
. 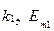 – кинетические константы процесса термодеструкции, G 1 – расход продуктов дестрекции связующего.
– кинетические константы процесса термодеструкции, G 1 – расход продуктов дестрекции связующего. – доля массы, которая уходит из материала в процессе термодеструкции (предельная пористость материала в конце процесса термодеструкции), то есть плотность материала станет
– доля массы, которая уходит из материала в процессе термодеструкции (предельная пористость материала в конце процесса термодеструкции), то есть плотность материала станет  ;
; – массовая доля углерода (кокс) в прококсованном материале (от исходной массы);
– массовая доля углерода (кокс) в прококсованном материале (от исходной массы);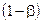 – массовая доля SiO2 (от исходной массы).
– массовая доля SiO2 (от исходной массы).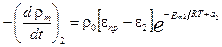 , (5.23)
, (5.23) ,
,  – предэкспоненциальный множитель и энергия активации для реакции углерода с двуокисью кремния.
– предэкспоненциальный множитель и энергия активации для реакции углерода с двуокисью кремния. , направленного со стороны расплава и
, направленного со стороны расплава и  , направленного от границы плавления внутрь твердой части материала:
, направленного от границы плавления внутрь твердой части материала: , (5.24)
, (5.24) – плотность (концентрация) двуокиси кремния в твердой фазе;
– плотность (концентрация) двуокиси кремния в твердой фазе; – тепловой эффект плавления двуокиси кремния;
– тепловой эффект плавления двуокиси кремния; – толщина материала (в твердой фазе), которая расплавится за время
– толщина материала (в твердой фазе), которая расплавится за время 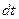 .
. – массовая доля углерода; (5.25)
– массовая доля углерода; (5.25)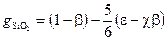 – массовая доля окиси кремния. (5.26)
– массовая доля окиси кремния. (5.26) . (5.27)
. (5.27) . Следовательно, скорость движения внешней поверхности пленки (по нормали к поверхности за счет плавления и ликвидации пор) можно определить как:
. Следовательно, скорость движения внешней поверхности пленки (по нормали к поверхности за счет плавления и ликвидации пор) можно определить как: . (5.28)
. (5.28)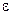 следует понимать как долю прореагировавшего вещества, уносимую из жидкой пленки в виде газа;
следует понимать как долю прореагировавшего вещества, уносимую из жидкой пленки в виде газа; 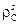 – плотность твердых частиц углерода коксового остатка в пленке расплава;
– плотность твердых частиц углерода коксового остатка в пленке расплава;  – плотность жидкой двуокиси кремния.
– плотность жидкой двуокиси кремния. ; (5.29)
; (5.29)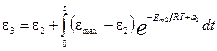 . (5.30)
. (5.30) .
.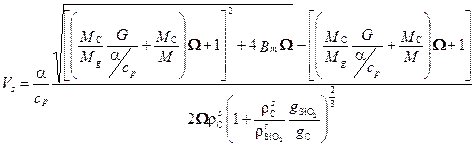 . (5.31)
. (5.31) . В противном случае скорость уноса поверхности материала из-за окисления углерода будет лимитирована скоростью испарения:
. В противном случае скорость уноса поверхности материала из-за окисления углерода будет лимитирована скоростью испарения: .
.


