Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Тема: Методы микроскопического исследования. Морфология микроорганизмов.Стр 1 из 5Следующая ⇒
Практическая работа № 2 Тема: Методы микроскопического исследования. Морфология микроорганизмов. Студент должен знать: 1. Предмет изучения медицинской микробиологии. 2. Классификация микроорганизмов (4группы, клеточные и доклеточные формы, царства). 3.Ультра структура бактериальной клетки (наружные и внутренние структуры) 4. Три морфологические формы бактерий. 5. Особенности патогенных прокариот (микоплазм, риккетсий, актиномицет, хламидий, спирохет) Практическое значение вопроса. Приложение 1 6. Классификация бактерий по толщине клеточной стенки. 7.Принцип и последовательность окраски мазка по Грамму. Практическое значение. 8. Метод микроскопии: виды микроскопий (световая, люминисцентная, тёмнопольная, электронная, фазово-контрастная). Принцип и цели применения в лабораторной практике. 9. Спрообразование прокариотов: 2 формы спор (бациллы. клостридии) Цель занятия. Овладеть методиками приготовления основных микробиологических препаратов. Изучить морфологические формы бактерий на примере чистых культур микроорганизмов и микрофлоры полости рта. Задачи: 1. Ознакомиться с оборудованием рабочего места и техникой безопасности при работе с микроорганизмами. 2. Изучить методы исследования микроорганизмов. 3. Овладеть методами приготовления микробиологических препаратов. 4. Изучить морфологические формы микроорганизмов. 5. Закрепить полученные знания при исследовании микрофлоры полости рта. ТЕОРЕТИЧЕСКАЯ ЧАСТЬ Подготовка микробиологической лаборатории к работе. Задание 1. Изучите теоретический материал и зарисуйте микроскоп в тетради с обозначениями деталей. Запишите какие виды микроскопий используются в медицинской лаборатории. Для того чтобы снизить количество микроорганизмов в воздухе и на различных поверхностях, в лабораторных помещениях применяют различные способы дезинфекции. Воздух в лаборатории наиболее просто дезинфицировать проветриванием. Продолжительная вентиляция помещения через форточку (не менее 30–60 мин) приводит к резкому снижению количества микроорганизмов в воздухе, особенно при значительной разнице в температуре между наружным воздухом и воздухом помещения. Более эффективный и наиболее часто применяемый способ дезинфекции воздуха – облучение ультрафиолетовыми лучами с длиной волны от 200 до 400 нм. Рабочее место, где непосредственно проводится работа с культурами микроорганизмов, требует особенно тщательной обработки. Рабочий стол следует дезинфицировать не только до начала работы, но и после ее окончания. Для протирания поверхности стола можно использовать растворы лизола и хлорамина, а также 70%-ные (по объему) растворы изопропилового или этилового спиртов.
Для работы в учебной микробиологической лаборатории используется следующие оборудование: 1.Микроскоп. Биологический микроскоп (рис. 1) представляет собой оптический прибор, увеличивающий предметы в 40-1500 раз; состоящий из механической, оптической и осветительной систем. К механической системе микроскопа относятся подковообразная ножка, тубусодержатель, тубус, предметный столик, винты. Оптическая система включает объективы и окуляр. Осветительная система состоит из конденсора с диафрагмой изеркала.Тубусодержатель и подковообразное основание соединены между собой подвижно шарниром. Тубус - зрительная трубамикроскопа. В верхнюю часть тубуса вставлен окуляр, а в нижнюю – вращающийся вокруг своей оси револьвер, в который ввинчены объективы. Тубус передвигается вверх и вниз при помощи макрометрического и микрометрического винтов. Один оборот микрометрического винта передвигает тубус на 0,1 мм. Поэтому микровинтом пользуются для более точной наводки, а для предварительной - макровинтом. Предметный столик предназначен для размещения исследуемого материала. Рисунок 1 - Микроскоп 1 - макровинт; 2 - тубусодержагель; 3 - шарнирное соединение; 4-предметный столик; 5 - тубус; 6 - окуляр; 7 - револьвер; 8 - объективы; 9 - конденсор; 10 - зеркало; 11 - микровинт; 12 –подковообразное основание
Конденсор состоит из линз, собирающих отраженные от зеркала лучи в световой пучок, и направляющих его через отверстие предметного столика на препарат. При определении подвижности неокрашенных препаратов конденсор должен быть несколько опущен. Диафрагма находится между зеркалом и кондесором и служит для регулирования количества света, поступающего в конденсор. Объектив состоит из системы линз, заключенных в металлическую оправу. Передняя линза служит для увеличения предмета, остальные - для коррекции изображения. Современные биологические микроскопы имеют не менее трех объективов. Сухие объективы увеличивают в 8 и 40 раз (между объективами и препаратом находится слой воздуха),иммерсионные – в 90раз. На оправу каждого объектива нанесена цифра, указывающая увеличение. Окуляр состоит из верхней-глазной и нижней-собирательной линз. На верхней части окуляра имеется цифра, указывающая увеличение (7,10,15). Окуляр увеличивает только изображение. Общее увеличение микроскопа складывается из произведения увеличения объектива на увеличение окуляра.
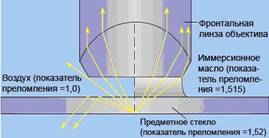
Рабочий стол для микроскопирования препаратов желательно размещать у окна или оснащать источником света. Микроскоп устанавливают на рабочий стол к себе тубусодержателем примерно на 7-10 см от края. Вначале проводят настройку освещения, для чего зеркалом направляют пучок света от источника освещения в объектив с увеличением в 8 раз. При правильной настройке освещения поле зрения микроскопа должно быть в виде равномерно освещенного круга. После этого на предметный столик помещают исследуемый препарат, который закрепляют клеммами и рассматривают под микроскопом, пользуясь объективами с увеличением в 8, 40 или 90 раз. При работе с объективами 8 и 40 тубус микроскопа осторожно опускают с помощью макрометрического винта, приближают объектив почти вплотную к препарату, но не касаются его. Наблюдают в окуляр, слегка приподнимая тубус тем же винтом до получения изображения. С помощью микрометрического винта проводят точную установку объектива до получения четкого изображения предмета. При работе с иммерсионным объективом (увеличение в 90 раз) на препарат предварительно наносят каплю иммерсионного масла, а затем контролируя сбоку макрометрическим винтом опускают объектив в каплю масла. Точную установку объектива проводят с помощью микрометрического винта, который вращают в обратном направлении до получения четкого изображения. При нанесении капли иммерсионного масла не происходит рассеивания луча света, а. значит, получается четкое изображение (рис.2).
Рисунок 2 - Схема хода лучей в сухой и иммерсионной системах По окончании работы исследуемый материал снимают с предметного столика. Мягкой тканью, смоченной в очищенном бензине или эфире, удаляют иммерсионное масло с объектива, на предметный столик помещают квадрат из фланели, опускают конденсор и убирают микроскоп в место, предохраняющее его от пыли и сырости.
Принцип действия люминесцентного микроскопа основан на способности отдельных объектов и красителей светится при освещении их ультрафиолетовыми лучами. Люминесцентные микроскопы снабжены источником ультрафиолетового света и набором светофильтров. У бактерий очень слабо выражена собственная флюоресценция. Поэтому необходимо их обработать флюоресцирующими красками (флюорохромами), которые окрашивают структурные элементы клетки в различные цвета. Электронная микроскопия — это метод исследования структур, находящихся вне пределов видимости светового микроскопа и имеющих размеры менее одного микрона (от 1 мкм до 1—5Å). Действие электронного микроскопа основано на использовании направленного потока электронов, который выполняет роль светового луча в световом микроскопе, а роль линз играют магниты (магнитные линзы). Электронная микроскопия, при которой изображение получают благодаря прохождению (просвечиванию) электронов через образец, называется просвечивающей (трансмиссивной). При сканирующей (растровой), или туннельной электронной микроскопии пучок электронов быстро сканирует поверхность образца, вызывая излучение, которое посредством катодно-лучевой трубки формирует изображение на светящемся экране микроскопа.
Задание 2. Изучить морфологические формы бактерий. К морфологическим свойствам бактерий относятся не только форма, но и размер клеток, расположение клеток в пространстве, наличие спор и капсул, подвижность и характер окраски бактерий по Граму. Наиболее типична морфология бактерий в молодых культурах. Среди основных морфологических форм бактерий различают: 1. Шаровидные (кокковые), которые по характеру взаиморасположения делятся на: 1) микрококки (лат. micro - маленький). В природе встречаются в виде одиночных шаровидных клеток.
А Б В Рисунок 1- Micrococcus luteus: А - схема расположения клеток в пространстве, Б – фотография полученная методом СЭМ, В - методом ФКМ 2) диплококки (лат. diploos - двойной) – бактерии, соединенные по две клетки;
A Б В Рисунок 2 - Neisseria meningitidis: А - схема расположения клеток в пространстве, Б – фотография полученная методом СЭМ, В - окраска по Граму 3) тетракокки (лат. tetra — четыре) – группируются по четыре клетки;
Рисунок 3 – Тетракокки 4) стрептококки (лат. streptos - цепь) – бактерии, образующие в результате деления клеток в одной плоскости разнообразной длины цепочки.
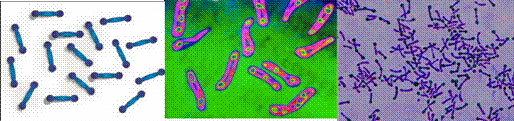
Рисунок 4 - Streptococcus mutans: А – схема расположения клеток в пространстве, Б – фотография полученная методом СЭМ, В – окрашенный препарат 4) сарцины (лат. sarceo - соединяю) – шаровидные бактерии, группирующиеся по 8 клеток. Располагаются они в виде куба, с каждой стороны которого по 4 клетки. Такая форма возникает в результате деления клетки в трех взаимно перпендикулярных плоскостях.
Рисунок 5 – Sarcina lutea: А – схема расположения клеток в пространстве, Б – фотография полученная методом СЭМ, В– окраска по Граму 5) стафилококки (лат. staphylo - гроздь) – клетки вследствие беспорядочного деления образуют скопления, напоминающие по внешнему виду гроздья винограда.
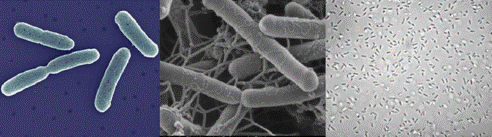
А Б В Рисунок 6 – Staphylococcus aureus (золотистый стафиллококк): А – схема расположения клеток в пространстве, Б – фотография полученная методом СЭМ, В – окраска по Граму 2. палочковидные, которые различаются поформе: 1) правильная (энтеробактерии (представители семейства Enterobacteriaceae), псевдомонады (род Pseudomonas));
Рисунок 7 – различные палочковидные бактерии, имеющие правильную форму E.coli Salmonellatyphimurium Pseudomonasaeruginosa 2) неправильная (коринебактерии (Corynebacterium)).
А Б В Рисунок 8 - Corynebacterium diphtheria: А - внешний вид клеток, Б -фотография полученная методом ТЭМ, В – окраска поГраму 3) извитые формы - по характеру и количеству завитков они делятся на: 1) вибрионы (слегка изогнутые палочки или неполные завитки); Рисунок 9– Вибрионы: Vibrio cholerae (А – ТЭМ, Б – окрашенный препарат, В – Vibrio fischeri (флуоресцентная микроскопия) 2) спириллы (один или несколько завитков); 3) спирохеты, которые в свою очередь, делятся на: лептоспиры (завитки с загнутыми крючкообразными концами - S-образная форма); боррелии (4 -12 неправильных завитков); трепонемы (14 -17 равномерных мелких завитков). Leptospirainterrogans Borreliaburgdorferi Treponema pallidum Рисунок 10 – Извитые формы бактерий 4. нитчатые формы, к которым относят актиномицеты (Actinomycetales). Клетки актиномицетов обычно имеют вид длинных и ветвящихся нитей, напоминающих в ряде случаев мицелий одноклеточных грибов (т.н. «тонкий мицелий»). Нити мицелия имеют длину 100–600 мкм и толщину 0,2–1,2мкм.
Actinomycesisraeli Streptomycessp. Рисунок 11- Представители актиномицетов Размеры бактерий в среднем составляют 0,5—5 мкм. Escherichiacoli, например, имеет размеры 0,3—1 на 1—6 мкм, Staphylococcusaureus — диаметр 0,5—1 мкм, Bacillus subtilis — 0,75 на 2—3 мкм. Крупнейшей из известных бактерий является Thiomargaritanamibiensis, достигающая размера в 750 мкм (0,75 мм). Спирохеты могут вырастать в длину до 250 мкм при толщине 0,7 мкм. В то же время к бактериям относятся самые мелкие из имеющих клеточное строение организмов. Mycoplasma mycoides имеет размеры 0,1—0,25 мкм. по размеру: мелкие (бруцеллы (Brucella), бордетеллы (Bordetella)); средние (бактероиды (Bacteroides), кишечная палочка (E.coli); крупные (бациллы (Bacillus), клостридии (Clostridium)); по форме концов: обрубленные (бациллы); закругленные (сальмонеллы, псевдомонады); заостренные (фузобактерии); утолщенные (коринебактерии); по характеру взаиморасположения все палочки делятся на: расположенные одиночно; диплобактерии и диплобациллы (сцепленные попарно); стрептобактерии и стрептобациллы (сцепленные в цепочку);
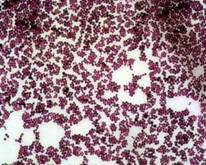
Задание 3. Ознакомиться с микрофлорой полости рта. Вся нормальная микрофлора человека подразделяется на резидентную (постоянную – автохтонную (облигатную), составляющую до 90% присутствующих в организме микроорганизмов, факультативную (аллохтонную) — менее 9,5%) и транзиторную (случайную) — до 0,5 %. Около 20 % микроорганизмов от общего числа обитает в полости рта (более 200 видов), 18-20% приходится на кожные покровы, 15-16% — на глотку, а больше всего микроорганизмов (до 40%) — в желудочно-кишечном тракте. Нормальная микрофлора организма начинает формироваться при рождении ребенка. В полости рта новорожденного она представлена лактобациллами, негемолитическими стрептококками и непатогенными стафилококками. Главными обитателями полости рта у взрослого человека являются бактерии преимущественно анаэробного типа дыхания (3/4 всех микробных видов), остальные виды представлены факультативными анаэробами. В ротовой полости самую большую группу бактерий составляют кокки. Род Staphylococcus. Стафилококки в полости рта здорового человека встречаются в среднем в 30% случаев. В зубном налете и на деснах здоровых людей присутствуют в основном Staphylococcus epidermidis. У некоторых людей в полости рта могут обнаруживаться и Staphylococcus aureus. Обладая значительной ферментативной активностью, стафилококки принимают участие в расщеплении остатков пищи в полости рта. Патогенные стафилококки, встречающиеся на слизистой носоглотки и в полости рта, являются частой причиной эндогенных инфекций, вызывая различные гнойно-воспалительные процессы полости рта.
Staphylococcusaureus Staphylococcusepidermidis Рисунок 12 – Представители рода Staphylococcus (окрашенные препараты) Род Streptococcus. Стрептококки являются основными обитателями полости рта (в 1 мл слюны — до 108-1011 стрептококков). В окрашенных мазках стрептококки располагаются в виде цепочек, грамположительны. Большинство из них являются факультативными анаэробами или микроаэрофилами, но встречаются и строгие анаэробы (например, пептострептококки). Стрептококки сбраживают углеводы с образованием молочной кислоты, вызывая молочнокислое брожение. Кислоты, появляющиеся в результате брожения, подавляют рост ряда гнилостных микробов, встречающихся в полости рта. Колонизация оральными стрептококками различных участков ротовой полости имеет качественные и количественные вариации в зависимости от условий жизни. S.salivarius и S.mitis в 100% случаев присутствуют в полости рта. S.mutans и S.sanguis обнаруживаются в большом количестве на зубах, a S.salivarius — главным образом на поверхности языка.
Streptococcusmutans Streptococcussalivarius Рисунок 13– Представители рода Streptococcus Род Veillonella. Вейллонеллы — это мелкие грамотрицательные кокки, располагаются кучками, парами или короткими цепочками. Строгие анаэробы.
Рисунок 14 – Veillonella parvula (СЭМ и окрашенный по Граму препарат) Род Neisseria. Нейссерии — грамотрицательные диплококки. Строгие аэробы. Нейссерии всегда в большом количестве встречаются в полости рта здоровых людей (до 1—3 млн. в 1мл слюны). В полости рта помимо кокков обитают разнообразные палочковидные формы бактерий. РодFusobacterium включает более 10 видов, изолированных из ротовой полости человека и животных. Фузобактерии — грамотрицательные анаэробные палочки, в культуре выглядят как прямые или искривленные палочки, короткие нити с заостренными концами, напоминающие веретено. Лептотрихии (род Leptotrichia содержит один вид - Leptotrichia buccalis) имеют вид длинных нитей разной толщины с заостренными или вздутыми концами, дают густые сплетения, могут располагаться попарно в виде зернистых палочек. Лептотрихии присутствуют в полости рта постоянно (чаще у шейки зубов) в большом количестве (в 1 мл слюны 103- 104).
Рисунок 15 - Leptotrichia buccalis
Облигатные анаэробы | |||||||||||||||||||
|
Грамотрицательные | Палочки | Veillonella | ||||||||||||||||||
| Кокки | Bacteroides Porphyromonas Prevotella Fusobacterium Leptotrichia | |||||||||||||||||||
| Спирохеты | Treponema Borrelia | |||||||||||||||||||
|
Грамположительные | Палочки | Bifidobacterium Propionibacterium | ||||||||||||||||||
| Кокки | Peptostreptococcus Peptococcus | |||||||||||||||||||
|
Грамотрицательные | Кокки | Neisseria | ||||||||||||||||||
| Спирохеты | Leptospira | |||||||||||||||||||
|
Грамположительные | Кокки | Streptococcus Staphylococcus | ||||||||||||||||||
| Палочки | Lactobacillus Corynebacterium | |||||||||||||||||||
| Ветвящиеся | Actinomyces | |||||||||||||||||||
Некоторые бактерии могут колонизировать поверхность слизистых или зубов, закрепляясь на поверхностных структуpax других бактерий, т.е. осуществляя коагрегацию. Стрептококки разных видов коагрегируются с актиномицетами, F. nucleatum, Veillonella, Haemophilus parainfluenzae. F.nucleatum связываетсяс Porphyromonas gingivalis, Haemophilus parainfluenzae и Treponema spp. Коагрегация — пример комменсализма и синергизма, которые возникают между микробными видами.
Задание 4. Изучите теоретический материал
Обязательными органоидами бактериальной клетки являются: нуклеоид, цитоплазма, цитоплазматическая мембрана.
Необязательными структурными элементами являются: клеточная стенка, капсула, споры, пили, жгутики.
1. В центре бактериальной клетки находится нуклеоид - ядерное образование, представленное чаще всего одной хромосомой кольцевидной формы. Состоит из двухцепочечной нити ДНК. Нуклеоид не отделен от цитоплазмы ядерной мембраной.
2. Цитоплазма - сложная коллоидная система, содержащая различные включения метаболического происхождения (зерна волютина, гликогена, гранулезы и др.), рибосомы и другие элементы белоксинтезирующей системы, плазмиды (вненуклеоидное ДНК), мезосомы (образуются в результате инвагинации цитоплазматической мембраны в цитоплазму, участвуют в энергетическом обмене, спорообразовании, формировании межклеточной перегородки при делении).
3. Цитоплазматическая мембрана ограничивает с наружной стороны цитоплазму и выполняет ряд важнейших функций - барьерную (создает и поддерживает осмотическое давление), энергетическую (содержит многие ферментные системы – дыхательные, окислительно- восстановительные, осуществляет перенос электронов), транспортную (перенос различных веществ в клетку и из клетки), рецепторную и сигнальную.
4. Клеточная стенка - присуща большинству бактерий (кроме микоплазм и некоторых других, не имеющих истинной клеточной стенки микроорганизмов). Она обладает рядом функций, прежде всего, обеспечивает механическую защиту и постоянную форму клеток, с ее наличием в значительной степени связаны антигенные свойства бактерий. Основное химическое соединение клеточной стенки, которое специфично только для бактерий - пептидогликан (муреин). От структуры и химического состава клеточной стенки бактерий зависит важный для систематики признак бактерий - отношение к окраске по Граму. В соответствии с ним выделяют две большие группы - грамположительные и грамотрицательные бактерии. Стенка грамположительных бактерий после окраски по Граму и последующем промывании этанолом сохраняет комплекс йода с генцианвиолетом и магниевыми солями рибонуклеиновых кислот (окрашены в сине- фиолетовый цвет), грамотрицательные бактерии теряют этот комплекс и соответствующий цвет после обработки, и они окрашиваются в розовый цвет за счет докрашивания фуксином.
Задание 5. Запишите в тетрадь особенности строения стенки гр+ и гр- бактерий и сделайте рисунки строения клеточной стенки гр+ и гр- бактерий
ПРАКТИЧЕСКАЯ ЧАСТЬ
Задание 6. Освоить методы фиксации и окраски мазков.
Для количественного учета, изучения морфологии, выявления структурных элементов, органоидов, внутриклеточных включений мазок бактериальной культуры необходимо зафиксировать и окрасить.
ЭТАПЫ ПРИГОТОВЛЕНИЯМАЗКА
1. Нанесение бактериальной культуры
2. Высушивание
3. Фиксация
4. Окрашивание
Мазок готовят на обезжиренном чистом предметном стекле, куда наносят небольшую каплю воды. В этой капле эмульгируют исследуемый материал, который распределяют тонким слоем на поверхности около 2 см2. Если микроорганизмы выращены на жидкой питательной среде, то культуру берут петлей или стерильной пипеткой и каплю наносят непосредственно на стекло (без воды). После этого мазок высушивают на воздухе и фиксируют.
Методы фиксации:
✔ Физический – над пламенем спиртовки
✔ Химический–в растворах спирта, ацетона, смеси Никифорова, формалина.
Фиксацию мазка над пламенем спиртовки производят в течение нескольких секунд мазком вверх. Эту операцию проводят достаточно быстро после полного высушивания мазка, не перегревая его (прикладывание предметного стекла к тыльной стороне ладони должно вызывать чувство выраженного тепла, но нежжения).
Цели фиксации
✔ Обеззараживание патогенных микроорганизмов
✔ Закрепление клеток на стекле
✔ Убитые микроорганизмы лучше воспринимают красители.
Способы окрашивания микроорганизмов: Существуют простые и сложные способы окрашивания микроорганизмов. При простом способе окрашивания на мазок наносится один краситель, при сложном способе окрашивания — 2 или более красителей. К таким способам окрашивания относится окраска по Граму. Соответственно выделяют формы бактерий грамположительные (окрашиваются в фиолетовый цвет) и грамотрицательные (окрашиваются в красный цвет). Грамположительные бактерии имеют несложно организованную, но мощную клеточную стенку, состоящую из множественных слоев пептидогликана, включающих уникальные полимеры тейхоевых кислот. Грамотрицательные бактерии имеют более тонкую клеточную стенку, включающую бимолекулярный слой пептидогликана и не содержащую тейхоевой кислоты.
Микроскопирование препарата
1. Установить освещение: конденсор должен быть поднят до упора, настройку производить с объективом малого увеличения 8-х — необходимо белое освещенное поле.
2. Препарат поместить на предметный столик.
3. Макровинтом опустить объектив на расстояние 0,5 см от препарата.
4. Глядя в окуляр, получить изображение препарата, вращая макровинт против часовой стрелки (на себя).
5. Произвести точную фокусировку с помощью микровинта.
6. Переместить револьвер на большое увеличение (объектив 40-х) и провести дефокусировку только микровинтом.
7. После просмотра препарата перевести револьвер на увеличение 8-х (малое) и только после этого снять препарат с предметного столика.
Кроме окраски по Граму к сложным дифференциальным методам окраски относятся:
1. Окраска кислотоустойчивых бактерий по Цилю— Нильсену фиксированный на пламени горелки мазок окрашивают 3-5 мин раствором карболового фуксина Циля или окрашенной фуксином бумажкой с подогреванием до появления паров, но не доводя краску до кипения;
* дают препарату остыть, бумажку снимают, сливают избыток краски, препарат промывают водой;
* окрашенный препарат обесцвечивают 5% H2SO4 (серной кислотой) в течение 3—5 с или 96° этиловым спиртом, содержащим 3% по объему соляной кислоты, несколько раз погружая в стаканчик с раствором;
* после обесцвечивания остаток кислоты сливают, препарат промывают водой;
* докрашивают дополнительно метиленовой синью Леф-флера 3—5 мин, промывают водой, подсушивают и микроскопируют.
Результаты окраски: при окраске препаратов по методу Циля—Нильсена кислотоустойчивые бактерии окрашиваются фуксином в красный цвет.
2. Окраска по Романовскому—Гимзе
Краска Романовского—Гимзы состоит из смеси азура, эозина и метиленовой сини. Перед употреблением к 10 мл дистиллированной воды прибавляют 10 капель краски Романовского—Гимзы. Приготовленный раствор краски наносят на фиксированный мазок и оставляют на 1 ч. Затем краску сливают, препарат промывают водой и высушивают на воздухе. Краска Романовского—Гимзе окрашивает микробы в фиолетово-красный цвет.
Вопросы к лабораторному занятию 2.
1. Основные правила техники безопасности при работе с микроорганизмами.
2. Виды оборудования, применяемого в микробиологической лаборатории.
3. Основные морфологические типы бактерий. Использование морфологической характеристики в идентификации микроорганизмов.
Приложение 1
Спирохеты
Спирохеты – длинные и тонкие бактерии, имеющие большое количество изгибов. Клеточная стенка по строению грамотрицательная. Под мембраной клеточной стенки располагаются специальные закрученные белки, придающие клеткам характерную винтообразную форму. Белки-фибриллы участвуют в движении, способствуя вращению, сгибанию и поступательным движениям. Кроме того спирохеты часто образуют вторичные завитки в виде петель и изгибов.
Замечание 1
Спирохеты плохо красятся стандартными методами. Обычно они поддаются окрашиванию по методу Романовского-Гимзе или серебрением. В живом виде спирохеты можно увидеть с помощью фазово-контрастной и темнопольной микроскопии.
Среди спирохет патогенными для человека являются три рода:
● Treponema
● Borrelia
● Leptospira.
Род Treponema - тонкие штопорообразные нити с 8-12 мелкими завитками. Патогенные виды трепонем:
Т. pallidum (возбудитель сифилиса) T. pertenue (возбудитель фрамбезии)
Род Borrelia - возбудители возвратного тифа, лаймской болезни.
Род Leptospira включает возбудителей лептоспироза.
Риккетсии
Мелкие грамотрицательные бациллы, являющиеся облигатными внутриклеточными паразитами. Не смотря на внутриклеточный паразитизм, риккетсии обладают собственным катаболическим аппаратом. Окрашиваются различными способами – по Романовскому-Гимзе, Маккиавелло-Здродовскому.
Пример 2
К болезням человека, вызываемым риккетсиями, относят эпидемический сыпной тиф (возбудитель R. prowazekii), клещевой риккетсиоз (возбудитель R. sibirica), пятнистую лихорадку Скалистых гор (возбудитель R. rickettsii).
Хламидии
Хламидии - мелкие грамотрицательные шаровидные бактерии. Хламидии не способны к спорообразованию, неподвижны. Хламидии - облигатные внутриклеточные паразиты.
Основная окраска для выявления хламидий - метод Романовского-Гимзе. Хламидии – облигатные внутриклеточные паразиты, не обладающие собственным энергетическим аппаратом. Вне клеток хламидии мелкие и неактивные и называются элементарными тельцами. Элементарные тельца попадают в эпителиальную клетку путем фагоцитоза. Внутри клеток-хозяев у хламидий запускается обмен веществ и они образуют ретикулярные тельца – активную форму, из них образуются элементарные тельца, способные покидать клетку путем экзоцитоза или разрушения клетки.
Пример 3
Основные хламидийные болезни человека - трахома, урогенитальный хламидиоз и пситаккоз или орнитоз.
Актиномицеты
Актиномицеты - длинные палочковидные грамположительные бактерии, способные к ветвлению. Актиномицеты способны образовывать пучки из переплетенных нитей, напоминающие гифы грибов, откуда они и получили свое название.
Из гиф формируется своеобразный мицелий, имеющий две части:
● Субстратный мицелий – врастает в питательную среду
● Воздушный мицелий – образует споры для размножения
Пример 4
Патогенные для человека актиномицеты вызывают актиномикоз.
Кроме того, существует группа бактерий похожих на актиномицет – нокардиоподобные бактерии, к ним относятся нокардии (возбудители нокардиоза), микобактерии (возбудители туберкулеза и лепры), коринебактерии (возбудители дифтерии).
Микоплазмы
Микоплазмы - мелкие бактерии, не имеющие клеточной стенки. Имеют разнообразную форму клеток: кокки и различные разновидности палочек. Плохо окрашиваются стандартными красителями.
Пример 5
Mycoplasma pneumoniae вызывают у человека пневмонию атипичного течения в связи с поражением пневмоцитов и интерстиция легких
Практическая работа № 2
Тема: Методы микроскопического исследования. Морфология микроорганизмов.
Студент должен знать:
1. Предмет изучения медицинской микробиологии.
2. Классификация микроорганизмов (4группы, клеточные и доклеточные формы, царства).
3.Ультра структура бактериальной клетки (наружные и внутренние структуры)
4. Три морфологические формы бактерий.
5. Особенности патогенных прокариот (микоплазм, риккетсий, актиномицет, хламидий, спирохет) Практическое значение вопроса. Приложение 1
6. Классификация бактерий по толщине клеточной стенки.
7.Принцип и последовательность окраски мазка по Грамму. Практическое значение.
8. Метод микроскопии: виды микроскопий (световая, люминисцентная, тёмнопольная, электронная, фазово-контрастная). Принцип и цели применения в лабораторной практике.
9. Спрообразование прокариотов: 2 формы спор (бациллы. клостридии)
Цель занятия. Овладеть методиками приготовления основных микробиологических препаратов. Изучить морфологические формы бактерий на примере чистых культур микроорганизмов и микрофлоры полости рта.
Задачи:
1. Ознакомиться с оборудованием рабочего места и техникой безопасности при работе с микроорганизмами.
2. Изучить методы исследования микроорганизмов.
3. Овладеть методами приготовления микробиологических препаратов.
4. Изучить морфологические формы микроорганизмов.
5. Закрепить полученные знания при исследовании микрофлоры полости рта.
ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
Подготовка микробиологической лаборатории к работе.
Задание 1. Изучите теоретический материал и зарисуйте микроскоп в тетради с обозначениями деталей. Запишите какие виды микроскопий используются в медицинской лаборатории.
Для того чтобы снизить количество микроорганизмов в воздухе и на различных поверхностях, в лабораторных помещениях применяют различные способы дезинфекции. Воздух в лаборатории наиболее просто дезинфицировать проветриванием. Продолжительная вентиляция помещения через форточку (не менее 30–60 мин) приводит к резкому снижению количества микроорганизмов в воздухе, особенно при значительной разнице в температуре между наружным воздухом и воздухом помещения. Более эффективный и наиболее часто применяемый способ дезинфекции воздуха – облучение ультрафиолетовыми лучами с длиной волны от 200 до 400 нм. Рабочее место, где непосредственно проводится работа с культурами микроорганизмов, требует особенно тщательной обработки. Рабочий стол следует дезинфицировать не только до начала работы, но и после ее окончания. Для протирания поверхности стола можно использовать растворы лизола и хлорамина, а также 70%-ные (по объему) растворы изопропилового или этилового спиртов.
Для работы в учебной микробиологической лаборатории используется следующие оборудование:
1.Микроскоп. Биологический микроскоп (рис. 1) представляет собой оптический прибор, увеличивающий предметы в 40-1500 раз; состоящий из механической, оптической и осветительной систем. К механической системе микроскопа относятся подковообразная ножка, тубусодержатель, тубус, предметный столик, винты. Оптическая система включает объективы и окуляр. Осветительная система состоит из конденсора с диафрагмой изеркала.Тубусодержатель и подковообразное основание соединены между собой подвижно шарниром. Тубус - зрительная трубамикроскопа. В верхнюю часть тубуса вставлен окуляр, а в нижнюю – вращающийся вокруг своей оси револьвер, в который ввинчены объективы. Тубус передвигается вверх и вниз при помощи макрометрического и микрометрического винтов. Один оборот микрометрического винта передвигает тубус на 0,1 мм. Поэтому микровинтом пользуются для более точной наводки, а для предварительной - макровинтом. Предметный столик предназначен для размещения исследуемого материала. 
Рисунок 1 - Микроскоп
1 - макровинт; 2 - тубусодержагель; 3 - шарнирное соединение; 4-предметный столик; 5 - тубус; 6 - окуляр; 7 - револьвер; 8 - объективы; 9 - конденсор; 10 - зеркало; 11 - микровинт; 12 –подковообразное основание
Конденсор состоит из линз, собирающих отраженные от зеркала лучи в световой пучок, и направляющих его через отверстие предметного столика на препарат. При определении подвижности неокрашенных препаратов конденсор должен быть несколько опущен. Диафрагма находится между зеркалом и кондесором и служит для регулирования количества света, поступающего в конденсор. Объектив состоит из системы линз, заключенных в металлическую оправу. Передняя линза служит для увеличения предмета, остальные - для коррекции изображения. Современные б