Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Вопрос 2.Свойства, получение и применение непредельных углеводородов. Правило Марковникова
Физические свойства алкенов C2H4 – C4H8 – газы, C5H10 – C16H32 - жидкости, C17H34 – … – твердые вещества. Алкены плохо растворимы в воде. Их температуры плавления и кипения закономерно повышаются при увеличении молекулярной массы соединения.
Физические свойства алкинов Ацетилен – газ легче воздуха, мало растворим в воде, в чистом виде почти без запаха. Изменения физических свойств углеводородов ряда ацетилена (так же как у алканов и алкенов) подчиняются общим закономерностям: при увеличении относительной молекулярной массы повышается температура кипения веществ.
Химические свойства алкенов I. Реакции присоединения. 1. гидрирование 1 2 3 CH2=CH – CH3 + H – H à CH3 – CH2 – CH3 пропилен пропан
2. галогенирование 1 2 3 CH2=CH – CH3 + Br – Br à CH2 – CH – CH3 | | Br Br пропилен 1,2-дибромпропан
3. гидрогалогенирование (по правилу Марковникова: при присоединении веществ с полярной ковалентной связью типа HX (где X – это - Hal, - OH и т.д.) к несимметричным непредельным углеводородам по месту разрыва П-связи атом водорода присоединяется к наиболее гидрированному атому углерода, а X – к наименее гидрированному атому углерода) 1 2 3 CH2=CH – CH3 + H – Br à CH3 – CH – CH3 | Br пропилен 2- бромпропан
4. гидратация (по правилу Марковникова) с образованием вторичных спиртов (кроме этилена – у него образуется первичный спирт)
1 2 3 CH2=CH – CH3 + H – OH à CH2 – CH – CH3 | OH пропилен пропанол-2 (вторичный пропанол)
II. Реакции окисления. 1. горение t0 C2H4 + 3 O2 à 2 CO2 + 2 H2O
2. частичное окисление кислородом воздуха с образованием эпоксидов (реакция Прилежаева) t0, Ag 2 CH2=CH2 + O2 ––à2 CH2 – CH2 \ / O Этиленоксид (эпоксиэтан или окись этилена)
3. окисление кислородом окислителя в щелочной среде (реакция Вагнера) из KMnO4 3 CH2=CH2 + [O] + H – OH ––––––––à HO – CH2 – CH2 – OH этиленгликоль (этандиол-1,2)
KOH 3 C-2H2=C-2H2 + 2 KMn+7O4 + 4 H2O ––à 3 C-1H2 – C-1H2 + 2 Mn+4O2 + 2 KOH | | OH OH
6 Mn+7 + 3ē → Mn+4 2 2 Mn+7 + 6ē → 2 Mn+4
Обесцвечивание щелочного раствора KMnO 4 – это качественная реакция на непредельные углеводороды.
4. жесткое окисление кислородом более энергичного окислителя в кислой среде (кислый раствор KMnO4, HNO3, хромовая смесь) при нагревании
СH3 – СH=CH – CH3 + 4 [O] ––à 2 CH3 – COOH бутилен-2 этановая (уксусная) кислота
метановая CO2↑ H2O кислота угольная кислота
III. Реакции полимеризации.
t0, kt, P …+ CH2=CH2 + CH2=CH2 + …––––––à …-CH2 – CH2 – CH2 – CH2-… этилен полиэтилен
t0, kt, P
IV. Реакции изомеризации.
550°C CH2=CH2 – CH2 – CH3 ––––à CH3 – CH = CH – CH3 + CH3 – C = CH2 | CH3 бутен-1 бутен-2 метилпропен
Химические свойства алкинов а) Реакция галогенирования Происходит в две стадии по месту расположения пи- связи (сначала разрушается одна пи-связь, образуется алкен, затем вторая – образуется алкан). 1. Галогенирование (присоединение галогенов): 1 стадия. СН ≡ СН + Br 2 (р-р) → СНВ r = СНВ r; 1,2-дибромэт ен 2 стадия. СНВ r = CHBr + Br 2 (р-р) → СНВ r 2 — CHBr 2 1,1,2,2-тетрабромэт ан Суммарное уравнение: CH ≡ CH + 2 Br ₂ → CHBr ₂ — CHBr ₂ Качественная реакция на пи-связь обесцвечивание бромной воды.
б) Реакция гидрирования Закончить уравнения реакций. 2. Присоединение водорода: СН ≡ СН + Н2 → Y 1 стадия: СН ≡ СН + Н2 → X; 2 стадия: X + H ₂ → Y. в) Реакция гидрогалогенирования – обучающийся у доски Составить уравнение реакции 1 стадии присоединения хлороводорода. 3.присоединение галогеноводорода СН ≡ СН + НС l → СН2= СНС l винилхлорид Продукт первой стадии винилхлорид используется в промышленности для реакций полимеризации получают полимер-поливинилхлорид (ПВХ) имеет важное промышленное значение. г) Реакция гидратации Гидратация 4.Реакция присоединения воды в присутствии солей ртути – реакция Кучерова: СН ≡ СН + НОН → СН3—С = О ацетальдегид І H ! Остальные алкины образуют кетоны
д) Реакции окисления– самостоятельная работа в тетради Окисление 1. Горение (закончить уравнение реакции): С2Н2 + О2 →? Ацетилен горит коптящим пламенем, т.к. соотношение атомов углерода и водорода в соединении одинаково. 2.Обесцвечивание раствора перманганата калия КМnО4 качественная реакция на пи-связь: СН ≡ СН + КМ n О4 → СООН—СООН щавелевая кислота е) Реакции полимеризации Реакции полимеризации 1.Димеризация: СН ≡ СН + СН ≡ СН → СН≡ С—СН=СН2 (CuCl) бутен-1-ин-3 (винилацетилен) 2. Тримеризация: СН ≡ СН + СН ≡ СН + СН ≡ СН → С6Н6 бензол (t=6000С, катализатор уголь активированный Сакт)
Получение алкенов
1. Крекинг нефтепродуктов C16H34 à C8H18 + C8H16 гексадекан октан октен Обычно образуется смесь различных углеводородов: например, при крекинге бутана конечными продуктами будет – смесь бутенов, пропилена, этилена и метана; при крекинге пропана – смесь пропилена, этилена и метана; при крекинге метилпропана – смесь метилпропилена, пропилена и метана. 2. Дегидрирование предельных углеводородов 550-650oc, Kt 2CH4 –––––––––––à C2H4 + 2H2 Получение алкинов 1. Метановый способ: 2СН4 → С2Н2 + 3Н2 (при t =15000С) 2. Карбидный способ: СаС2 + 2Н2О → С2Н2 + Са(ОН)2
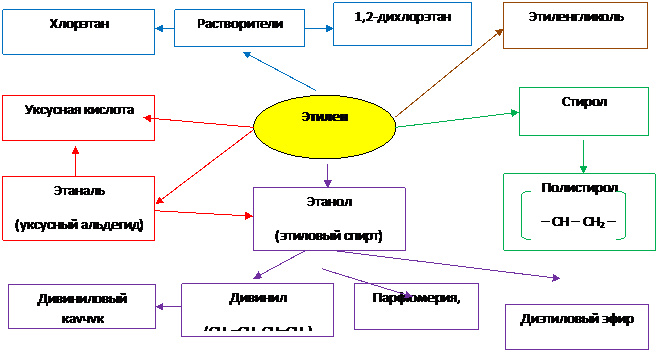
Применение алкенов 1. Применение этилена
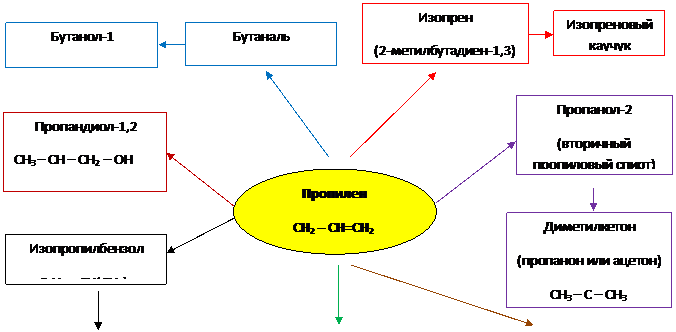
2. Применение пропилена
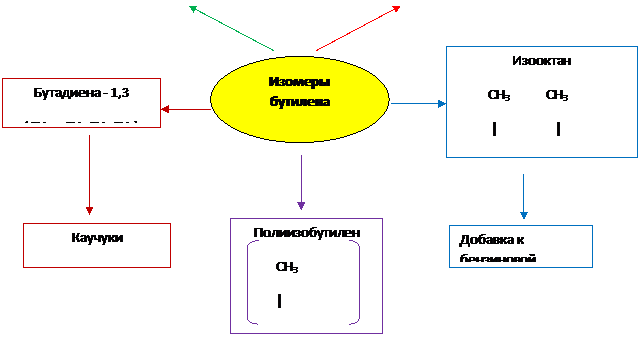
3. Применение изомеров бутилена
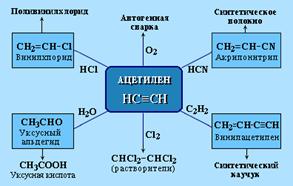
Применение алкинов (самостоятельно)! Ацетилен используется для получения самых разнообразных веществ:
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-01-08; просмотров: 213; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.129.13.201 (0.035 с.) |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||


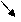 HCOOH + [O] ––à HOCOOH (H2CO3)
HCOOH + [O] ––à HOCOOH (H2CO3)