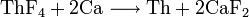Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Где накапливается стронций в человеке?⇐ ПредыдущаяСтр 20 из 20
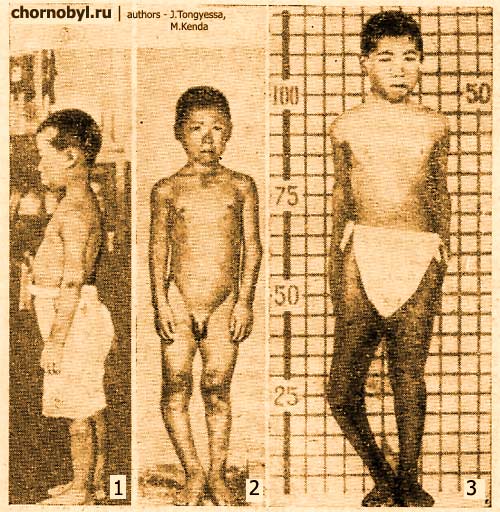
Стронций остеотроп – то есть элемент, который накапливается избирательно в определенных тканях живых существ, в том числе и человека. Этим органом (тканью) является скелет (кости). Объясняется такая закономерность очень просто – по химическим свойствам стронций подобный кальцию, который является основных строительным элементом скелета всех организмов. При дефиците кальция, а зона Полесья бедна на этот элемент, и при наличии радиоактивного стронция – организм без разбору накапливает в костях этот радионуклид. Накопления стронция в костях вызывает и другую важную проблему – радионуклид очень медленно выводится из человеческого организма (скелета). Через двести дней выводится только половина накопленного стронция. Важно, что накапливаясь в костях – стронций облучает важные, говоря языком радиобиологии, критические органы человека – костный мозг. Место, где образовывается кровь человека. Высокое содержания стронция в костях человека способно оказать существенное воздействие на этот орган и вызвать соответствующие заболевания. Чтобы понять насколько избирательно накапливается стронций в костной ткани, укажем, что например в мышечной ткани (мясе) стронция накапливается только один процент – остальное в костях. Влияние радиоактивного стронция Высокое накопление стронция, особенно в организме детей, может привести к крайне опасным последствиям. Радиоактивный стронций облучает растущую костную ткань, что приводить к заболеванию и деформации суставов ребенка, наблюдается задержка в росте. Это заболевание имеет даже свое название – стронциевый рахит. Наиболее ярко негативное влияние стронция на организм человека запечатлено на фото ребенка, который пережил ядерную бомбардировку в Хиросиме.
Фото поражение человека инкорпорированным стронцием. 1 – фото ребенка через 2 года после бомбандировки (1947 год); 2 – прогрессирующее поражение сустава ноги (снимок сделан через 1 год после первого снимка); 3 – ребенок в 1951 году (развитие болезни). Как уже отмечали, при высоком накоплении стронция в костях происходит облучение и поражение костного мозга. Хроническое облучение приводит к развитию лучевой болезни, появлению опухолей в системах кровообразования, а также возникают злокачественные опухоли в костях. Вызывает лейкемию, приводит к поражению печени и мозга человека.
Важным профилактическим методом, который позволяет предотвратить поступления стронция в организм человека является правильное приготовление пищи, которая получена на территориях подвергшихся загрязнению стронцием-90. Кулинарная обработка позволяет снизить концентрацию радионуклида в несколько раз. Ненужно пренебрегать такими простыми процедурами.
THORIUM ЗОХ 200X1 M Торий То́рий — элемент III группы таблицы Менделеева, принадлежащий к актиноидам; тяжёлый слаборадиоактивный металл. Нахождение в природе Торий почти всегда содержится в минералах редкоземельных элементов, которые служат одним из источников его получения. Содержание тория в земной коре 8 – 13 г/т, в морской воде 0,05 мкг/л. В магматических породах содержание тория уменьшается от кислых (18 г/т) к основным (3 г/т). Значительное количество тория накапливается в связи с пегматитовыми и постмагматическими процессами, при этом его содержание увеличивается с повышением количества калия в породах. Основная форма нахождения тория в породах в виде основной составной части уран-ториевых либо изоморфной примеси в акцессорных минералах. В постмагматических процессах в определённых благоприятных условиях (обогащённость растворов галоидами, щелочами и углекислотой) торий способен мигрировать в гидротермальных растворах и фиксироваться в скарновых уран-ториевых и гранат-диопсидовых ортитсодержащих месторождениях. Здесь главными минералами тория являются монацит и ферриторит. Накапливается торий также в некоторых грейзеновых месторождениях, где он концентрируется в ферриторите либо образует минералы, содержащие титан, уран и др. [править] Месторождения Торрий содержится в основном в 12 минералах. [править] Изотопы Основная статья: Изотопы тория На данный момент известны 30 изотопов тория и еще 3 возбуждённых изомерных состояний некоторых его нуклидов.
Только один из нуклидов тория (торий-232) обладает достаточно большим периодом полураспада по отношению к возрасту Земли, поэтому практически весь природный торий состоит только из этого нуклида. Некоторые из его изотопов могут определяться в природных образцах в следовых количествах, так как входят в радиоактивные ряды радия, актиния и тория:
Наиболее стабильными изотопами являются 232Th (период полураспада составляет 14,05 миллиардов лет), 230Th (75 380 лет), 229Th (7 340 лет), 228Th (1,9116 года). Оставшиеся изотопы имеют периоды полураспада менее 30 дней (большинство из них имеют периоды полураспада менее 10 минут)[3]. [править] Получение
Торий, как и некоторые другие редкоземельные элементы, выделяют из галогенидов или оксида методом металлотермии (кальцийтермии):
[править] Применение Торий имеет ряд областей применения, в которых подчас играет незаменимую роль. Положение этого металла в Периодической системе элементов и структура ядра предопределили его применение в области мирного использования атомной энергии. Торий-232 — четно-четный изотоп (четное число протонов и нейтронов), поэтому не способен делиться тепловыми нейтронами и быть ядерным горючим. Но при захвате теплового нейтрона 232Th превращается в 233U по схеме: 232Th + n → 233Th — (β-) → 233Pa — (β-) → 233U. Уран-233 способен к делению подобно урану-235 и плутонию-239, что открывает более чем серьёзные перспективы для развития атомной энергетики (уран-ториевый топливный цикл, реакторы на быстрых нейтронах). В атомной энергетике применяются карбид, оксид и фторид тория (в высокотемпературных жидкосолевых реакторах) совместно с соединениями урана и плутония и вспомогательными добавками. Так как общие запасы тория в 3—4 раза превышают запасы урана в земной коре, то атомная энергетика при использовании тория позволит на сотни лет полностью обеспечить энергопотребление человечества. Кроме атомной энергетики, торий в виде металла с успехом применяется в металлургии (легирование магния и др.), придавая сплаву повышенные эксплуатационные характеристики (сопротивление разрыву, жаропрочность). Отчасти торий в виде окиси применяется в производстве высокопрочных композиций как упрочнитель (для авиапромышленности). Оксид тория из-за его наивысшей температуры плавления из всех оксидов (3350 K) и неокисляемости идёт на производство наиболее ответственных конструкций и изделий, работающих в сверхмощных тепловых потоках, и может быть идеальным материалом для облицовки камер сгорания и газодинамических каналов для МГД-электростанций. Тигли, изготовленные из окиси тория, применяются при работах в области температур около 2500—3100 °C. Ранее оксид тория применялся для изготовления калильных сеток в газовых светильниках. Торированные катоды прямого накала применяются в электронных лампах, а оксидно-ториевые — в магнетронах и мощных генераторных лампах. Добавка 0,8—1 % ThO2 к вольфраму стабилизирует структуру нитей ламп накаливания. Ксеноновые дуговые лампы почти всегда имеют торированные катод и анод, поэтому незначительно радиоактивны. Оксид тория применяется как элемент сопротивления в высокотемпературных печах. Торий и его соединения широко применяют в составе катализаторов в органическом синтезе.
[править] Биологическая роль Торий постоянно присутствует в тканях растений и животных. Коэффициент накопления тория (то есть отношение его концентрации в организме к концентрации в окружающей среде) в морском планктоне — 1250, в донных водорослях — 10, в мягких тканях беспозвоночных — 50—300, рыб — 100. В пресноводных моллюсках его концентрация колеблется от 3×10−7 до 1×10−5 %, в морских животных от 3×10−7 до 3×10−6 %. Торий поглощается главным образом печенью и селезёнкой, а также костным мозгом, лимфатическими узлами и надпочечниками; плохо всасывается из желудочно-кишечного тракта. У человека среднесуточное поступление тория с продуктами питания и водой составляет 3 мкг; выводится из организма с мочой и калом (0,1 и 2,9 мкг соответственно). Торий малотоксичен, однако как природный радиоактивный элемент вносит свой вклад в естественный фон облучения организмов. [править] Любопытные факты
[править] Примечания
[править] Ссылки
Периодическая система химических элементов Д. И. Менделеева [скрыть]
Ядерная технология | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Инженерия | Ядерная физика · Деление ядра · Термоядерная реакция · Излучение · Ионизирующее излучение · Атомное ядро · Ядерная безопасность · Ядерная химия | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Материалы | Ядерное топливо · Отработанное ядерное топливо · Ядерное топливное сырье · Торий · Уран (Обогащение урана • Обеднённый уран) · Плутоний · Дейтерий · Тритий | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Ядерная энергия |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Ядерная медицина |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Ядерное оружие | История ·Разработка ·Ядерная война ·Ядерная гонка ·Ядерный взрыв(Поражающие факторы ядерного взрыва) ·Ядерное испытание ·Перевозка ·распространение Ядерный клуб · Список ядерных испытаний | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

| Это незавершённая статья о химическом элементе. Вы можете помочь проекту, исправив и дополнив её. |
Источник — «http://ru.wikipedia.org/wiki/%D0%A2%D0%BE%D1%80%D0%B8%D0%B9»
Категории: Химические элементы | Торий | Актиноиды
Скрытые категории: Википедия:Статьи с незавершёнными разделами | Статьи со ссылками на Викисклад | Незавершённые статьи о химических элементах
URANIUM 30X200X 1M
Уран Ура́н (устаревший вариант — ура́ний [3]) — химический элемент с атомным номером 92 в периодической системе, атомная масса 238,029; обозначается символом U (лат. Uranium), относится к семейству актиноидов.
Уран широко распространён в природе. Кларк урана составляет 0,0003 % (вес.), концентрация в морской воде 3 мкг/л. Количество урана в слое литосферы толщиной 20 км оценивается в 1,3×1014 т.
Основная масса урана находится в кислых породах с высоким содержанием кремния. Значительная масса урана сконцентрирована в осадочных породах, особенно обогащённых органикой. В больших количествах как примесь уран присутствует в ториевых и редкоземельных минералах (ортит, сфен CaTiO3[SiO4], монацит (La,Ce)PO4, циркон ZrSiO4, ксенотим YPO4 и др.). Важнейшими урановыми рудами являются настуран (урановая смолка), уранинит и карнотит. Основными минералами — спутниками урана являются молибденит MoS2, галенит PbS, кварц SiO2, кальцит CaCO3, гидромусковит и др.
|
|
Физиологическое действие

В микроколичествах (10−5—10−8 %) обнаруживается в тканях растений, животных и человека. В наибольшей степени накапливается некоторыми грибами и водорослями. Соединения урана всасываются в желудочно-кишечном тракте (около 1 %), в легких — 50 %. Основные депо в организме: селезёнка, почки, скелет, печень, лёгкие и бронхо-лёгочные лимфатические узлы. Содержание в органах и тканях человека и животных не превышает 10−7г.
Уран и его соединения токсичны. Особенно опасны аэрозоли урана и его соединений. Для аэрозолей растворимых в воде соединений урана ПДК в воздухе 0,015 мг/м³, для нерастворимых форм урана ПДК 0,075 мг/м³. При попадании в организм уран действует на все органы, являясь общеклеточным ядом. Уран практически необратимо, как и многие другие тяжелые металлы, связывается с белками, прежде всего, с сульфидными группами аминокислот, нарушая их функцию. Молекулярный механизм действия урана связан с его способностью подавлять активность ферментов. В первую очередь поражаются почки (появляются белок и сахар в моче, олигурия). При хронической интоксикации возможны нарушения кроветворения и нервной системы.