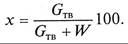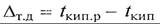Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Тема 2.3. Выпаривание растворов
Ч., в т.ч. лаб. раб. и практ. занят 4ч.
Студент должен:
знать: - назначение выпарных аппаратов; - принципы составления материального и теплового балансов процесса выпаривания; - устройство и принцип работы выпарных аппаратов; - принципы расчета выпарных аппаратов;
уметь: - составлять материальный и тепловой балансы; - определять основные расчетные параметры процесса выпаривания; - выбрать оптимальные варианты схемы выпарной установки. Сущность выпаривания. Выпаривание при атмосферном давлении, при вакууме, при избыточном давлении. Выпарные установки: однокорпусные, многокорпусные, с термокомпрессией вторичного пара. Общая и полезная разность температур при выпаривании. Температура кипения растворов, температурные потери. Выпарные аппараты, их классификация. Аппараты с направленной и неупорядоченной циркуляцией раствора. Пленочные выпарные аппараты, роторные аппараты, аппараты с барботажем топочных газов и погружными горелками. Принципы выбора выпарных установок различных конструкций. Материалы для изготовления выпарных аппаратов. ВЫПАРИВАНИЕ РАСТВОРОВ Выпаривание – процесс концентрирования растворов твердых нелетучих веществ путем частичного удаления растворителя при кипении в виде пара. В технике процесс выпаривания получил широкое распространение, так как многие вещества (щелочи, соли, сахар и др.) получают в виде растворов (чаще всего водных), а для дальнейшего потребления, хранения и транспортировки концентрация их должна быть значительно повышена. Выпаривание применяют иногда для выделения растворителя в чистом виде, например при опреснении морской воды, когда полученный пар конденсируется и используется в бытовых или технических целях. При использовании насыщенного водяного пара в качестве горячего теплоносителя он называется греющим или первичным. В отличие от него образующийся в процессе кипения раствора пар называют вторичным. Вторичный пар, отбираемый для дальнейшего технического использования, называют экстрапаром. Свойства растворов 1. Концентрацией х, или составом раствора, называется массовое количество растворенного твердого вещества Gтв в определенном массовом или объемном количестве раствора или растворителя W, которое определяется в процентах как
Для большинства растворов в определенном количестве растворителя при конкретных условиях можно растворить ограниченное количество твердого вещества. Раствор, содержащий при данных условиях предельное количество растворенного вещества, называется насыщенным. Количество растворенного вещества в насыщенном растворе, отнесенное к определенному количеству раствора или растворителя, называется растворимостью. Растворимость твердых веществ в воде не является постоянной величиной, а изменяется в значительных пределах в зависимости от температуры. При этом различают вещества с прямой растворимостью, которая увеличивается с повышением температуры (NaNO3, KNO3, NаОН, КОН и др.), и обратной растворимостью, падающей с повышением температуры (MnSO4, Na2SO4 и др.). 2. Теплоемкость с веществ, и в частности растворов, незначительно зависит от температуры. Однако концентрация растворенного вещества оказывает значительное влияние на величину теплоемкости. Функция эта имеет нелинейную зависимость, поэтому для проведения расчетов обычно пользуются справочными данными, представленными в виде таблиц или графиков. 3. Температурная депрессия Δт.д. Температура кипения воды при нормальном давлении составляет 100°С. Ту же температуру имеют образовавшиеся водяные пары. Температура кипения воды понижается с уменьшением окружающего давления и повышается с его увеличением. На ту же величину изменяется температура паров над чистой жидкостью. Если в кипящей жидкости находится растворенное вещество, то раствор начинает кипеть при более высокой температуре, увеличивающейся c повышением концентрации растворенного вещества. Температура образующихся при этом паров над раствором будет меньше, и ее величина соответствует температуре кипения чистого растворителя при том же давлении. Разность между температурой кипения раствора tкип.р и растворителя tкип называют физико-химической или температурной депрессией
и определяют по таблицам и графикам, составленным на основании опытных данных.
4. Теплота растворения (концентрирования). При проведении процесса растворения солей происходят физико-химические процессы, сопровождающиеся противоположными тепловыми эффектами. Так, разрушение кристаллической решетки твердого вещества требует затрат энергии и сопровождается поглощением теплоты. Химическое взаимодействие растворяемого вещества с растворителем – сольватация (при растворении в воде – гидратация) сопровождается выделением теплоты. Алгебраическая сумма выделившейся и поглощенной теплоты определяет общий тепловой эффект процесса растворения. Эта же величина с обратным знаком характеризует тепловой эффект в процессе концентрирования Δq и может быть определена из справочной литературы для конкретных условий проведения процесса.
|
||||||
|
Последнее изменение этой страницы: 2020-12-09; просмотров: 132; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.218.70.93 (0.004 с.) |