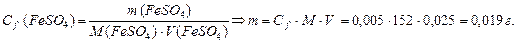Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Важной характеристикой раствора является концентрация. Этой величиной определяются многие свойства растворов.Стр 1 из 9Следующая ⇒
Химия входит в число наук, составляющих фундамент медицины. Химические методы исследования постоянно используются в диагностике заболеваний и профилактических обследованиях. Химический синтез является основой изготовления лекарств. Поэтому, для дальнейшего изучения материала, необходимо знать теоретические основы химии. Наряду с теоретической базой, в медицине применяются экспериментальные методы, помогающие освоению материала. В настоящее время практикуму, как специфической и важнейшей форме учебной работы, уделяется особое внимание, так как усвоение изучаемого материала, может происходить только в ходе активной деятельности самого учащегося. Эта деятельность реализуется на практике и лабораторных занятиях в процессе решения различных ситуационных задач. Без знания техники лабораторных работ нельзя быть уверенным в точности поставленного эксперимента. Многие химические процессы протекают лишь при условии, что участвующие в них вещества находятся в растворенном состоянии. Растворы имеют большое значение, как в промышленности, так и в медицине. Важнейшие биологические жидкости – кровь, лимфа, моча, слюна, пот являются растворами солей, белков, углеводов, липидов в воде. Усвоение пищи связано с переходом питательных веществ в растворенное состояние. Биохимические реакции в живых организмах протекают в растворах. В жидких средах организма поддерживается постоянство кислотности, концентрации солей и органических веществ (концентрационный гомеостаз). Биологические жидкости участвуют в транспорте питательных веществ (жиров, аминокислот, кислорода), лекарственных препаратов к органам и тканям, а также в выведении из организма метаболитов (мочевины, билирубина, углекислого газа и т.д.). Приведенные примеры подчеркивают важность изучения свойств растворов для медиков. Химическую посуду изготавливают из различных материалов, её классифицируют на стеклянную, кварцевую, фарфоровую, металлическую, пластиковую, высокоогнеупорную. Посуда общего назначения
Пробирки представляют собой узкие цилиндрической формы сосуды с закругленным дном; они бывают различной величины и диаметра и из различного стекла. Обычные лабораторные пробирки изготовляют из легкоплавкого стекла, но для особых работ, когда требуется нагревание до высоких температур, пробирки изготовляют из тугоплавкого стекла или кварца. Кроме обычных, простых пробирок, применяют также градуированные и центрифужные конические пробирки (рис. 1).
Для хранения пробирок, находящихся в работе, служат специальные деревянные, пластмассовые или металлические штативы.
Химические стаканы (рис. 2) имеют различную вместимость от 50 до 1000 см3. Стаканы изготавливают из термо- и химически стойкого стекла. Стаканы из термостойкого стекла маркируют специальным знаком – матовым прямоугольником или кругом.
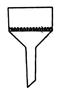
Конические колбы (рис. 3) широко применяются при титровании. Изготавливают колбы из тонкостенного или термостойкого стекла. Они бывают различной вместимости (25 – 2000 см3). Капельные или капиллярные пипетки применяют для взятия проб, отделения раствора от осадка, а также прибавления малых объемов реактивов. Использованные пипетки опускают в стакан с водой, чтобы не дать реактиву высохнуть в капилляре. Воронки (рис. 4) служат для переливания жидкостей, фильтрования, приготовления растворов и заполнения бюреток. В фарфоровых чашках и тиглях (рис. 5) вместимостью 5 – 10 см3нагревают или выпаривают растворы, прокаливают сухие остатки.
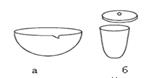
Стеклянные палочки с оплавленными концами используют для перемешивания растворов. Часовое или предметное стекло применяют для обнаружения отдельных ионов. Капельницы (рис. 6) предназначены для работы с индикаторами. Мерная посуда
Объем жидкости можно измерить с различной степенью точности, которая определяется задачей анализа. В зависимости от относительной погрешности, допускаемой при измерении объема, мерная посуда делится на две группы – для приблизительного и точного измерения объема.
К посуде для приблизительного измерения объема относятся мерные цилиндры, стаканы и мензурки. Относительная погрешность при измерении объема такой посудой составляет 1 % и более.
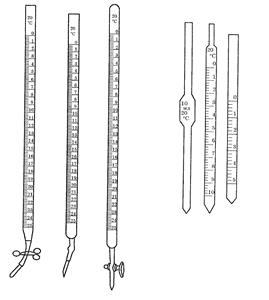
Мерные цилиндры (рис. 7 а) – стеклянные и пластиковые толстостенные сосуды с нанесенными на внешней стенке делениями, указывающими объем в см3 (5 – 2000 см3). Чтобы отмерить нужный объем жидкости, ее наливают в мерный цилиндр до тех пор, пока нижний край мениска не достигнет уровня нужного деления. Иногда встречаются цилиндры, снабженные притертыми пробками. Обычно их применяют только при специальных работах.
Мерные стаканы (рис. 7 б) дают самую большую ошибку в измерении объема из-за редких делений, указывающих объем.
Мензурки (рис. 7 в) – сосуды конической формы, на стенке которых нанесена шкала. Вместимость мензурок 50 – 1000 см3.
К посуде для точного измерения объемов относят мерные колбы, мерные пипетки и бюретки. Относительная ошибка при измерении объема составляет менее 1 %. Точный объем измеряют и записывают в виде числа, содержащего два знака после запятой.
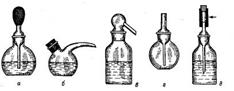
Мерные колбы (рис. 8) предназначены для приготовления растворов точной концентрации, имеют одну метку на длинном узком горлышке. Мерные колбы бывают различной емкости – от 50 мл до 2 л. Они бывают с притертой пробкой и без нее. Мерные колбы служат для приготовления рабочих растворов, для разбавления до определенного объема или же для растворения какого-либо вещества в определенном объеме соответствующего растворителя.
Бюретки и пипетки (рис. 9)– это мерная посуда, используемая при проведении химического анализа. Бюретки используются для титрования. Работа с рефрактометром. Одну или две капли исследуемого раствора соли, помещают между призмами рефрактометра. В окно верхней призмы направляют источник света. Через нижнюю призму свет попадает на шкалу прибора, частично её освещая и создавая чёткую границу света снизу и тени сверху. Если граница светотени недостаточно чёткая, имеет радужные полоски, то вращением компенсатора добиваются их исчезновения. Поворотом рычага, на котором закреплён окуляр, добиваются совмещения трёх чёрточек с границей светотени и считывают по левой шкале коэффициент рефракции, по правой - процентное содержание вещества. Контроль работы производится по дистиллированной воде, коэффициент рефракции которой равен 1,333. Зная коэффициент рефракции раствора, по таблице находят его процентное содержание. Необходимо помнить, что таблица составляется только для определенного вещества. Вывод:
Вопросы для обсуждения.
4. Выполнить тестовые задания (письменно):
5. Ситуационные задачи:
6. Задачи для самостоятельного решения (выполнить письменно):
7. Вспомогательные материалы по самоподготовке: Аналитическая химия – наука о методах и приемах определения качественного и количественного химического состава веществ или их смесей.
АНАЛИТИЧЕСКАЯ ХИМИЯ
Качественный анализ
Инструментальные |
Химические | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Физико-химические | Физические | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Сначала выполняют соответствующую химическую реакцию, потом выбирают какой-нибудь физический метод для анализа полученного продукта реакции. | Проводят определение веществ по физическим свойствам (вязкость, интенсивность окрашивания, электрическая проводимость). Спектральный анализ (используют спектры излучения, характерный для каждого химического элемента). Люминесцентный анализ (используют спектры люминесцентного излучения, характерные для индивидуального вещества). | В химических методах проводят химические реакции и измеряют: - массу полученного продукта (гравиметрические методы) или объем реагента, пошедший на взаимодействие с анализируемым веществом (титриметрические методы). | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Использование физических и физико-химических методов часто требует применения дорогостоящей аппаратуры. Поэтому в качественном анализе эти методы анализа используют не так часто, как химические. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Использование разнообразных типов химических реакций (см. ниже), позволяет считать титриметрический анализ более универсальным методом, чем гравиметрический. Он дает возможность анализировать значительно большее число объектов, кроме того, титриметрический анализ занимает значительно меньше времени чем гравиметрический анализ.
Термин «титриметрический» произошел от слова «титр», что означает содержание вещества (в граммах) в 1 мл раствора.
Титриметрический анализ основан на точном измерении количества реактива, затраченного на реакцию с определенным компонентом. Раствор, содержащий реагент, концентрация которого известна с большой точностью, называется рабочим или стандартным раствором (раствором титранта), или титрованным раствором.
Второй раствор, вступающий во взаимодействие с рабочим раствором, содержит вещество неизвестной концентрации и называется анализируемым раствором.
Актуальность темы:
Все химические реакции сопровождаются выделением или поглощением теплоты, что объясняется разрывом одних химических связей в молекулах исходных веществ и образование других химических связей в молекулах продуктов реакций. Частью термодинамики является термохимия, которая изучает тепловые эффекты реакции.
Термохимические расчеты широко используют в медицине для оценки калорийности пищевых продуктов, составления диет для больных. Знание раздела термодинамики позволяет определить возможность самопроизвольного протекания реакций, направление реакций, биоэнергетику физиологических процессов в живых организмах.
Учение о скоростях протекания химических реакций (т.е. химическая кинетика) представляет для будущих врачей большой интерес, т.к. все биохимические процессы в живых клетках осуществляются с определенной скоростью и зависят от многих факторов, таких, например, как концентрация субстрата, температура.
- Цель обучения:
Знать основные понятия и законы термодинамики, кинетики, определять тепловые эффекты реакций, определять скорость и порядок реакции, проводить термохимические расчеты по определению изменения энтальпии, энтропии, энергии Гиббса, определять возможность протекания реакций.
- Вопросы для обсуждения:
1. Предмет и задачи термодинамики. Химическая термодинамика.Термодинамические системы, их классификация. Параметры и функции термодинамических систем.
2. Первое начало термодинамики. Внутренняя энергия. Энтальпия. Закон Гесса, следствия из него. Термохимия. Калориметрия.
3. Второе начало термодинамики. Энтропия. Направление самопроизвольного протекания реакции. Свободная энергия Гиббса, Гельмгольца.
4. Особенности живых организмов как термодинамических систем.
5. Химическая кинетика. Механизмы и скорость химических реакций. Гомогенные и гетерогенные реакции. Факторы, влияющие на скорость протекания реакции (природа реагирующих веществ, площадь поверхности, концентрация, температура, давление, энтропия активации, энергия активации, катализаторы).
6. Закон действия масс. Порядок реакции.
7. Зависимость скорости реакции от температуры. Уравнение Вант-Гоффа.
8. Катализ и катализаторы. Гомогенный и гетерогенный катализ. Понятие об обратимых и необратимых процессах.
9. Понятие о химическом равновесии. Константа химического равновесия. Принцип Ле-Шателье. Факторы смещения химического равновесия (температура, концентрация, давление).
10. Связь между изменением свободной энергией Гиббса и константой химического равновесия.
11. Проявление принципа Ле-Шателье в живых организмах (сопряженные реакции).









 Þ
Þ 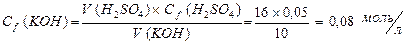
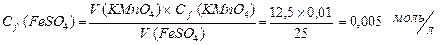 Массу FeSO4 находим по формуле:
Массу FeSO4 находим по формуле: