Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Тема 3.3. Органическая химия.Стр 1 из 3Следующая ⇒
Раздел 3. Химия. Тема 3.3. Органическая химия. Введение. Углеводороды. Кислородосодержащие органические вещества. Азотосодержащие органические вещества. Биологические полимеры. Синтетические и искусственные полимеры.
Введение. Органическая химия изучает свойства и реакции органических соединений - веществ, построенных на основе "углеродного скелета". Наибольшее количество соединений углерод образует с так элементами-органогенами: H, N, O, S, P. Способность углерода соединяться с большинством элементов и образовывать молекулы различного состава и строения обусловливает многообразие органических соединений. Название «органические соединения» связано со словом «организм»: из этих соединений в основном состоят все живые организмы. Бурное развитие органической химии началось после создания выдающимся русским химиком А.М. Бутлеровым ее теоретической основы – структурной теории, основная идея которой в том, что свойства органических соединений зависят не только от их состава, но и от структуры, т.е. последовательности связи атомов в молекуле. А.М. Бутлеров ввел понятие изомеров. Изомеры - это варианты веществ с одинаковым молекулярным составом и массой, но с разной структурой и потому с разными свойствами. Именно возможность построения из одних и тех же немногих элементов большого числа изомерных структур объясняет существование огромного количества органических соединений (их более пяти миллионов, тогда как неорганических – около пятисот тысяч). Конец ХIХ века был периодом триумфального шествия органического синтеза; в эти годы были впервые получены анилиновые красители, взрывчатые органические вещества, многие лекарства.
Углеводороды. Углеводороды – это соединения углерода с водородом. Составляют основу органических соединений. По количеству и характеру химических связей между атомами углерода они делятся на предельные и непредельные, алициклические и ароматические. Углеводороды
Спирты. Одноатомные предельные спирты. Рассмотрим отдельных представителей и общие свойства спиртов. Простейший представитель этого класса органических веществ – метанол, или метиловый спирт. Его формула – СН3ОН. Это бесцветная жидкость с характерным спиртовым запахом, хорошо растворимая в воде. Метанол – это очень ядовитое вещество. Несколько капель, принятых внутрь, приводят к слепоте человека, а немного большее его количество – к смерти! Раньше метанол выделяли из продуктов пиролиза древесины, поэтому сохранилось его старое название – древесный спирт. Метиловый спирт широко применяется в промышленности. Из него изготавливают лекарственные препараты, уксусную кислоту, формальдегид. Его применяют также в качестве растворителя лаков и красок.
Не менее распространенным является и второй представитель класса спиртов – этиловый спирт, или этанол. Его формула – С2Н5ОН. По своим физическим свойствам этанол практически ничем не отличается от метанола. Этиловый спирт широко применяют в медицине, также он входит в состав спиртных напитков. Из этанола получают в органическом синтезе достаточное большое количество органических соединений. Получение этанола. Основным способом получения этанола является гидратация этилена. Реакция происходит при высокой температуре и давлении, в присутствии катализатора. СН2=СН2 + Н2О → С2Н5ОН Реакция взаимодействия веществ с водой называется гидратацией. Многоатомные спирты К многоатомным спиртам относятся органические соединения, в молекулах которых содержится несколько гидроксильных групп, соединенных с углеводородным радикалом.
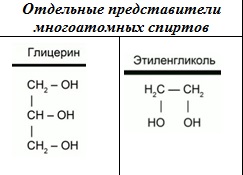
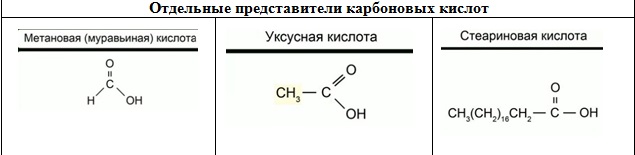
Одним из представителей многоатомных спиртов является глицерин (1,2,3-пропантриол). В состав молекулы глицерина входят три гидроксильных группы, каждая из которых находится у своего атома углерода. Глицерин – это очень гигроскопичное вещество. Он способен поглощать влагу из воздуха. Благодаря такому свойству, глицерин широко используется в косметологии и медицине. Глицерин обладает всеми свойствами спиртов. Представителем двух атомных спиртов является этиленгликоль. Его формулу можно рассматривать, как формулу этана, в которой атомы водорода у каждого атома замещены на гидроксильные группы. Этиленгликоль – это сиропообразная жидкость, сладковатая на вкус. Но она очень ядовита, и ни в коем случае ее нельзя пробовать на вкус! Этиленгликоль используется в качестве антифриза. Одним из общих свойств спиртов является их взаимодействие с активными металлами. В составе гидроксильной группы атом водорода способен замещаться на атом активного металла. 2С2Н5ОН + 2Na→ 2С2Н5ОNa+ H2↑ Получается этилат натрия, и выделяется водород. Этилат натрия – солеподобное соединение, которое относится к классу алкоголятов. В силу своих слабых кислотных свойств спирты не взаимодействуют с растворами щелочей. Карбонильные соединения К карбонильным соединениям относятся альдегиды и кетоны. В составе карбонильных соединений находится карбонильная группа. Простейшим альдегидомявляется формальдегид. Формальдегид – это газ с резким запахом, чрезвычайно ядовитое вещество! Раствор формальдегида в воде называется формалином и применяется для сохранения биологических препаратов. Формальдегид широко используют в промышленности для изготовления пластмасс, которые не размягчаются при нагревании. Простейшим представителем кетонов является ацетон. Это жидкость, которая хорошо растворяется в воде, и в основном его применяют в качестве растворителя. Ацетон обладает очень резким запахом. Карбоновые кислоты В составе карбоновых кислот находится карбоксильная группа Простейшим представителем этого класса является метановая, или муравьиная кислота. Муравьиная кислота содержится в муравьях, в крапиве и хвое ели. Ожог крапивой – это результат раздражающего действия муравьиной кислоты.
Наибольшее значение имеет уксусная кислота. Она необходима для синтеза красителей, медикаментов (например, аспирина), сложных эфиров, ацетатного волокна. 3-9%-ный водный раствор уксусной кислоты – уксус, вкусовое и консервирующее средство. Кроме муравьиной и уксусной карбоновых кислот, существует целый ряд природных карбоновых кислот. К ним относятся лимонная и молочная, щавелевая кислоты. Лимонная кислота содержится в соке лимона, малины, крыжовника, в ягодах рябины и т.д. Широко применяется в пищевой промышленности и медицины. Лимонную и молочную кислоты используют в качестве консервантов. Молочную кислоту получают путем брожения глюкозы. Щавелевая кислота используется для удаления ржавчины и в качестве красителя. В высших жирных карбоновых кислотах содержится, как правило, 15 и более атомов углерода. Например, стеариновая кислота содержит 18 атомов углерода. Соли высших карбонов кислот натрия и калия называются мылами. Стеарат натрия С17Н35СООNa входит в состав твердого мыла. Соединения каждого класса образуют различные производные. Например, к производным спиртов относятся простые эфиры ROR', к производным карбоновых кислот – сложные эфиры RCOOR', амиды RCONH2, ангидриды(RCO)2O, хлорангидриды RCOCl и т.д. Нитросоединения. Низшие нитроалканы (бесцветные жидкости) используются как растворители пластмасс, целлюлозного волокна, многих лаков, низшие нитроарены (желтые жидкости) – как полупродукты для синтеза аминосоединений. Амины. Амины (или аминосоединения) можно рассматривать как органические производные аммиака. Амины могут быть первичными R – NH2, вторичными RR'NH и третичными RR'R" N, в зависимости от числа атомов водорода, которые замещены на радикалы R, R', R". Например, первичный амин — этиламин C2H5NH2, вторичный амин — дижетиламин (CH3)2NH, третичный амин – триэтиламин (C2H5)3N. Амины используются в производстве растворителей для полимеров, лекарственных препаратов, кормовых добавок, удобрений, красителей. Очень ядовиты, особенно анилин (желто-коричневая жидкость, всасывается в организм даже через кожу). Аминокислоты. Белки. Аминокислоты – органические соединения, содержащие в своем составе две функциональные группы – кислотную СООН и аминную NH2; являются основой белковых веществ. Примеры:
Аминокислоты проявляют свойства и кислот, и аминов. Так, они образуют соли (за счет кислотных свойств карбоксильной группы):
и сложные эфиры (подобно другим органическим кислотам):
С более сильными (неорганическими) кислотами они проявляют свойства оснований и образуют соли за счет основных свойств аминогруппы:
Биологические полимеры. Все органические вещества могут быть разделены на две группы: низкомолекулярные вещества и полимеры. Размеры низкомолекулярных веществ обычно составляют десятки и сотни атомных единиц массы, а.е.м., тогда как полимеры достигают массы в миллионы и даже миллиарды а.е.м.. Однако такие вещества построены из небольшого количества многократно повторяющихся единиц — мономеров, что значительно упрощает их образование в клетке. Количество мономеров в молекуле полимера может варьировать от нескольких штук до десятков миллионов. Например, глутатион, пептид, играющий важную роль в окислительно-восстановительных процессах, состоит всего из трех аминокислот, а молекула ДНК, образующая единственную хромосому бактерий, построена более чем из 3 млн. нуклеотидов. Гомо- и гетерополимеры Полимер может состоять из одинаковых мономеров. Такие полимеры называют гомополимерами. К ним относятся, например, крахмал и целлюлоза. Однако большая часть биологических полимеров построена из нескольких типов мономеров. Они носят название гетерополимеров. Мономеры, входящие в состав гетерополимеров, относятся, как правило, к одному классу веществ и соединяются одинаковыми связями. Примером гетерополимеров могут служить гиалуроновая кислота, состоящая их двух мономеров, и белки, построенные более чем из 20 различных мономеров. Разветвленность. 1. Неразветвленные, или линейные, полимеры образуются, если каждый мономер образует две связи с соседними мономерами. Такими полимерами являются белки, нуклеиновые кислоты, многие полисахариды. 2. Разветвленные полимеры образуются, если к мономеру присоединяется три или более других мономера. Примерами разветвленных полисахаридов являются крахмал и гликоген. Разветвление обычно происходит лишь на небольшой части мономеров, поэтому разветвленные полимеры могут различаться по частоте ветвления. Длина ответвлений также может быть разной: от одного до десятков и сотен мономеров. Встречаются полимеры, в которых основная цепь состоит из одного мономера, а боковые — из другого. Раздел 3. Химия. Тема 3.3. Органическая химия. Введение. Углеводороды.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2020-12-09; просмотров: 104; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.191.46.36 (0.034 с.) |