
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Растворение как физико-химический процес
Растворы образуются при взаимодействии растворителя и растворённого вещества. Процесс взаимодействия растворителя и растворённого вещества называется сольватацией (если растворителем является вода - гидратацией). Растворение протекает с образованием различных по форме и прочности продуктов - гидратов. При этом участвуют силы как физической, так и химической природы. Процесс растворения вследствие такого рода взаимодействий компонентов сопровождается различными тепловыми явлениями. Энергетической характеристикой растворения является теплота образованияраствора, рассматриваемая как алгебраическая сумма тепловых эффектов всех эндо- и экзотермических стадий процесса. Наиболее значительными среди них являются: Если энергия разрушения кристаллической решетки меньше энергии гидратации растворённого вещества, то растворение идёт с выделением теплоты (наблюдается разогревание). Так, растворение NaOH – экзотермический процесс: на разрушение кристаллической решётки тратится 884 кДж/моль, а при образовании гидратированных ионов Na+ и OH-выделяется соответственно 422 и 510 кДж/моль. Если энергия кристаллической решётки больше энергии гидратации, то растворение протекает с поглощением теплоты (при приготовлении водного раствора NH4NO3 наблюдается понижение температуры). Растворимость
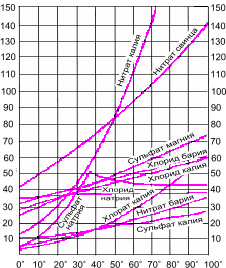
Предельная растворимость многих веществ в воде (или в других растворителях) представляет собой постоянную величину, соответствующую концентрации насыщенного раствора при данной температуре. Она является качественной характеристикой растворимости и приводится в справочниках в граммах на 100 г растворителя (при определённых условиях). Растворимость зависит от природы растворяемого вещества и растворителя, температуры и давления. Природа растворяемого вещества. Кристаллические вещества подразделяются на: P - хорошо растворимые (более 1,0 г на 100 г воды); M - малорастворимые (0,1 г - 1,0 г на 100 г воды);
Природа растворителя. При образовании раствора связи между частицами каждого из компонентов заменяются связями между частицами разных компонентов. Чтобы новые связи могли образоваться, компоненты раствора должны иметь однотипные связи, т.е. быть одной природы. Поэтому ионные вещества растворяются в полярных растворителях и плохо в неполярных, а молекулярные вещества - наоборот. Влияние температуры. Если растворение вещества является экзотермическим процессом, то с повышением температуры его растворимость уменьшается (Например,Ca(OH)2 в воде) и наоборот. Для большинства солей характерно увеличение растворимости при нагревании.
Влияние давления. С повышением давления растворимость газов в жидкостях увеличивается, а с понижением уменьшается.
Контрольные вопросы: 1. Какие смеси называют растворами? 2. Из каких компонентов состоят растворы? 3. Какие растворы называют насыщенными, ненасыщенными, разбавленными, концентрированными? 4. Может ли разбавленный раствор быть насыщенным? 5. Обязательно ли концентрированны раствор будет насыщенным? 6. Что означает массовая частичка? 7. Химическим или физическим является процесс растворения? 8. Какие существуют типы связей? 9. Почему вода является полярным растворителем? 10. Чем отличаются истинные растворы от дисперсных систем? 11. Где в жизни вы встречались с ратсворами?
Литература 1. Буринська Н.М., Депутат В.М., Сударєва Г.Ф., Чайченко Н.Н. Хімія: Підручник для 10 класу загальноосвітніх навчальних закладів (профільний рівень). – К.: Педагогічна думка, 2010. – 352 с., іл., табл. 2. Величко Л.П. Хімія: підручник для 11 класу загальноосвітніх начальних закладаів: Академічний рівень. – К.: Освіта, 2011. – 223 с. 3. Габриелян О.С. Химия. 9, 10, 11 кл. – М., 2000, 2003. 4. Габриелян О. С., Остроумов И. Г. Химия для профессий и специальностей социально-экономического и гуманитарного профилей: учебник для студ. учреждений сред. проф. образования. — М., 2014. 5. Габриелян О.С. Химия. Практикум: учеб. пособие. — М., 2014. 6. Габриелян О.С. и др. Химия. Тесты, задачи и упражнения: учеб. пособие. — М., 2014. 7. Габриелян О.С. Химия. Пособие для подготовки к ЕГЭ: учеб. пособие. — М., 2014. 8. Ерохин Ю. М. Химия: Задачи и упражнения: учеб. пособие для студ. учреждений сред. проф. образования. — М., 2014. 9. Ерохин Ю. М. Сборник тестовых заданий по химии: учеб. пособие для студ. Учреждений сред. проф. образования. — М., 2014. 10. Попель П.П., Крикля Л.С. Хімія: підручник для 10 класу загальноосвітніх навчальних закладів. – К.: ВЦ «Академія», 2010. – 208 с.: іл. 11. Попель П.П., Крикля Л.С. Хімія: підручник для 11 класу загальноосвітніх навчальних закладаів (академічний рівень). – К.: ВЦ «Академія, 2011. – 352 с.: іл. 12. Попель П.П., Крикля Л.С, Савченко І.О. Хімія: підручник для 11 класу загальноосвітніх навчальних закладів. – К.: ВЦ «Академія», 2007. – 272 с. 13. Савинкина Е.В., Логинова Г.П. Химия для школ и классов гуманитарного профиля. 10, 11 кл. – М., 2001-2002. 14. Химия: электронный учебно-методический комплекс. — М., 2014. 15. Ярошенко О.Г. Хімія: Підручник для 10 класу загальноосвітніх начальних закладів (рівень стандарту, академічний рівень). – К.: Грамота, 2010. – 224 с.: іл.
|
||||||||
|
Последнее изменение этой страницы: 2020-12-09; просмотров: 321; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.191.22 (0.024 с.) |
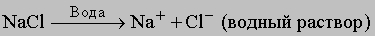 <="" div="" style="padding: 0px; margin: 0px; border-style: none; cursor: default;">
<="" div="" style="padding: 0px; margin: 0px; border-style: none; cursor: default;"> <="" div="" style="padding: 0px; margin: 0px; border-style: none; cursor: default;">
<="" div="" style="padding: 0px; margin: 0px; border-style: none; cursor: default;">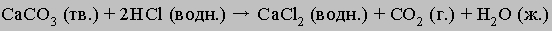 <="" div="" style="padding: 0px; margin: 0px; border-style: none; cursor: default;">
<="" div="" style="padding: 0px; margin: 0px; border-style: none; cursor: default;">


