
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Тема 1. Физика и химия стекла.Стр 1 из 4Следующая ⇒
Тема 1. Физика и химия стекла. Получение стекла. Стекло – продукт совместного плавления нескольких минеральных веществ. Химически может быть отнесено к классу силикатов, т.е. солей кремниевой кислоты H2SiO3, кислоты, химически очень слабой, почти нерастворимой в воде, но образующей в воде коллоидный раствор, который осаждается в виде бесцветного студня и которому соответствует общая химическая формула: m SiO 2 · nH 2 O Значения m и n зависят от условий осаждения. Одним из известных производных кремниевой кислоты являются соли натрия или калия – силикаты. Носят соли техническое название жидкое (растворимое) стекло. Значению m>1 соответствуют различные поликремниевые кислоты, производными которых могут считаться многие минералы: асбест (3MgO·2H2O·2SiO2), полевые шпаты: ортоклаз(K2O· Al2O3· SiO), альбит(Na2O·Al2O3· SiO2), анорит (CaO· Al2O3· SiO2). Al2O3· SiO2 – алюмосиликаты Al2Be3[Si6O18]- берилл. Его разновидности: изумруд (окислы хлора), аквамарин (окислы железа). Топаз – фторалюминиевый силикат. Гранат – силикаты и алюмосиликаты с примесями магния, железа, марганца, кальция, хрома – окраска желтая, красная, розовая, черная, зеленая и т.д. Большие прозрачные, бесцветные кристаллы SiO2 – кварц – в природе называется горным хрусталем, фиолетовый – аметист. Основным химическим элементом, связывающим минералы является кремний – 3-й после водорода и кислорода по растворимости на Земле. Основную часть массы твердой земной коры составляют силикатные породы, наиболее насыщенные кремнием породы – это двуокись кремния – песок. Из получаемых искусственным путем, нерастворимых в воде силикатов является стекло. Формула стекла в общем виде: xR 2 O · yRO · zRO 2 Где R2O – окислы щелочных металлов (Na2O, K2O, Li2O….) RO – окислы щелочно-земельных и тяжелых металлов, а также окислы, обуславливающие окраску (CaO, MgO, BaO, PbO, ZnO, MnO, FeO, CrO) RO2 – кислотные окислы (SiO2, Al2O3, B2O3, P2O5) неметаллов. Наиболее распространенным типом стекла является система из 3 дешевых и доступных окислов: Na2O, CaO, SiO2. Получается из соды Na2CO3, мела CaCO3 и песка SiO2. Стехиометрический состав стекла приблизительно равен: Na 2 O · CaO ·6 SiO 2 В зависимости от основных стеклообразующих компонентов различают: 1. Оксидные стекла: - силикатные (SiO2) - алюмосиликатные (Al2O3· SiO2)
- боросиликатные (B2O3· SiO2) - бороалюмосиликатные (B2O3· Al2O3· SiO2) - алюмофосфатные (Al2O3·P2O5) - алюмоборофосфатные (Al2O3·B2O3· P2O5) 2. Халькогенидные стекла (6 группа, исключая кислород) – на основе серы, селена, телура; мышьяк, сурьма, таллий. Пр: As2S3, As2Se3, As2Te3, Tl2Te3, Sb2S3 3. Галогенидные стекла: - фторберилатные (BeF2) - LiF - KBr -CaF2 -NaCl Используются галогенидные стекла в оптических системах ИК-спектрометров, т.к. они пропускают ИК лучи. Оксидные стекла С химической точки зрения стекло практически инертно, что определяет его использование в качестве материала химической, лабораторной посуды, химические препараты в стеклянной таре, элементов химико-технологической аппаратуры. Однако по эффективности кародирующего действия на стекло химические элементы располагаются в ряд: плавиковая кислота (HF), фосфорная кислота (H3PO4), растворы щелочей (при длительном контакте), растворы щелочных карбонатов, кислота и вода. Свойства стекла зависят от характера и количественного соотношения образующих окислов: - кислотные окислы сообщают стеклу термическую, химическую, механическую стойкость и прочность. - щелочные окислы понижают вязкость и температуру размягчения, ухудшают твердость и химическую стойкость. - окислы щелочно-земельных металлов повышают химическую стойкость, обеспечивают требуемую вязкость. - введение некоторых окислов обеспечивает стеклу ряд специфических свойств. Введение CdO придает стеклу способность задерживать электроны; PbO – способность поглощения рентгеновского излучения; VO- придает способность поглощать УФ излучение; присутствие ионов редко-земельных элементов и урана придает стеклу способность к люминесценции; добавка Nd к системе BaO· K2O· SiO2 позволяет получать материал для изготовления лазеров. Повышенной пропускаемостью в УФ и ИК областях обладает кварцевое стекло (почти чистый SiO2) Обычно стекло – прозрачный бесцветный материал, но посредством добавок окислов можно изменять его цвет: - окислы Co – синий цвет - Cr2O3 – изумрудно – зеленый - окислы Mn –фиолетовый - Cr, Ni, Fe, Ce – желтый - Co, Mn, Er – розовый - CdS, CdSe –красно-рубиновый - MnO обесцвечивает стекло за счет образования 3-валентных силикатов железа, марганца, окрашенных в дополнительные цвета: желтый и фиолетовый.
Окрашивание можно производить посредством диспергирования в расплаве, т.е. коллоидным распределением красящего вещества ряда металлов: Ag – желтое, Au, Cu – красно-рубиновый, Se – розовый. Физически стекло – аморфный материал, который после охлаждения расплава приобретает свойства твердого хрупкого тела. При застывании стекломасса переходит в особое состояние аморфного материала, который называется стеклообразным. Это состояние термодинамически неравновесное, метастабильное, склонное к кристаллизации. При переходе вещества от жидкого к кристаллическому состоянию, элементы будущей кристаллической структуры располагаются упорядоченно, обеспечивая ближний и дальний порядок такой структуры. Фазовый переход 1 рода сопровождается выделением тепла кристаллизации, т.е. избытка энергии расплава над энергией твердого кристаллического состояния и характеризующийся четкой температурой плавления, кристаллизации. Но при охлаждении стекломассы, вязкость её прогрессивно возрастает от 102 до 1013 пуаз, что позволяет элементам пространственной решетки расположиться строго упорядоченно (ионы металлов и кислорода), а т.к. нет строго закономерного повторения структурных свойств элементов, то отдельные её связи характеризуются неодинаковой прочностью. Поэтому стекло в противоположность кристаллическим структурам не обладает определенной температурой плавления, а в процессе нагревания размягчается постепенно, приобретая пластичные свойства и способность смешиваться с другим размягченным массивом. Эта способность расплава стекла используется при изготовлении дутых изделий, изделия такой сложной формы как химическая или физическая посуда. Физические свойства стекла зависят от химического состава и структуры, которая формировалась в процессе стеклования. Этот процесс зависит от температурного и временного режима остывания. Стекла различного состава и назначения характеризуются: 1. Плотностью (2,2÷8,0 г/мл), (Плотность - физическая величина, определяемая для однородного вещества его массой в единице объёма. Плотность неоднородного вещества — предел отношения массы к объёму, когда объём стягивается к точке, в которой определяется плотность). 2. Термический коэффициент расширения ((0,56÷12) 10-6°С), (термическим коэффициентом расширения называют число, выражающее относительное изменение объема твердого тела, произошедшее в результате его нагревания или охлаждения). 3. Удельная электропроводность (1/сопротивление) (10-7÷101(Ом·см)-1) 4. Диэлектрическая проницаемость (3,8÷16) – характеризует во сколько раз напряженность электрического поля будет меньше, чем в вакууме. Стекло, часто используемое как оптический материал характеризуется показателем преломления, дисперсией (т.к. показатель преломления зависит от длины волны), а также стекло обладает люминесцентными свойствами. (Показатель преломления - отношение скорости света в вакууме к скорости света в среде (абсолютный показатель преломления). Относительный показатель преломления 2 сред - отношение скорости света в среде, из которой свет падает на границу раздела, к скорости света по второй среде. Показатель преломления равен отношению синуса угла падения лучей к синусу угла преломления (см. Преломление света). Зависит от длины волны света и свойств среды. Дисперсия света- зависимость показателя преломления n вещества от частоты n (длины волны l) света или зависимость фазовой скорости световых волн от частоты).
Предварительное исследование объектов из стекла. В ходе предварительного исследования фрагментов стеклянных изделий, основной задачей является информация диагностического характера об искомом объекте. Второй задачей (дополнительной) является установление причины и механизма разрушения стекла. Чаще всего задачи решаются посредством выявления морфологических признаков фрагментов стеклянных изделий с использованием органолептических методов (которые можно выявить с помощью органов чувств), а также измерительных и микроскопических, не требуемых значительных временных затрат и сложной приборной базы. Исследование позволяет ориентировочно установить родовую принадлежность соответствующего осколка стеклянного изделия. Показатель преломления. Определение показателя преломления: основными константами характеризующими плотность стекла является показатель преломления, дисперсия, угол полного внутреннего отражения, коэффициент поглощения и пропускания, оптическая плотность. (Доля света, которая проходит сквозь материал, характеризуется коэффициентом пропускания, а доля, которая поглощается — коэффициентом поглощения. Оптическая плотность D- мера непрозрачности слоя вещества для световых лучей. Равна десятичному логарифму отношения потока излучения F0, падающего на слой, к ослабленному в результате поглощения и рассеяния потоку F, прошедшему через этот слой: D = lg (F0/F),). Закон Бугера –Ламберта- Бэра: Если мощность пучка, вошедшего в слой вещества толщиной l, равна Io, то, согласно Б.—Л.—Б. з., мощность пучка при выходе из слоя I = I 0 e- ccl, где c — удельный показатель поглощения света, рассчитанный на единицу концентрации с вещества, определяющего поглощение; c зависит от природы и состояния вещества и от длины волны проходящего излучения В экспертной практике используются измерения показателя преломления. Показатель преломления обозначается nd20. 20 – температура, при которой измеряется показатель, D –желтая линия натрия.
Значение nd20 не зависит от внешних условий. При измерении не происходит уничтожение или видоизменение объекта, поэтому показатель преломления является устойчивым признаком, которого бывает достаточно при проведении исследования. Для определения показателя преломления используются рефрактометры, но применение для экспертиз ограничено необходимостью наличия у исследуемого объекта двух плоскопараллельных гладких поверхностей. Образец должен иметь форму прямоугольного параллелепипеда с размерами 20×20×10 мм с полированными и взаимно перпендикулярными гранями. Лекции Асташовой Елены, СЭ-081. Тема 1. Физика и химия стекла. Получение стекла. Стекло – продукт совместного плавления нескольких минеральных веществ. Химически может быть отнесено к классу силикатов, т.е. солей кремниевой кислоты H2SiO3, кислоты, химически очень слабой, почти нерастворимой в воде, но образующей в воде коллоидный раствор, который осаждается в виде бесцветного студня и которому соответствует общая химическая формула: m SiO 2 · nH 2 O Значения m и n зависят от условий осаждения. Одним из известных производных кремниевой кислоты являются соли натрия или калия – силикаты. Носят соли техническое название жидкое (растворимое) стекло. Значению m>1 соответствуют различные поликремниевые кислоты, производными которых могут считаться многие минералы: асбест (3MgO·2H2O·2SiO2), полевые шпаты: ортоклаз(K2O· Al2O3· SiO), альбит(Na2O·Al2O3· SiO2), анорит (CaO· Al2O3· SiO2). Al2O3· SiO2 – алюмосиликаты Al2Be3[Si6O18]- берилл. Его разновидности: изумруд (окислы хлора), аквамарин (окислы железа). Топаз – фторалюминиевый силикат. Гранат – силикаты и алюмосиликаты с примесями магния, железа, марганца, кальция, хрома – окраска желтая, красная, розовая, черная, зеленая и т.д. Большие прозрачные, бесцветные кристаллы SiO2 – кварц – в природе называется горным хрусталем, фиолетовый – аметист. Основным химическим элементом, связывающим минералы является кремний – 3-й после водорода и кислорода по растворимости на Земле. Основную часть массы твердой земной коры составляют силикатные породы, наиболее насыщенные кремнием породы – это двуокись кремния – песок. Из получаемых искусственным путем, нерастворимых в воде силикатов является стекло. Формула стекла в общем виде: xR 2 O · yRO · zRO 2 Где R2O – окислы щелочных металлов (Na2O, K2O, Li2O….) RO – окислы щелочно-земельных и тяжелых металлов, а также окислы, обуславливающие окраску (CaO, MgO, BaO, PbO, ZnO, MnO, FeO, CrO) RO2 – кислотные окислы (SiO2, Al2O3, B2O3, P2O5) неметаллов. Наиболее распространенным типом стекла является система из 3 дешевых и доступных окислов: Na2O, CaO, SiO2. Получается из соды Na2CO3, мела CaCO3 и песка SiO2. Стехиометрический состав стекла приблизительно равен: Na 2 O · CaO ·6 SiO 2
В зависимости от основных стеклообразующих компонентов различают: 1. Оксидные стекла: - силикатные (SiO2) - алюмосиликатные (Al2O3· SiO2) - боросиликатные (B2O3· SiO2) - бороалюмосиликатные (B2O3· Al2O3· SiO2) - алюмофосфатные (Al2O3·P2O5) - алюмоборофосфатные (Al2O3·B2O3· P2O5) 2. Халькогенидные стекла (6 группа, исключая кислород) – на основе серы, селена, телура; мышьяк, сурьма, таллий. Пр: As2S3, As2Se3, As2Te3, Tl2Te3, Sb2S3 3. Галогенидные стекла: - фторберилатные (BeF2) - LiF - KBr -CaF2 -NaCl Используются галогенидные стекла в оптических системах ИК-спектрометров, т.к. они пропускают ИК лучи. Оксидные стекла С химической точки зрения стекло практически инертно, что определяет его использование в качестве материала химической, лабораторной посуды, химические препараты в стеклянной таре, элементов химико-технологической аппаратуры. Однако по эффективности кародирующего действия на стекло химические элементы располагаются в ряд: плавиковая кислота (HF), фосфорная кислота (H3PO4), растворы щелочей (при длительном контакте), растворы щелочных карбонатов, кислота и вода. Свойства стекла зависят от характера и количественного соотношения образующих окислов: - кислотные окислы сообщают стеклу термическую, химическую, механическую стойкость и прочность. - щелочные окислы понижают вязкость и температуру размягчения, ухудшают твердость и химическую стойкость. - окислы щелочно-земельных металлов повышают химическую стойкость, обеспечивают требуемую вязкость. - введение некоторых окислов обеспечивает стеклу ряд специфических свойств. Введение CdO придает стеклу способность задерживать электроны; PbO – способность поглощения рентгеновского излучения; VO- придает способность поглощать УФ излучение; присутствие ионов редко-земельных элементов и урана придает стеклу способность к люминесценции; добавка Nd к системе BaO· K2O· SiO2 позволяет получать материал для изготовления лазеров. Повышенной пропускаемостью в УФ и ИК областях обладает кварцевое стекло (почти чистый SiO2) Обычно стекло – прозрачный бесцветный материал, но посредством добавок окислов можно изменять его цвет: - окислы Co – синий цвет - Cr2O3 – изумрудно – зеленый - окислы Mn –фиолетовый - Cr, Ni, Fe, Ce – желтый - Co, Mn, Er – розовый - CdS, CdSe –красно-рубиновый - MnO обесцвечивает стекло за счет образования 3-валентных силикатов железа, марганца, окрашенных в дополнительные цвета: желтый и фиолетовый. Окрашивание можно производить посредством диспергирования в расплаве, т.е. коллоидным распределением красящего вещества ряда металлов: Ag – желтое, Au, Cu – красно-рубиновый, Se – розовый. Физически стекло – аморфный материал, который после охлаждения расплава приобретает свойства твердого хрупкого тела. При застывании стекломасса переходит в особое состояние аморфного материала, который называется стеклообразным. Это состояние термодинамически неравновесное, метастабильное, склонное к кристаллизации. При переходе вещества от жидкого к кристаллическому состоянию, элементы будущей кристаллической структуры располагаются упорядоченно, обеспечивая ближний и дальний порядок такой структуры. Фазовый переход 1 рода сопровождается выделением тепла кристаллизации, т.е. избытка энергии расплава над энергией твердого кристаллического состояния и характеризующийся четкой температурой плавления, кристаллизации. Но при охлаждении стекломассы, вязкость её прогрессивно возрастает от 102 до 1013 пуаз, что позволяет элементам пространственной решетки расположиться строго упорядоченно (ионы металлов и кислорода), а т.к. нет строго закономерного повторения структурных свойств элементов, то отдельные её связи характеризуются неодинаковой прочностью. Поэтому стекло в противоположность кристаллическим структурам не обладает определенной температурой плавления, а в процессе нагревания размягчается постепенно, приобретая пластичные свойства и способность смешиваться с другим размягченным массивом. Эта способность расплава стекла используется при изготовлении дутых изделий, изделия такой сложной формы как химическая или физическая посуда. Физические свойства стекла зависят от химического состава и структуры, которая формировалась в процессе стеклования. Этот процесс зависит от температурного и временного режима остывания. Стекла различного состава и назначения характеризуются: 1. Плотностью (2,2÷8,0 г/мл), (Плотность - физическая величина, определяемая для однородного вещества его массой в единице объёма. Плотность неоднородного вещества — предел отношения массы к объёму, когда объём стягивается к точке, в которой определяется плотность). 2. Термический коэффициент расширения ((0,56÷12) 10-6°С), (термическим коэффициентом расширения называют число, выражающее относительное изменение объема твердого тела, произошедшее в результате его нагревания или охлаждения). 3. Удельная электропроводность (1/сопротивление) (10-7÷101(Ом·см)-1) 4. Диэлектрическая проницаемость (3,8÷16) – характеризует во сколько раз напряженность электрического поля будет меньше, чем в вакууме. Стекло, часто используемое как оптический материал характеризуется показателем преломления, дисперсией (т.к. показатель преломления зависит от длины волны), а также стекло обладает люминесцентными свойствами. (Показатель преломления - отношение скорости света в вакууме к скорости света в среде (абсолютный показатель преломления). Относительный показатель преломления 2 сред - отношение скорости света в среде, из которой свет падает на границу раздела, к скорости света по второй среде. Показатель преломления равен отношению синуса угла падения лучей к синусу угла преломления (см. Преломление света). Зависит от длины волны света и свойств среды. Дисперсия света- зависимость показателя преломления n вещества от частоты n (длины волны l) света или зависимость фазовой скорости световых волн от частоты).
|
|||||||||
|
Последнее изменение этой страницы: 2020-12-09; просмотров: 347; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.224.184.149 (0.065 с.) |

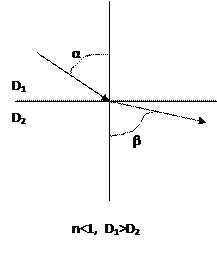
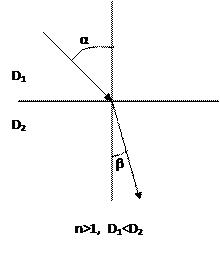 nd20 характеризуется отношением скорости распространения света в вакууме (для практических целей в воздухе) к скорости распространения в исследуемом объекте. Определяется как синус угла падения α к синусу угла преломления β луча в материале.
nd20 характеризуется отношением скорости распространения света в вакууме (для практических целей в воздухе) к скорости распространения в исследуемом объекте. Определяется как синус угла падения α к синусу угла преломления β луча в материале.


