
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Тема «Определение теплового эффекта реакции нейтрализации»
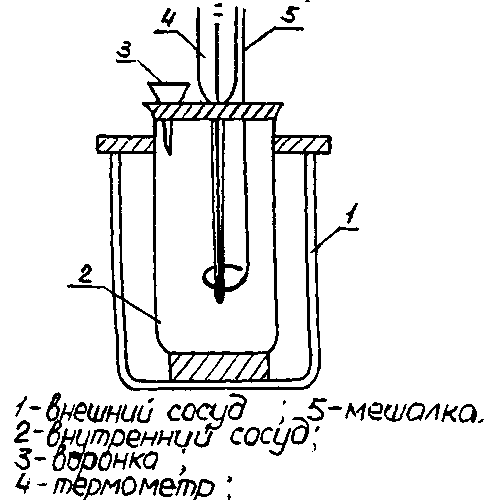
Цель работы – освоить методику калориметрических измерений и методику экспериментального определения теплового эффекта реакции нейтрализации сильной кислоты сильным основанием, овладеть навыками осуществления термохимических расчетов. Приборы и посуда: жидкостный калориметр, весы с разновесами; термометр на 100 °С; штатив с пробирками; мерные цилиндры емкостью 50 мл; химические стаканы емкостью 100 мл (2 шт.); пипетка; шпатель. Реактивы: серная кислота H2SO4 (1,0 М раствор); 2) гидроксид натрия NaОН (2,0 М раствор). Выполнение работы: Определение теплового эффекта реакции производят в пробирках называемых калориметрами. Простейший из них изображен на рисунке. Серную кислоту можно нейтрализовать двумя способами. Первый способ – это последовательная нейтрализация в две стадии:
H2SO4 + NaOH=NaHSO4 + H2O, ∆H1;
NaHSO4 + NaOH =NaSO4 + H2O, ∆H2.
Второй способ – полная нейтрализация в одну стадию: H2SO4+2NaOH=Na2SO4 +2H2O, ∆H3
Опыт 1. нейтрализация серной кислоты в две стадии.
В калориметрический стакан влить 50 см3 1,0 М раствора серной кислоты. Измерить температуру (t1). В два стакана отмерить по 25см3 2,0 М раствора щелочи NaOH. В раствор кислоты быстро и без потерь вылить из 1-го стакана щелочь. Перемешать путем встряхивания полученный раствор кислой соли NaHSO4 и быстро измерить максимальную температуру (t2). К полученному раствору кислой соли NaHSO4 быстро прилить раствор щелочи из второго стакана и после перемешивания измерить максимальную температуру (t3) раствора средней соли Na2SO4. Результаты опыта записать в таблицу.
Опыт 2. Нейтрализация серной кислоты в одну стадию.
В калориметрический стакан влить 50 см3 1М раствора серной кислоты. Измерить температуру (t1). В раствор серной кислоты влить 50 см3 2М раствора щелочи. Перемешать раствор, измерить максимальную температуру (t2). Результаты опыта записать в таблицу.
Таблица.
Обработка результатов Теплота, выделяющаяся в результате реакции нейтрализации, вычисляется по формуле:
Q=V*d*C*∆t*20*0,001 ккал Где: Q – теплота кДж; V – общий объем раствора в калориметре, см3; d – плотность раствора в калориметре, г/см3; C – удельная теплоемкость раствора, кДж/моль; ∆t – разность температур до и после реакции; Задание 1. Рассчитать тепловой эффект первой и второй стадии реакции нейтрализации в первом опыте. 2. Рассчитать тепловой эффект реакции нейтрализации во втором опыте. 3. На основании следствия из закона Гесса рассчитать теоретический тепловой эффект реакции нейтрализации серной кислоты щелочью, если известны теплоты образования продуктов реакции и исходных веществ:
4. Сравнить тепловой эффект реакции нейтрализации во втором опыте с теоретическим тепловым эффектом. 5. сравнить суммарный тепловой эффект реакции нейтрализации в первом опыте с тепловым эффектом во втором опыте и сделать вывод о выполнении закона Гесса. Контрольные вопросы: 1. Как изменяется энтальпия системы, если реакция идет с поглощением тепла? 2. Вычислить тепловой эффект реакции NaH(k)+H2O(ж)=NaOH(р)+H2(г) по стандартным энтальпиям образования веществ, участвующих в реакции, если 3. Определить знак изменения энтропии в следующих реакциях: 4NH3+ЗО2=6Н2О(ж)+2N2 СН4(Ж)+4CI2=CCI4(ж)+4HCI СО+ЗН2=СH4+Н2О(ж) 4. В каком направлении нижеприведенная реакция будет протекать самопроизвольно? N2+2H2O=NH4NO2, если ∆ G 0 298 (NH4NO2)=l 15,94кДж/моль, ∆ G 0 298 (H2O(г))= -228,8кДж/моль.
|
|||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2020-11-28; просмотров: 442; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.226.4.239 (0.016 с.) |
||||||||||||||||||||||||||||||||||||||||||||||||||
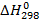 (NaH(k))=-56,94 кДж/моль,
(NaH(k))=-56,94 кДж/моль, 


