
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Влияние температуры на проницаемость клеточных мембран для бетацианина⇐ ПредыдущаяСтр 19 из 19
Бетацианин - пигмент столовой свеклы - относительно большая, хорошо растворимая в воде молекула, находящаяся в клеточном соке. Чтобы попасть во внешнюю среду, молекула бетацианина должна пройти через тонопласт, основной цитоплазматический матрикс и плазмалемму. Диффузия бетацианина из вакуоли в среду может проходить достаточно быстро при действии различных факторов или агентов, вызывающих изменение проницаемости мембраны. Измеряя оптическую плотность инкубационной среды через определенный промежуток времени, можно оценить степень воздействия данного фактора на проницаемость мембран. Цель работы состоит в определении влияния температуры на проницаемость мембран для бетацианина по выходу его в различные инкубационные среды. Цель работы. Определение защитного действия раствора сахарозы на устойчивость клеток растений к повреждению холодом Объект исследования. Корень столовой свеклы (Beta vulgaris)
Материалы и оборудование. 0,5 М водный раствор сахарозы; сверло (пробковое) диаметром 5 мм; лезвие, линейка; воронка Бюхнера; пробирки; пипетки; термостаты с температурой 35 и 45°С, ФЭК.
Порядок работы. 1. Пробковым сверлом вырезать столбики ткани диаметром 5 мм. 2. Лезвием по линейке разрезать их на диски толщиной 1 мм каждый. 3. 60 дисков одинаковых по цвету в течение 15-20 мин промыть водопроводной водой на воронке Бюхнера. 4. В три пробирки налить по 10 мл воды, в три другие - по 10 мл сахарозы. 5. В каждую пробирку поместить по десять дисков. 6. По две пробирки (одна с водой, другая с сахарозой) оставить при комнатной температуре, две другие поставить в водяную баню с температурой 35°С (отметить время), две оставшиеся пробирки (с водой и сахарозой) поместить в водяную баню при 45° С (также отметить время). 7. В течение 1 ч через каждые 10-15 мин в пробирках измерять выход бетацианина в раствор: из пробирки пипеткой отливать раствор в чистую пробирку и после измерения оптической плотности (на ФЭКе с зеленым светофильтром (кюветы 0,5 см) или на спектрофотометре λ=535 нм) выливать раствор в ту же опытную пробирку, стараясь не терять жидкость. 8. Построить график зависимости оптической плотности раствора от времени. 9. Сделать вывод.
Работа 30
Вязкость протоплазмы в связи с определением жаростойкости (по П. А. Генкелю)
Вязкость протоплазмы — свойство коллоидов клетки, тесно связанные с засухоустойчивостью и жаростойкостью растений. Работами П. А. Генкеля установлено, что вязкость протоплазмы пропорциональна степени жароустойчивости растения. Суккуленты, имеющие большую вязкость плазмы, отличаются большей жаростойкостью по сравнению с мезофитами. Вязкость протоплазмы у суккулента выше, чем у мезофита и, следовательно, выпуклый плазмолиз в его клетках появляется позже, чем у мезофитов (у 1-го через 3—8 час, у 2-го через 20—40 мин.). Конечно, жаростойкость не может быть объяснена только степенью вязкости протоплазмы, но данное свойство может служить диагностическим признаком при характеристике видов и сортов растений.
Цель работы. Определение вязкости цитоплазмы у растений разных экологических групп
Объект исследования. Растение – мезофит, растение - суккулент
Материалы и оборудование. Растворы сахарозы: 1; 0,9; 0,8; 0,7; 0,6; 0,5 0,4; 0,3, 0,2; 0,1 М, раствор нейтрального красного в концентрации 1:10 000, вазелин. стаканчик с холодной водой. стаканчик с горячей водой. кисточка. предметные и покровные стекла. бритва. скальпель. препаровальные иглы, центрифуга, центрифужные пробирки, пипетки.
Порядок работы. 1. Сделать тонкий поперечный срез листа суккулента (алоэ), также приготовить препарат эпидермиса листа мезофита (можно взять эпидермис с чешуй лука). 2. Окрасить препараты в чашке Петри в растворе нейтрального красного (если содержимое клеток объекта плохо видно без окраски) в течение не более 10 мин. 3. Перенести препараты в другую чашку с чистой водой. 4. Поместить объект на предметное стекло в каплю сахарозы (1 М), закрыть покровным стеклом. 5. Края покровного стекла герметизировать вазелином, чтобы избежать испарения воды и, следовательно, повышения концентрации раствора. Препараты тканей суккулента и мезофита можно поместить под одно покровное стекло. 6. Наблюдать за объектом под микроскопом. Сначала в клетках отмечается вогнутый плазмолиз, постепенно переходящий в выпуклый. Время, в течение которого вогнутый плазмолиз перейдет в выпуклый, является показателем степени вязкости протоплазмы»
7. Сравнить объекты по времени наступления плазмолиза. 8. Представить результаты работы в виде таблицы (составить самостоятельно). 9. Сделать выводы.
Работа 31 Характеристика активности процессов перекисного окисления липидов по образованию малонового диальдегида в растительных тканях
Окислительные процессы в живых организмах в ряде случаев происходят при участии свободных радикалов. Индуцирование этих процессов часто обусловлено кислородными радикалами: супероксидным анион-радикалом Ог, гидроперекисным радикалом НО2, гидроксильным радикалом ОН, стабильным продуктом восстановления кислорода - пероксидом водорода Н2О2, а также синглетным кислородом. Возникновение этих активных форм кислорода связано как с процессами, происходящими в клетке в норме (например, в световых реакциях при фотосинтезе), так и в ответ на стрессовые воздействия (водный дефицит, загрязнение среды, низкие температуры, действие гербицидов и т. д.). Изменение активности процессов генерации активных форм кислорода наблюдается и в онтогенезе растений. Процессы перекисного окисления липидов с участием форм активированного кислорода приводят к разрушению полиненасыщенных жирных кислот и обеднению клетки содержащими их полярными и ненасыщенными жирными кислотами, появлению гидропероксидных группировок в составе гидрофобной зоны мембран. Это изменяет физико-химические свойства мембран: текучесть, способность к латеральной диффузии, что приводит к отклонению в функционировании мембранно-связанных ферментов, увеличивает проницаемость мембран для многих веществ и ионов. Кроме того, липидные пероксиды вызывают разрушения многих физиологически важных соединений, таких, как сульфгидрильные соединения, гормоны, стероиды и др. Продукты перекисного окисления липидов способны ингибировать репликацию ДНК и белковый синтез. Возможно появление внутри- и межмолекулярных ошибок в результате свободнорадикальной полимеризации и поликонденсации с некоторыми продуктами перекисного окисления липидов, например с малоновым диальдегидом. Малоновый диальдегид (МДА) — продукт перекисного окисления липидов. Этот бифункциональный альдегид способен образовывать шиффовы основания с аминогруппами белка, выступая в качестве сшивающего агента. В результате образуются нерастворимые белок-липидные комплексы, называемые пигментами изнашивания или липофусцинами: В ответ на различные стрессовые воздействия в тканях растения происходит увеличение содержания МДА, что связано с активацией в этих условиях свободнорадикальных реакций в клетках. Таким образом, содержание МДА может служить показателем активности окислительных процессов, обусловленных кислородными радикалами. Определение содержания МДА в растительных тканях основано на его реакции с 2-тиобарбитуровой кислотой (ТБК), в результате чего образуется окрашенный продукт с максимумом поглощения при 532 нм.
Цель работы. Исследовать влияние условий выращивания растений на содержание МДА в растительных тканях. Определить изменение содержания МДА в зависимости от возраста растений.
Объекты исследования. Листья проростков пшеницы, выращенных при различных условиях водоснабжения; листья гороха разного возраста. Материалы и оборудование. 20%-й раствор ТХУ (ТБК-); 0,5%-й раствор ТБК в 20%-м растворе ТХУ (ТБК+); 10%-й раствор бутилгидрокситолуола (BHT) в этиловом спирте, 80%-ый этиловый спирт, фарфоровые ступки с пестиком; мерные пробирки объемом 5 мл с притерными пробками; лабораторные пробирки; пипетки объемом 2 и 5 мл; водяная баня; весы аналитические; центрифуга; спектрофотометр.
Порядок работы. 1. Растереть на льду 50 мг листьев или корней в 1 мл 80%-го этанола, используя предварительно охлажденные до 4°С фарфоровые ступку и пестик. Количественно перенести гомогенат в 1,5-мл пробирку типа “Эппендорф”. Промыть ступку и пестик 0,5 мл этанола. Объединить растворы. 2. Центрифугировать при 13,5 тыс/об. × мин 10 мин при температуре 4°С 3. Поместить по 400 мкл полученного супернатанта в две 1,5-мл пластиковые пробирки с завинчивающейся крышкой или стеклянные пробирки со шлифом. 4. Добавить 380 мкл ТБК- раствора в первую пробирку и 380 мкл ТБК+ раствора – во вторую. Добавить 20 мкл раствора бутилгидрокситолуола в каждую пробирку. 5. В вытяжном шкафу интенсивно перемешать содержимое пробирок, нагревать при 95°С в термостате или на водяной бане в течение 25 мин. Пробирки закрыть пробкой для предотвращения выкипания растворов! 6. Быстро охладить пробирки на льду 7. Центрифугировать при 13,5 тыс/об. × мин в течение 10 мин. 8. Измерить оптическую плотность полученного супернатанта при 440, 532, и 600 нм 9. Рассчитать содержание эквивалентов МДА (нМ/мл) по следующим формулам:
Amax= 532 нм ε = 157000
MДA (нм/мл) = (A - B/157000) 106
A = [(A532 +ТБК) - (A600 +ТБК) - (A532 - ТБК - A600 - ТБК)]
B = [(A440 + ТБК - A600 + ТБК) 0.0571]
(A532 - ТБК - A600 - ТБК) = Поправка на содержание антоцианинов
(A600 + ТБК) = Поправка на неспецифические соединения
[(A440 +ТБК - A600 +ТБК) 0.0571] = Поправка на сахара
10. Представить результаты работы в виде таблицы (составить самостоятельно). 11. Сделать выводы по результатам работы.
Литература 1. Баславская С.С., Трубецкова О.М. Практикум по физиологии растений.- М.: Изд-во МГУ, 1964. – 328 с. 2. Малый практикум по физиологии растений: Учеб. пособие.- 9-е изд./ Под ред. Мокроносова А.Т. М.: Изд-во МГУ, 1994. – 184 с. 3. Практикум по физиологии растений / Третьяков Н.Н. и др. – 4-е изд. – М.: КолосС, 2003. – 288 с.
4. Сказкин Ф.Д., Ловчиновская Е.И., Миллер М.С., Аникиев В.В. Практикум по физиологии растений. – 5-е изд. – М.: Изд-во «Советская наука», 1958. – 339 с. 5. Taylor N. L., Millar A. H. Oxidative Stress and Plant Mitochondria. Methods in Molecular Biology. 2007. Vol. 372. pp. 389-403
Содержание
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2020-11-23; просмотров: 325; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.136.26.20 (0.033 с.) |
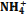 и
и 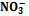 из питательного раствора
из питательного раствора



