
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Характер и причины изменений белков кровиСтр 1 из 4Следующая ⇒
Белки крови. Ферменты. Диагностическое значение
ВВЕДЕНИЕ
Белки присутствуют во всех тканях и биологических жидкостях организма. Практически все физиологические и патологические реакции в живых системах протекают при непосредственном участии белков. Количественный и качественный состав белков крови достаточно полно отражает состояние белкового обмена организма в целом, поэтому белки крови широко используются для диагностических целей. По современным представлениям, плазма крови содержит до 300 различных белков, которые можно разделить на две основные группы: альбумины и глобулины. Соотношение между этими группами белков, а также количественные и качественные изменения индивидуальных белков внутри указанных групп имеют место при многих физиологических и патологических состояниях. По выполняемой ими функции белки крови можно разделить на основные группы: - транспортные / трансферрин, тироксин-связывающий белок/ - белки острой фазы / фибриноген, С-реактивный белок и др./ - комплемент / СЗ и С4 компоненты/ - факторы свертывания / фибриноген, протромбин, фактор УШ/ - ферменты / амилаза, и др./ - ингибиторы протеиназ / α1-антитрипсин, антитромбин/ - белковые гормоны / инсулин, глюкагон, вазопрессин/ - иммуноглобулины / IgG и др./ - поддерживающие онкотическое давление /все, особенно альбумин - поддерживающие буферную емкость / все белки / Физиологическая функция белков плазмы состоит в поддержании коллоидно-осмотического давления, кислотно-основного состояния, в процессах катализа; транспорте гормонов, липидов, жирных кислот, жирорастворимых витаминов, пигментов, минеральных веществ. Они - носители природного и приобретенного иммунитета. Белки плазмы крови - неотъемлемые компоненты свертывающей и противосвертывающей системы.
ЭЛЕКТРОФОРЕЗ БЕЛКОВ
Для анализа белков крови наиболее информативным является метод электрофореза. Белки; находящиеся в растворе имеют определенный электрический заряд, величина которого зависит от структуры молекулы белка и определяется наличием амино- и карбоксильных групп на поверхности молекулы. В электрическом поле под действием электрического тока молекулы движутся к полюсам. Изоэлектрическая точка большинства белков плазмы находится в диапазоне кислых значений рН и при электрофорезе в щелочном буфере они движутся к аноду. Распределенные таким образом по величине заряда и молекулярной массе белки могут быть зафиксированы и оценены количественно и качественно.
В настоящее время известно несколько методических модификаций метода электрофореза белков и в частности, белков крови В практике клинико-диагностических лабораторий наиболее часто используют электрофорез белков крови на ацетатцеллюлозной пленке, позволяющий получить 5 основных фракций: одну фракцию альбумина и 4 фракции глобулинов. В щелочной среде в электрическом поле наиболее быстро перемещается альбумин затем α1, α2, β и γ глобулины. Для работы может быть использовано типовое оборудование для биохимической лаборатории. Для анализа берут свежую не гемолизированную сыворотку, полученную из взятой натощак крови. Сыворотку можно хранить не более 72 часов при температуре 2-8 С, предварительно определив общее содержание белка в образце биуретовым методом
ХОД ОПРЕДЕЛЕНИЯ
1. Смоченную в буфере пластину помещают в рамке в электрофоретическую камеру. Образцы наносят на поверхность пластинки с помощью апликатора (0.2-0.4мкл сыворотки крови на катодный край). 2. После нанесения образцов подключают электрический ток. Для пластинок АЦ толщиной около 120 мкм, применяется сила тока 0.5 мА на 10мм ширины пластины, при использовании более толстых пленок (250-300 мкм) – до 1.0 мА на 10 мм ширины пластинки. При высоком градиенте напряжения (30-40В/см), четкое разделение фракций может быть получено за 10-20 мин. 3. После отключения тока пластинку переносят в красящий раствор на 5 минут. Затем отмывают до отбеливания фона дважды по 3 минуты в 5-7% растворе уксусной кислоты, промывают в трех водах и подсушивают между листами фильтровальной бумаги. 4. Для определения количественных характеристик белков, высушенную пластинку сканируют на денситометре при длине волны: для пунцового С - 520-540 нм: для амидо-черного - 600 нм; для бромфенолового синего - 600 нм;
ФРАКЦИИ БЕЛКОВ, ПОЛУЧАЕМЫЕ ЭЛЕКТРОФОРЕЗОМ
Фракции глобулинов не являются гомогенными, в их составе разнообразные в функциональном отношении белки, которые в случае необходимости могут быть проанализированы отдельно. - 7 - Количественная характеристика этих фракций, процентное соотношение между ними достаточно стабильно при нормальном состоянии организма и определенное у здоровых доноров может быть взято за основу при анализе белкового состава крови при различных патологических состояниях. В практике здравоохранения белковый состав крови определяется как в плазме, так и в сыворотке. В сыворотке крови из-за отсутствия фибриногена содержание общего белка меньше примерно на 2.5 г/л., по сравнению с плазмой.Присутствие фибриногена в плазме часто приводит к образованию выраженной полосы в области бета-глобулинов что может быть расценено как прапротеинемия. Нормальные значения фракций как в абсолютном, так и в процентном выражении при анализе методом электрофореза зависят от типа носителя, на котором проводится разделение, применяемого красителя, типа аппаратуры. Исходя из этого, значения "нормы" при анализе белков крови методом электрофореза отрабатываются в каждой лаборатории и вносятся в собственный бланк. Как было сказано выше, с помощью электрофореза на ацетате целлюлозы получают 5 стандартных фракций: альбумин и четыре фракции глобулинов α1, α2, β и γ. В ряде случаев удается обнаружить преальбумин - белок с наибольшей подвижностью. α- фетапротеин при онкологических заболеваниях может увеличиваться в 100 раз по отношению к норме и проявляться отдельной полосой между альбумином и зоной α1-глобулинов. Парапротеины, как правило, движутся при электрофорезе отдельной полосой / градиент М /. Нормальные значения фракций белков в % при разделении на ацетате целлюлозы: альбумин - 48 - 61% α1 -глобулин 2,5 - 5,О% α2 - глобулин 8,0- 11,0% β - глобулин 11,0 - 15,0% γ - глобулин 16,0 - 25,0% Характер изменений основных фракций белков крови, их количественные и качественные характеристики позволяют дать общее заключение о наличии, интенсивности и степени выраженности патологического процесса. Альбумин. На его долю приходится до 65% всего белка сыворотки крови. Основные функции альбумина: связывание воды, обеспечивающее значительную долю онкотического давления /80 %/. Альбумин осуществляет транспорт ионов калия, магния, билирубина, свободных жирных кислот, лекарственных соединений, гормонов щитовидной железы. Он источник пластического материала. Гипоальбуминемия наблюдается вследствие потери альбумина при нефротическом синдроме, гастроэнтерите, кровотечении; при повышении катаболизма /травма, инфекции, сепсис, опухоли, гипертиреоз/; при понижении синтеза /цирроз и жировая дистрофия печени, недоедание/. При ожогах, токсикозах, асците, в постоперационном периоде. Гиперальбуминемия является результатом острого обезвоживания, приема анаболических стероидов. Нормальное содержание 37 - 55 г/л в сыворотке крови.Электрофоретическая подвижность альбумина меняется при его участии в комплексообразовании, особенно с лекарственными препаратами. Фракции α1, α2 - глобулинов содержат значительное количество индивидуальных белков, которые могут быть использованы для диагностики. При электрофорезе увеличение содержания фракций связано с развитием воспалительного процесса. Фракция α1 - глобулинов часто является мерилом интенсивности процесса воспаления. Количественные изменения этих фракций отражают нарушения равновесия синтез-распад: снижение содержания этих белков при электрофорезе связано с заболеваниями печени, приводящими к уменьшению синтетических процессов в органе, тяжелыми дистрофическими процессами, а возрастание содержания белков этой фракции – результат развития острых воспалительных процессов, обострения инфекционных процессов, наличия опухолевого роста. Увеличение α1 – глобулинов характерно для хронического гепатита, длительного лечения эстрогенами, беремености, а фракция α2 глобулинов – часто бывает увеличена за счет гаптоглобина.
Фракция β - глобулинов содержит значительное количество липопротеидов, белков, участвующих в обмене липидов и их транспорте. Нарушение нормального содержания белков этой фракции свидетельствует о нарушениях обмена липидов и часто изменения на электрофореграмме, отмечаемые для этой фракции белков, соответствуют изменениям фракций α -глобулинов. Возрастание уровня β- глобулинов, может быть при железодефицитой анемии, за счет увеличения трансферрина. Фракция γ - глобу линов представлена белками, обеспечивающими иммунитет организма.Эти белки синтезируются и секретируются В-лимфоцитами. В настоящее время известно 5 классов иммуноглобулинов (Ig)
Белковые фракции крови
. У детей с частыми инфекциями, бронхиальной астмой, хроническим обструктивным бронхитом и у взрослых в случаях неэффективности лечения противовоспалительными препаратами желательно проводить определение подклассов IgG. Их 4, они различаются по функции и по структуре тяжелых цепей. Заболевания, сопровождающиеся увеличением концентрации подклассов IgС: аллергия, астма, экзема, дерматит, рассеянный склероз; снижение концентрации: аутоиммунные заболевания /бронхиальная астма у детей, системная красная волчанка/, иммунодефициты /ВИЧ-инфекция, химиотерапия, высокие дозы кортикостероидов/; инфекции /средний отит, возвратные легочные инфекции, бронхэктазы/; другие заболевания (нефротический синдром, алкогольный цирроз печени, конечная стадия почечной недостаточности). Гипогаммаглобулинемия. Физиологическая встречается у новорожденных, патологическая - как у детей, так и у взрослых может быть как врожденной, так и приобретенной и сопровождается иммунодефицитом. Наиболее частая врожденная патология - избирательный дефицит IgА. Встречается у детей в конце первого года жизни, когда исчезает материнский иммунитет (пневмонии, синуситы, отиты, сепсис, понос, вирусный гепатит). Лабораторный признак - снижение СОЭ. Приобретенные нарушения иммунитета с уменьшением Ig могут возникать после потерь белка /обширные ожоги, заболевания почек/; тяжелых травм, серьезных оперативных вмешательств, злокачественных поражений лимфоплазмоцитарной системы /миелома, лимфолейкозы, миелолейкоз/, а также при СПИДе.
Гипергаммаглобулинемия - возможна при повышенном синтезе антител. В этом случае нарастает содержание всех классов Ig с преобладанием IgG. Ig увеличиваются при всех бактериальных инфекциях /стафило-, стрепто-, пневмококковых/, и сепсисе, рожистом воспалении, скарлатине, ангине, инфекционном мононуклеозе, хронических инфекциях, паразитарных заболеваниях /малярия, эхинококкоз печени, легких, токсоплазмоз, глистная инвазия/. Патологическое увеличение концентрации характерно для аутоиммунных заболеваний /ревматоидный артрит, системная красная волчанка/,и для хронических заболеваний печени, имеющих аутоиммунную природу /хронические гепатиты, циррозы/.
Активность ферментов. Каталитическая активность ферментов зависит от ряда показателей, одним из которых является количество и особенности субстрата. С этими параметрами связана как скорость образования фермент-субстратного комплекса, так и скорость ферментативной реакции. Для нормального протекания реакции необходимо количество субстрата, превышающее константу Михаэлиса-Ментен в 5-10 раз. При большем увеличении количества субстрата скорость ферментативной реакции может падать за счет «субстратного» торможения. Ферментативная реакция зависит от рН и от температуры среды. Величина рН влияет на процесс связывания фермента с субстратом, на образование и распад фермент-субстратного комплекса. Поэтому для ферментов характерно понятие «оптимума рН» Для большинства ферментов «оптимум рН» – это область физиологических значений рН, характерных для плазмы крови в условиях нормы: 7-8. Однако, есть ферменты оптимум рН для которых лежит в области рН=2 (пепсин, трипсин) и ферменты, активность которых проявляется при достаточно высоких значениях рН, как, например, щелочная фосфатаза, оптимум рН для действия этого фермента – 10,5. Величина рН очень важна для сохранения активности ферментов, поэтому необходимо использовать подходящие буферные растворы для стабилизации и поддержания постоянного значения рН реакционной среды, необходимого для работы данного фермента. Для большинства ферментов концентрация буферного раствора может варьировать от 0,01 до 0,1 моль/л. Для нормального протекания ферментативного процесса имеет значение температура, так как от нее зависит скорость ферментативной реакции. При этом необходимо обращать внимание на продолжительность периода инкубации и на стабильность фермента в этих условиях. Чаще всего при анализе ферментов поддерживается температурный оптимум, характерный для нормального состояния человеческого организма Ферменты, будучи белками, реагируют на изменения температурного режима – при повышении температуры активность ферментов может увеличиваться. Однако, при достаточно длительном повышении температуры (выше Соединения, присутствие которых приводит к изменению конформации фермента, изменению его активности и состояния активного центра, называют кофакторами. Кофакторы имеют разную степень сродства по отношению к ферментам и центрам активации. По своей природе кофакторами могут быть ионы металлов: цинка, магния, кальция, меди, марганца, железа, натрия, калия, и биологически активные вещества различного происхождения. Вещества, способные трансформировать ферменты из неактивного состояния в активное называют активаторами, индукторами, стимуляторами. Активаторы могут изменять структуру и длину молекулы фермента, переводя его из неактивной формы в активную (соляная кислота и пепсин), а также присоединятся к активному центру (катионы и анионы минеральных солей). Активация фермента может быть достигнута воздействием нескольких ионов. Вещества, приводящие к снижению или подавлению активности ферментов, называются ингибиторами. Ионы металлов в зависимости от концентрации могут выступать как в роли активаторов, так и в роли ингибиторов. Ингибиторы бывают необратимые и обратимые; конкурентные и неконкурентные. Соли тяжелых металлов, реагируя с ферментом, приводят к необратимому ингибированию его активности. Обратимое ингибирование может быть конкурентным и неконкурентным. При конкурентном ингибированиии активность фермента может быть восстановлена добавлением избытка субстрата. Обратимое ингибирование ферментов сыворотки часто исчезает при ее разведении, что и является одной из причин повышения активности ферментов сыворотки при ее разведении. Неконкурентное ингибирование может быть вызвано фосфорорганическими соединениями. При определении ферментов в моче, ее необходимо диализовать, так как в моче присутствуют ингибиторы, затрудняющие это определение. На активность ферментов могут влиять лекарственные препараты и продукты их метаболизма. Это необходимо учитывать при определении ферментативной активности в крови. Все вышеуказанное имеет значение при анализе ферментативной активности и определяет условия, при которых возможна оценка активности.ферментов Чаще всего присутствие и количество фермента определяется по специфичности и скорости катализируемой им реакции. Активность фермента (но не его концентрация) определяется косвенно на основании оценки катализируемого процесса, при этом определяется либо убыль субстрата, либо прирост продукта реакции за единицу времени. Фермент может оцениваться на основании количественного определения продуктов катализируемой им реакции. После достижения равновесия ферментативной реакции – определение проводят по «конечной точке», веществу, появляющемуся в результате реакции. Наиболее удобны реакции, при которых происходит практически полное использование субстрата, его преобразование в метаболит. Методы определения фермента по «конечной точке» мало чувствительны к изменениям условий реакции, особенно, если они незначительны (рН, температура). Пригодность фермента для оценки активности данным методом можно оценить по константе Михаэлиса: чем меньше константа Михаэлиса, тем выше сродство фермента с субстратом и, тем больше фермент пригоден для определения его активности по «конечной точке». Фермент можно оценить по убыли субстрата в течение определенного промежутка времени протекания ферментативной реакции – метод по «начальной точке» определения фермента. Метод оценки фермента, связанный с изменением концентрации субстрата в малые фиксированные отрезки времени носит название «кинетический метод». При кинетическом методе определяют изменения в нескольких точках за минуту и проводят расчет по формуле Бугера-Ламберта-Бера. При данном способе определения активности фермента возможно "двухточечное измерение" когда на исследуемом участке кривой дважды определяют абсорбцию- в начале и в конце измерения. За единицу активности фермента принимают международную единицу МЕ или Ед, которая представляет количество фермента, катализирующего превращение 1 микромоля (мкмоль или mмоль) субстрата за 1 минуту. Каталитическая активность выражается числом единиц на 1 литр любой биологической жидкости или 1 мг белка – Ед/л или Ед/мг белка. В системе СИ единица фермента – это катал (кат) – количество фермента, катализирующее превращение 1 моля субстрата за 1 секунду. Используют также нанокатал (нкат), или микрокатал (мккат). Активность фермента может быть выражена в нкат/л или нкат/мг белка. 1 Ед/л = 16,67 нкат/л 1 нкат = 0,06 Ед/л
Метаболизм ферментов. Метаболизм ферментов протекает сходно с аналогичными процессами, характерными для других белков. В плазме происходит их инактивация, и дальнейшие превращения ферменты претерпевают в клетках ретикулоэндотелиальной системы, где при участии тканевых протеаз осуществляется их катаболизм. Незначительное количество ферментов уходит через пищеварительный тракт, а также через мочевыводящие пути. Последний путь малоэффективен, так как в норме через почечный фильтр могут проходить соединения с молекулярной массой не более 60-70 кДа. Ферменты, находящиеся в желчи, по большей части имеют эндотелиальное происхождение и не связаны с ферментами плазмы. Ферментология. Ферментология изучает все процессы, связанные с ферментами, рассматривая их структуру, биологическую активность в норме и при патологии, считая, что патология во многом является результатом последовательных нарушений структуры и функции ферментов. Ферментология включает в себя несколько направлений анализа ферментов, каждое из которых имеет свою значимость для жизнедеятельности. Ферменты могут быть использованы в лабораторной практике в качестве высокоочищенных аналитических реагентов для количественного определения метаболитов. Чаще всего они используются в практике клинической лаборатории в виде готовых наборов промышленного производства, которые сопровождаются инструкцией по их применению. Менее специфические ферменты могут быть использованы для тех же целей, но за счет систем, обеспечиваемых сопряженными реакциями, т. е. использования нескольких ферментов, создающих ряд последовательных реакций. Оценка конечного результата проводится разными способами, в том числе и фотометрическими методами. При анализе цельной крови всегда в этих случаях необходима ее депротеинизация, при работе с сывороткой – добавление детергентов.
Ферментопатология. Изучение нарушений ферментов (количественное и качественное) в патогенезе заболеваний определяет все аспекты ферментопатологии. Одна из основных составляющих жизнедеятельности – согласованная деятельность ферментных систем. При нарушении согласованности возникает болезнь. Нарушение ферментативной активности определяется структурной организацией молекулы фермента, ее сохранности как молекулы в целом, так и составных частей: апофермента и кофермента. Причинами ферментопатий служат: 1. отсутствие, недостаток, аномальная структура апофермента за счет: · повреждение или изменение матрицы ДНК, РНК; · недостаток энергообеспечения синтеза; · нарушение этапов регуляции синтеза; · недостаток пластического материала (аминокислот); · повреждение на уровне клеток и клеточных структур. 2. отсутствие, недостаток, аномальная структура коферментов за счет: · нарушения поступления витаминов, коферментов; · нарушение резорбции витаминов в ЖКТ; · нарушение фосфорилирования витаминов в кишечнике; · нарушения, приводящие к гиповитаминозу; · деструкция клеток. Ферментопатии могут быть первичными и вторичными. Первичные ферментопатии являются результатом изменений или аномалий, возникающих на генетическом уровне за счет нарушений в структуре ДНК, процессах транскрипции и трансляции, что является причиной молекулярных болезней. Первичные ферментопатии приводят к отсутствию активного фермента в ткани или органе; резкому снижению активности фермента; и в очень редких случаях к повышению его активности. При отсутствии активного фермента возникают и развиваются наследственные дефекты обмена, при этом происходит накопление неиспользованного субстрата, и в то же время уменьшение продукта реакции, который в свою очередь является субстратом для дальнейших преобразований (следующей реакции) или источником для синтеза биологически активного соединения. При отсутствии активного фермента или значительного снижения его активности при первичных ферментопатиях могут отмечаться нарушения: · со стороны субстрата: v накопление неутилизируемого субстрата в клетках, биологических жидкостях; v нарушение обмена субстрата, как метаболита; v накопление аномальных продуктов обмена субстрата; v развитие вторичного метаболического блока; v интоксикация и нарушение функций организма в целом. Одновременно в случае отсутствия активных форм фермента или значительного снижения его активности возникают нарушения, связанные с продуктом реакции: · уменьшение содержания продукта реакции; · нарушение образования биологически активных веществ (метаболитов); · дефицит биологически активных веществ (метаболитов); · нарушение регуляции метаболических процессов; · нарушение функции жизненно важных органов. Ферментопатии первичного происхождения протекают с различной степенью выраженности. Если субстрат, который накапливается при ферментопатии, не токсичен, а продукт реакции не используется для синтеза биологически активных веществ и, следовательно, не развивается дефицит биологически активных веществ, то ферментопатия чаще всего протекает бессимптомно. Бессимптомные ферментопатии характеризуются отсутствием функциональных расстройств, отсутствием клинических проявлений. Они могут быть обнаружены при обследовании как, например, доброкачественная фруктозурия, почечная глюкозурия. Относительно бессимптомные первичные ферментопатии протекают без субъективных проявлений, но могут обнаруживаться (проявляться) при провокации. Так, в хирургической практике, обнаруживается скрытый дефицит холинэстеразы при использовании в качестве анестезирующих средств миорелаксантов. Дефицит глюкозо-6-фосфатдегидрогеназы проявляется при назначении противомалярийных препаратов. Клинические ферментопатии первичного происхождения всегда сопровождаются клиническими проявлениями. Вторичные ферментопатии возникают и проявляются вследствие повреждения клеток и тканей различными агентами. Воздействие, оказываемое на клетку, клеточную структуру, орган приводит к нарушению активности одного или нескольких ферментов, ферментных систем, что в свою очередь вызывает дисбаланс обменных процессов и возникновение патологии. Ферментопатии инфекционного происхождения возникают в результате воздействия токсических продуктов обмена вирусов, бактерий, то есть за счет экзо- и эндотоксинов. Аналогично происходит развитие ферментопатий при отравлениях. Яды и продукты их метаболизма вызывают нарушения обменных процессов, деструктивные изменения в клетках и стимулируют дезорганизацию ферментных систем. Вторичная ферментопатия может возникнуть в результате механического повреждения, вследствие которого нарушается кровоснабжение и следовательно транспорт субстратов и происходит накопление токсических метаболитов.
Ферментодиагностика. Одним из основных объектов определения ферментативной активности при заболевании служит кровь: сыворотка или плазма. Чаще с диагностическими целями анализируют сыворотку. В сыворотке крови присутствуют ферменты, имеющие различное происхождение: · клеточные ферменты – попадают в кровь из тканей в результате физиологического старения и гибели клеток, повышения проницаемости мембран. Уровень этих ферментов в крови зависит от их концентрации в тканях, молекулярной массы и локализации в клетке. Неспецифические клеточные ферменты обнаруживаются в большинстве органов. Органоспецифические ферменты (или маркерные) обнаруживаются в определенных тканях (аргиназа – в паренхиме печени, креатинкиназа – в мышечной ткани). · Секреторные ферменты выполняют в крови свою специфическую функцию (ферменты свертывающей системы крови и системы фибринолиза постоянно вырабатываются в печени и секретируются в кровь, где и участвуют в процессах гемостаза; аналогично – церулоплазмин из печени поступает в кровь, где осуществляет транспорт меди). Секреторные ферменты специфичны для плазмы. · Экскреторные ферменты синтезируются пищеварительными железами (поджелудочная железа, слизистая кишечника, эндотелий желчевыводящих путей). Появление этих ферментов в сыворотке в норме обусловлено естественным разрушением клеточных структур. К экскреторным ферментам относится щелочная фосфатаза, амилаза, липаза. Это ферменты неспецифичные для плазмы. В норме их в плазме мало и следовательно активность низка, но она резко увеличивается при патологии органа. Присутствие ферментов в плазме может быть оценено как: гиперферментопатия, гипоферментопатия и дисферментопатия. Гипоферментопатия касается большей степени секреторных ферментов и регистрируется редко. Она может быть обусловлена: 1. генетическими нарушениями, приводящими к нарушению синтеза фермента; 2. ингибированием синтеза фермента; 3. усилением деградации фермента. Гиперферментопатия может быть обусловлена: 1. выходом ферментов из поврежденных органов и тканей; 2. результатом действия сильных раздражителей, сопровождающихся метаболическими перестройками (вместе с появлением лейкоцитоза, увеличением СОЭ); 3. усилением синтеза белка. Дисферментопатии в основном связаны с появлением в крови органоспецифических ферментов Диагностически значимые ферменты дают достаточно информации для установления факта развивающейся патологии, оценки тяжести заболевания, контроля проводимой терапии.
Аминотрансферазы Аминотрансферазы принимают участие в переаминировании аминокислот. Диагностически значимы: · аспартатаминотрансфераза (КФ 2.6.1.1) – АСТ · аланинаминотрансфераза (КФ 2.6.1.2) – АЛТ Клеточные ферменты - аминотрансферазы встречаются во всех органах и тканях. Большое количество АСТ содержится в эритроцитах, поэтому для определения активности трансфераз в сыворотке гемолизированная кровь не используется. Активность ферментов определяется хроматографическими, спектрофотометрическими и колориметрическими методами. Диагностически значимым при определении активности трансфераз является коэффициент де Ритиса АСТ/АЛТ, изменение которого характерно для патологических процессов. Холиноэстераза – ХЭ. Различают два типа ферментов (ХЭ): одна группа – это истинная ХЭ (ацетилхолинэстераза КФ 3.1.1.7), вторая - псевдохолиноэстеразы (КФ 3.1.1.8), отличающиеся более широкой субстратной специфичностью. Повышение активности ХЭ в сыворотке крови наблюдается при тяжелой форме болезни Боткина (на протяжение всего желтушного периода). Увеличение активности наблюдается также при циррозе печени, при онкологических заболеваниях, в случае метастазирования в печень, нефротическом синдроме, бронхиальной астме, ревматическом эндокардите. Миорелаксанты могут приводить к длительному выраженному снижению ХЭ. Ингибирование ХЭ имеет место при отравлении пестицидами, инсектицидами, фосфорорганическими соединениями. При интоксикации угнетение активности ХЭ в сыворотке крови наступает уже при низких дозах яда, и оценивается как один из первых симптомов интоксикации, что и является результатом изменения активности синтеза белков в печени. Гипоферментемия регистрируется при тяжелых инфекционных заболеваниях, мышечной дистрофии, недостаточности питания. Белки крови. Ферменты. Диагностическое значение
ВВЕДЕНИЕ
Белки присутствуют во всех тканях и биологических жидкостях организма. Практически все физиологические и патологические реакции в живых системах протекают при непосредственном участии белков. Количественный и качественный состав белков крови достаточно полно отражает состояние белкового обмена организма в целом, поэтому белки крови широко используются для диагностических целей. По современным представлениям, плазма крови содержит до 300 различных белков, которые можно разделить на две основные группы: альбумины и глобулины. Соотношение между этими группами белков, а также количественные и качественные изменения индивидуальных белков внутри указанных групп имеют место при многих физиологических и патологических состояниях. По выполняемой ими функции белки крови можно разделить на основные группы: - транспортные / трансферрин, тироксин-связывающий белок/ - белки острой фазы / фибриноген, С-реактивный белок и др./ - комплемент / СЗ и С4 компоненты/ - факторы свертывания / фибриноген, протромбин, фактор УШ/ - ферменты / амилаза, и др./ - ингибиторы протеиназ / α1-антитрипсин, антитромбин/ - белковые гормоны / инсулин, глюкагон, вазопрессин/ - иммуноглобулины / IgG и др./ - поддерживающие онкотическое давление /все, особенно альбумин - поддерживающие буферную емкость / все белки / Физиологическая функция белков плазмы состоит в поддержании коллоидно-осмотического давления, кислотно-основного состояния, в процессах катализа; транспорте гормонов, липидов, жирных кислот, жирорастворимых витаминов, пигментов, минеральных веществ. Они - носители природного и приобретенного иммунитета. Белки плазмы крови - неотъемлемые компоненты свертывающей и противосвертывающей системы.
ЭЛЕКТРОФОРЕЗ БЕЛКОВ
|
|||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2020-11-11; просмотров: 97; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.16.66.206 (0.13 с.) |
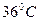 -
- 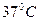 .При проведении измерений активности ферментов необходимо следить за температурой, сохраняя ее постоянство в пределах
.При проведении измерений активности ферментов необходимо следить за температурой, сохраняя ее постоянство в пределах 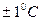 .
.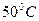 ) активность ферментов снижается, а при дальнейшем повышении температуры может наступить денатурация белка. В настоящее время в справочном материале часто приводят таблицы индивидуальной зависимости активности фермента от изменений температурного режима.
) активность ферментов снижается, а при дальнейшем повышении температуры может наступить денатурация белка. В настоящее время в справочном материале часто приводят таблицы индивидуальной зависимости активности фермента от изменений температурного режима.


