Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Формирование структуры сплавов при кристаллизации
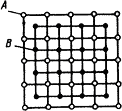
Кристаллизация - это процесс образования кристаллической решетки при переходе из жидкого в твердое состояние. Для того чтобы понять этот процесс, необходимо знать различие между твердым и жидким состоянием. Твердое тело имеет определенную форму и объем, обладает прочностью и пластичностью. Жидкости тоже имеют определенный объем, но, обладая малой сдвиговой прочностью, могут приобретать форму сосуда и могут течь. Таким образом, главное различие твердого и жидкого состояний заключается в изменении текучести. Текучесть определяется скоростью деформации тела под воздействием приложенной к нему статической силы сдвига. Кроме того, разница в свойствах твердого тела и жидкости проявляется в коэффициенте диффузии – скорости, с которой атомы могут перемещаться в веществе с места на место при их хаотическом движении. Диффузия в жидкостях намного больше, чем в твердых телах. Размещение атомов в жидкостях является неупорядоченным и характеризуется отсутствием дальнего порядка (рис. 2.1.а), то есть упорядоченное расположение атомов распространяется на очень небольшое расстояние.
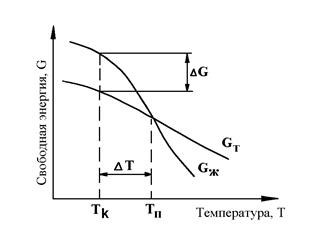
Твердое тело можно представить себе как совокупность атомов, расположенных на определенном (межатомном) расстоянии (рис. 2.1.б). Вследствие интенсивного теплового движения атомов ближний порядок динамически неустойчив. Микрообъемы с правильным расположением атомов, возникнув, могут существовать некоторое время, затем распасться и возникнуть вновь в другом месте (рис. 2.1.в). С понижением температуры степень ближнего порядка и размер таких микрообъемов возрастают. Система, состоящая из большого числа атомов, стремится к такому состоянию, которому в данных условиях соответствует минимальное значение величины свободной энергии. Если вещество может существовать в жидком и твердом кристаллических видах, то устойчивой в данных условиях будет та фаза, которая обладает меньшей величиной свободной энергии. С изменением внешних условий, например, температура, свободная энергия системы изменяется по сложному закону, который различен для твердого и жидкого состояния (рис. 2.2). При температурах выше равновесной температуры плавления Тп меньшей свободной энергией обладает жидкая фаза, а ниже этой температуры - твердая фаза. При температуре Тп обе фазы могут существовать одновременно и процесс кристаллизации еще не начинается. Для его начала необходимо, чтобы процесс был термодинамически выгоден системе и сопровождался уменьшением свободной энергии системы. Из кривых на рис. 3.5 видно, что это возможно при охлаждении жидкости ниже равновесной температуры Тп.
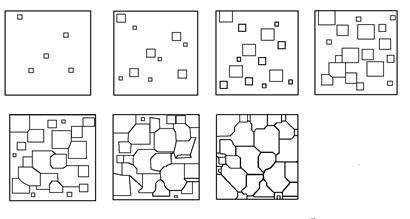
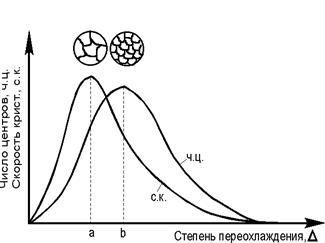
Температура, при которой практически начинается кристаллизация, называется фактической температурой кристаллизации (Тк). Разность между температурами Тп и Тк называется степенью переохлаждения: DТ=Тп-Тк. Чем больше степень переохлаждения DТ, тем больше разность свободных энергий DG и больше скорость кристаллизации. Процесс кристаллизации состоит из двух элементарных процессов. Первый процесс заключается в зарождении мельчайших частиц кристаллов (зародышей или центров кристаллов). В них атомы упакованы также как в твердом металле. Схема кристаллизации приведена на рис. 2.3. Она начинается с образования кристаллических зародышей и продолжается в процессе роста их числа и размеров. Пока образовавшиеся кристаллы растут свободно, они имеют более или менее правильную геометрическую форму. Однако при столкновении их правильная форма нарушается, так как в этих участках рост граней прекращается. Рост продолжается только в тех направлениях, где есть свободный доступ «питающей» жидкости. В результате образуется структура с кристаллами неправильной формы - зернами или кристаллитами. При прочих равных условиях скорость процесса кристаллизации и строение металла после затвердевания зависят от числа центров кристаллизации, возникающих в единице времени и в единице объема (1/(мм3 с)), и скорости их линейного роста (мм/с). Г. Тамман установил зависимость числа центров кристаллизации и скорости роста кристаллов от степени переохлаждения (рис. 2.4.). При DТ = 0 процесс кристаллизации не идет, скорости образования зародышей и их роста равны нулю. При DТ = a число центров кристаллизации небольшое, а скорость их роста максимальна. В этом случае структура металла будет крупнозернистой. При DТ = b число центров - максимально, а скорость их роста мала. Структура металла мелкозернистая.
Рис. 2.3. Схема кристаллизации
При очень больших степенях переохлаждения DТ скорость кристаллизации и число центров равны нулю. Подвижность атомов уже недостаточна для того, чтобы осуществлялась перестройка их из хаотического расположения в жидкости в правильное в кристалле. Структура металла - аморфная.
Рис. 2.4. Скорость роста кристалла и скорость зарождения центров кристаллизации в зависимости от степени переохлаждения
Самопроизвольное образование зародышей может происходить только в высокочистом жидком металле при больших степенях переохлаждения. В расплаве всегда присутствуют примеси - неметаллические включения, оксиды и т.д., которые чаще всего и являются зародышами. Если частицы примеси имеют одинаковую кристаллическую решетку с решеткой затвердевающего металла и параметры сопрягающихся решеток примеси и кристаллизующегося вещества примерно одинаковы (отличие не превышает 9%), то они играют роль готовых центров кристаллизации. Структурное сходство между поверхностями зародыша и частицы посторонней примеси приводит к уменьшению размера критического зародыша, работы его образования, и затвердевание жидкости начинается при меньшем переохлаждении, чем при самопроизвольном зарождении. Чем больше примесей, тем больше центров кристаллизации, тем меньше получается зерно. Такое образование зародышей называют гетерогенным. На практике стараются получить металл с мелким зерном, который имеет, как правило, лучшие эксплутационные свойства. Получить мелкое зерно можно, увеличивая число центров кристаллизации или уменьшая скорость их роста. Теория сплавов. Под сплавом понимают вещество, полученное сплавлением двух или более элементов. Возможны другие способы приготовления сплавов: спекания, электролиз, возгонка. В этом случае вещества называются псевдосплавами. Сплав, приготовленный преимущественно из металлических элементов и обладающий металлическими свойствами, называется металлическим сплавом. Сплавы обладают более разнообразным комплексом свойств, которые изменяются в зависимости от состава и метода обработки. К основным понятиям в теории сплавов относят: систему, компоненты, фазу, вариантность. Система – группа тел выделяемых для наблюдения и изучения. Чистый металл является простой однокомпонентной системой, сплав – сложной системой, состоящей из двух и более компонентов. Компоненты – вещества, образующие систему. В качестве компонентов выступают чистые вещества и химические соединения, если они не диссоциируют на составные части в исследуемом интервале температур. Фаза – однородная часть системы, отделенная от других частей системы поверхностного раздела, при переходе через которую структура и свойства резко меняются. Вариантность (C) (число степеней свободы) – это число внутренних и внешних факторов (температура, давление, концентрация), которые можно изменять без изменения количества фаз в системе.
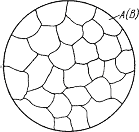
Строение металлического сплава зависит от того, в какие взаимодействия вступают компоненты, составляющие сплав. Почти все металлы в жидком состоянии растворяются друг в друге в любых соотношениях. При образовании сплавов в процессе их затвердевании возможно различное взаимодействие компонентов. В зависимости от характера взаимодействия компонентов различают сплавы: - механические смеси; - химические соединения; - твердые растворы. Сплавы – механические смеси образуются, когда компоненты не способны к взаимному растворению в твердом состоянии и не вступают в химическую реакцию с образованием соединения. Механические смеси образуются между элементами, значительно различающимися по строению и свойствам, когда сила взаимодействия между однородными атомами больше, чем между разнородными. Сплав состоит из кристаллов входящих в него компонентов (рис. 2.5). В сплавах сохраняются кристаллические решетки компонентов.
Рис. 2.5. Схема микроструктуры механической смеси
Сплавы – химические соединения образуются между элементами, значительно различающимися по строению и свойствам, если сила взаимодействия между разнородными атомами больше, чем между однородными. Особенности этих сплавов: - постоянство состава, то есть сплав образуется при определенном соотношении компонентов, химическое соединение обозначается Аn Вm. Образуется специфическая, отличающаяся от решеток элементов, составляющих химическое соединение, кристаллическая решетка с правильным упорядоченным расположением атомов (рис. 2.6); - ярко выраженные индивидуальные свойства; - постоянство температуры кристаллизации, как у чистых компонентов.
Рис. 2.6. Кристаллическая решетка химического соединения
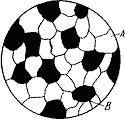
Сплавы твердые растворы – это твердые фазы, в которых соотношения между компонентов могут изменяться. Являются кристаллическими веществами. Характерной особенностью твердых растворов является наличие в их кристаллической решетке разнородных атомов, при сохранении типа решетки растворителя. Твердый раствор состоит из однородных зерен (рис. 2.7).
Рис. 2.7. Схема микроструктуры твердого раствора
По степеням растворимости компонентов различают твердые растворы: - с неограниченной растворимостью компонентов; - с ограниченной растворимостью компонентов.
При неограниченной растворимости компонентов кристаллическая решетка компонента растворителя по мере увеличения концентрации растворенного компонента плавно переходит в кристаллическую решетку растворенного компонента. Для образования растворов с неограниченной растворимостью необходимы: - изоморфность (однотипность) кристаллических решеток компонентов; - близость атомных радиусов компонентов, которые не должны отличаться более чем на 8…13 %. - близость физико-химических свойств подобных по строение валентных оболочек атомов. При ограниченной растворимости компонентов возможна концентрация растворенного вещества до определенного предела, При дальнейшем увеличении концентрации однородный твердый раствор распадается с образованием двухфазной смеси. По характеру распределения атомов растворенного вещества в кристаллической решетке растворителя различают твердые растворы: - замещения; - внедрения; - вычитания. В растворах замещения в кристаллической решетке растворителя часть его атомов замещена атомами растворенного элемента (рис. 2.8 а). Замещение осуществляется в случайных местах, поэтому такие растворы называют неупорядоченными твердыми растворами.
Рис. 2.8. Кристаллическая решетка твердых растворов замещения (а), внедрения (б)
При образовании растворов замещения периоды решетки изменяются в зависимости от разности атомных диаметров растворенного элемента и растворителя. Если атом растворенного элемента больше атома растворителя, то элементарные ячейки увеличиваются, если меньше – сокращаются. В первом приближении это изменение пропорционально концентрации растворенного компонента. Изменение параметров решетки при образовании твердых растворов – важный момент, определяющий изменение свойств. Уменьшение параметра ведет к большему упрочнению, чем его увеличение. Твердые растворы внедрения образуются внедрением атомов растворенного компонента в поры кристаллической решетки растворителя (рис. 2.8.б). Образование таких растворов, возможно, если атомы растворенного элемента имеют малые размеры. Такими являются элементы, находящиеся в начале периодической системы Менделеева: углерод, водород, азот, бор. Размеры атомов превышают размеры межатомных промежутков в кристаллической решетке металла, это вызывает искажение решетки и в ней возникают напряжения. Концентрация таких растворов не превышает 2…2,5%. Твердые растворы вычитания или растворы с дефектной решеткой. Образуются на базе химических соединений, при этом возможна не только замена одних атомов в узлах кристаллической решетки другими, но и образование пустых, не занятых атомами, узлов в решетке. К химическому соединению добавляют, один из входящих в формулу элементов, его атомы занимают нормальное положение в решетке соединения, а места атомов другого элемента остаются, незанятыми. Диаграмма состояния представляет собой графическое изображение состояния любого сплава изучаемой системы в зависимости от концентрации и температуры (рис. 2.9)
. Рис. 2.9. Диаграмма состояния
Диаграммы состояния показывают устойчивые состояния, т.е. состояния, которые при данных условиях обладают минимумом свободной энергии, и поэтому ее также называют диаграммой равновесия, так как она показывает, какие при данных условиях существуют равновесные фазы. Построение диаграмм состояния наиболее часто осуществляется при помощи термического анализа. В результате получают серию кривых охлаждения, на которых при температурах фазовых превращений наблюдаются точки перегиба и температурные остановки. Температуры, соответствующие фазовым превращениям, называют критическими точками. Некоторые критические точки имеют названия, например, точки отвечающие началу кристаллизации называют точками ликвидус, а концу кристаллизации – точками солидус. По кривым охлаждения строят диаграмму состава в координатах: по оси абсцисс – концентрация компонентов, по оси ординат – температура. Шкала концентраций показывает содержание компонента В. Основными линиями являются линии ликвидус (1) и солидус (2), а также линии соответствующие фазовым превращениям в твердом состоянии (3, 4). По диаграмме состояния можно определить температуры фазовых превращений, изменение фазового состава, приблизительно, свойства сплава, виды обработки, которые можно применять для сплава.
|
||||||||||||||||||||
|
Последнее изменение этой страницы: 2020-11-11; просмотров: 196; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.222.109.141 (0.035 с.) |
|||||||||||||||||||||