
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Занятие № 1. Что такое химияСтр 1 из 10Следующая ⇒
Занятие № 1. Что такое химия
Какие вещества вы знаете? Напишите их названия: _______________________________________________________________________________________________________________________________ ____________________________________________________________________________________________________________________________ Давайте проверим, не путаете ли вы предметы и вещества. Что из перечисленного – предмет, а что - вещество? 1) стекло 2) стул 3) бутылка 4) древесина 5) гвоздь 6) книга 7) резина 8) железо 9) шина автомобиля 10) бумага Распределите по парам предмет и вещество, из которого он состоит:
Подсказка: про предмет можно сказать, что он из чего-то сделан, а про вещество - нет. Например – нож сделан из железа. А сказать, что железо сделано из ножа – нельзя. Практическая работа № 1 Наблюдение различных физических тел. 1. Перечислите и положите перед собой различные физические тела, которые находятся сейчас рядом с вами. 2. Из каких веществ изготовлены эти тела? 3. Какие тела находятся у вашего соседа? Из каких веществ они изготовлены? 4. Вспомните и назовите как можно больше физических тел, которые состоят из тех же веществ, что и тела, лежащие сейчас на столе. ________________________________________________________________________________________________________________________________________________________________________________________________ Занятие № 2. Практическая работа № 2 «Знакомство Ход работы 1. Инструктаж по технике безопасности при работе с нагревательными приборами и со стеклянной посудой. 2. Выполните опыты. 3. Оформите таблицу
4. Приведите в порядок своё рабочее место.
II. Устройство и работа спиртовки Оборудование: спиртовка, спички. Ход работы: 1. Изучите строение и использование спиртовки; 2. Нарисуйте в тетради спиртовку, обозначив её составные части; 3. Изучите правила работы со спиртовкой;
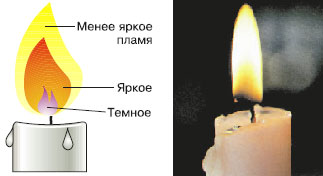
III. Строение пламени 1. Изучите строение пламени; 2. Рассмотрите пламя спиртовки, выделите три зоны: нижняя часть пламени – тёмная и самая холодная, средняя часть пламени – яркая, верхняя часть пламени – менее яркая, но с наиболее высокой температурой. 3. Внесите на короткое время в пламя лучинку так, чтобы она проходила через нижнюю часть пламени и по характеру обугливания определите, какая часть пламени имеет наибольшую температуру. 4. Сделайте выводы.
Кейс
Почему же ноша первого осла после купания стала легче, а второго тяжелее? Что произошло бы, если бы второй осёл нёс не вату, а сахар? Практическая работа № 4 «Изучение свойств веществ». 1. Насыпьте в стакан с водой чайную ложку сахарного песка и размешай его. Что происходит с крупинками песка? Куда они девались? Можно ли сказать, что сахарный песок исчез (попробуй воду на вкус). Изменился ли цвет воды, в которой ты размешал песок? Потеряла ли она прозрачность?
2. Проделайте с питьевой содой такой же опыт, какой ты ставил с сахаром. Растворяется ли в воде сода? 3. Аккуратно понюхайте предложенные учителем предметы, сделайте вывод. 4. Возьмите парафиновую свечу и подожгите ее. Понаблюдайте за тем, что происходит. (Парафин свечи при нагревании плавится, и затем испаряется. Но если он остынет – то снова станет парафином. А когда свеча горит – парафин превращается в другие вещества – углекислый газ и воду). 5. Сделайте выводы о веществах и их свойствах. Заполните таблицу – для каждого свойства отметьте – это свойство предмета или вещества
Кейс
Различные племена, предпочитают использовать для приготовления соли разные виды растений, например, папирус, некоторые травы, листья и кожуру бананов. Некоторые племена получают соль из золы сухих листьев, сжигаемых на земле, а точнее из смеси черной золы и частично обуглившихся листьев. Для экстрагирования солей в золу добавляют воду, которая растворяет соли, а затем подвергается фильтрованию. Для получения соли используется глиняный котел с отверстиями в нижней части. Эти отверстия изнутри покрывают полосками банановых листьев. В листьях прорезают щели, которые действуют как примитивный фильтр. Котел загружают золой, которую заливают холодной водой. Вода медленно просачивается через прорези в банановых листьях и стекает в поставленный снизу кувшин. Время от времени в котел добавляют воду и приминают золу. Полученный в результате соляной раствор сразу же используется для варки овощей. Задания: 1. Попробуйте придумать и нарисовать прибор, с помощью которого можно получить раствор соли из смеси в лабораторных условиях.
2. Составьте план разделения смеси двух твердых веществ: морского песка и поваренной соли. Мы знаем, что они отличаются по отношению к воде: соль растворяется, а песок – нет. 1. ________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________ 2. ________________________________________________________________________________________________________________________________________________________________________________________ ____________________________________________________________ Раствор - смесь, состоящая из частиц растворённого вещества, растворителя и продуктов их взаимодействия. Фильтрование - процесс разделения смесей при помощи фильтровальных перегородок, пропускающих жидкость или газ, но задерживающих твёрдые частицы. Кейс В XIX веке чрезвычайное интеллектуальное удовлетворение ученым доставило обнаружение смысла зеленой окраски растений. Оказывается, растения поглощают свет и поглощенную энергию используют для синтеза питательных веществ! Нужно было выделить и очистить пигменты зеленого листа – хлорофиллы. А они так близки по свойствам, что разделить их не удавалось.
Михаил Семенович Цвет бился над задачей разделения пигментов зеленого листа. Он взял стеклянную трубку, наполнил ее порошком мела и на верхний слой налил немного спиртового экстракта листьев. Экстракт был буро-зеленого цвета, и такого же цвета стал верхний слой меловой колонки. А затем Михаил Семенович начал по каплям лить сверху в трубку с мелом чистый спирт. Капля за каплей очередная его порция растворяла пигменты с крупинок мела, передвигаясь вниз по трубке. В результате в столбике мела получались однородные окрашенные полосы чистых веществ. Это было прекрасно. Ярко-зеленая полоса, полоса чуть желтее зеленого – это два вида хлорофиллов и яркая желто-оранжевая полоса каротиноидов. Цвет назвал эту картину хроматограммой. (Трудно удержаться от улыбки: Цвет – хромос, хроматограмма – цветограмма.) Метод был так странно прост, что большая часть современников или не восприняла это удивительное открытие, или, что еще печальнее, резко восстала против его автора. Молчание длилось почти 30 лет... В 1944 году английские химики предложили подобный метод, который сейчас лежит в основе большинства достижений в науке и технике. Вопросы 1. Как называется данный метод? 2. Какие виды разделения данным методом известны? 3. В чем на ваш взгляд преимущества разделения таким методом веществ? Практическая работа № 6 «Хроматография красителей из фломастеров». Возьмите лист фильтровальной бумаги и вырежьте из него длинный прямоугольник, такой, чтобы свободно проходил в ваш стаканчик. Проведите карандашом линию вдоль короткой стороны на расстоянии 5-7 мм от края. На этой линии нарисуйте выбранными фломастерами точки, на расстоянии 1 см друг от друга. Поставьте прямоугольник в стаканчик цветными точками вниз. Растворитель будет подниматься по бумаге и цветные пятна начнут подниматься вслед за ним. В конце у вас получится что-то похожее на такую картину: Если мы посмотрим на то, что получилось, то увидим, что у первого и второго фломастеров чернила состоят из чистых красителей. У третьего – чернила составлены из двух красителей и один из них – такой же, как и в первом фломастере.
Не обязательно, что у вас получится точно так же, но в это и интересно в исследовании – результат не всегда получается предсказать. Поэтому попробуйте провести ваше собственное исследование и результат запишите в таблицу.
Вопросы 1. Подумайте, что произошло в бочонках с белой краской? 2. Знаете ли вы другие способы получения пигментов для красок? 3. Назовите вещества, которые на ваш взгляд, могут быть пигментами красок?
Кейс
то взрывались, то пылали, то шипели, то сверкали, то в покое пребывали Алюминий, Натрий, Калий, Фтор, Бериллий, Водород… Перепутались все свойства, недалеко от беды. Вдруг команда: - Стройся, войско! – Стали строиться в ряды. Во втором ряду волненье: все боятся окисленья. – Поглядите! – злится Литий. – Фтор ужасный окислитель! Я не встану в этот ряд! Пусть другие здесь горят! – И Бериллий мрачно мыслит: - Кислород нас всех окислит! И, простите за повтор, как несносен этот Фтор! – Бор кивает головой, но не рвется сразу в бой! И Азот не лезет в спор. Но зато взорвался Фтор: - Ах! Так мы для вас не пара! Кислород! Поддай им жару! Окисляй! За мной! Вперед! – Стойте! – крикнул Углерод. – Я и уголь, и алмаз. И за них я и за вас! Я сражаться не горю, я вас лучше помирю! Встану я посередине!.. Третий ряд! Трубите сбор! – Натрий, Магний, Алюминий, Кремний, Фосфор, Сера, Хлор! По порядку, по закону элементы встали в ряд. И выходит, что в колонне все похожие стоят! Кремний встал под Углеродом. Сера схожа с Кислородом. Алюминий встал под Бор – замечательный подбор! Ряд пристраивают к ряду. А рядов – то десять кряду. Металлы под металлами, едкие под едкими, ковкие под ковкими идут своими клетками. По порядку все стоит. Вот Природы Алфавит! Задания: 1. Дайте определение понятия «атом», «химический элемент». 2. Кем и когда были предложены термины «атом», «химический элемент»? 3. Сколько химических элементов встречается в природе, сколько синтезировано искусственно? 4. О скольких химических элементах рассказывается в стихотворении? Выпишите все химические элементы, о которых идет речь, используя таблицу химических элементов Д.И. Менделеева. 5. Попробуйте найти в таблице имя элемента по символу и наоборот.
Заполните пропуски в таблице, а заодно и попробуйте догадаться – давно ли открыт этот элемент или нет.
Кейс На уроке природоведения пятиклассники изучали вещества и Анна Ивановна – учитель, сказала, что вещества бывают простые и сложные. Однако объяснить, как отличить одни вещества от других она не успела, потому что прозвенел звонок. Но домашнее задание нужно было выполнять. Необходимо было определить: какие из перечисленных веществ относятся к простым, а какие к сложным: вода, цинк, мел, кислород, озон, бертолетова соль, фуллерен, углекислый газ, карбин, фосфин, алмаз.
Тогда Вася решил, что Интернет ему поможет. Действительно, поискав нужную информацию по данной теме, Вася нашел стихотворение: Если наши атомы Как ему может помочь это стихотворение в выполнении домашнего задания Вася так и не понял и позвонил однокласснику Виталику. После общения с одноклассником Вася снова оказался у компьютера и через пять минут домашнее задание было выполнено. Вопросы: 1. Что посоветовал поискать в сети Интернет Васе Виталик? 2. Сформулируйте определение «простого» и «сложного вещества».
Напишите химические формулы: газа азота - простого вещества, содержащегося в воздухе, в состав молекулы которого входят два атома элемента азота ________________; угарного газа – очень ядовитого сложного вещества, молекула которого состоит из одного атома углерода и одного атома кислорода ___________________; углекислого газа, из которого состоят «пузырьки» в газированной воде. Его молекула содержит один атом углерода и два атома кислорода __________; воды, у которой молекула состоит из двух атомов водорода и одного атома кислорода _____________; пероксида водорода, дезинфицирующего средства. Его молекула состоит из двух атомов водорода и двух атомов кислорода _____________; уксусной кислоты, приправы, которую добавляют в маринованные блюда и в майонезы. Ее молекула содержит два атома углерода, четыре атома водорода и два атома кислорода _______________; всем известного сахара. Его молекула состоит из двенадцати атомов углерода, двадцати двух атомов водорода и одиннадцати атомов кислорода ______. Практическая работа № 9 «Моделирование химических формул».
Атомы изображайте в виде шариков, атомы разных элементов обозначайте разными цветами. Связи между атомами делайте в виде спичек. Не забудьте, что атом H образует только одну связь, О – 2 связи, N - 3 связи, а С - 4 связи. Не забудьте, что атом H образует только одну связь, О – 2 связи, N - 3 связи, а С- 4 связи.
Кейс Одно время это вещество добывали, опуская рабочих в клетях в жерла спящих вулканов, где они соскабливали его с внутренних стенок вулканов. В провинции Индонезии существует вулкан, полностью заполненный этим веществом, который носит название Кава Иджен. Вещество оседает на трубах, после чего рабочие сбивают его арматурой и несут на взвешивание. Там, таким образом, они зарабатывают себе на жизнь.
Вопросы: 1. Как называется это вещество? 2. Где может применяться данное вещество и его соединения? Кейс
Самый легкий газ. Активно использовался в дирижаблестроении, пока не сгорел немецкий дирижабль Гинденбург. Вопросы: 1. Назовите самый легкий газ. 2. Какие свойства этого газа обусловили его применение. Кейс
Вывод: очень часто у ученых есть какое-нибудь необычное увлечение, как любовь к цветам, например. На первый взгляд, это «хобби» было совершенно бесполезным и ничем не могло помочь Бойлю в его настоящей профессии. Но было бы ошибочно и далее полагать, что увлечения и наука не взаимосвязаны. Если бы Бойль не любил цветы и, следовательно, не принес бы корзину с фиалками в свою лабораторию, то неизвестно, кто, когда и каким образом сделал бы открытие вместо него. Давайте посмотрим, что происходит с разными индикаторами в растворах кислот и оснований. Что наблюдаете? Запишите результат
А что получится, если мы будем аккуратно по каплям добавлять к раствору основания, окрашенного индикатором, раствор кислоты? Каким будет цвет индикатора: таким же, как в кислоте или как в основании? Что происходит с цветом индикатора? _____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________ Кейс В 19 веке на смену лакмусу пришли более прочные и дешевые синтетические красители, поэтому использование лакмуса ограничивается лишь грубым определением кислотности среды. На смену лакмусу в химии пришел лакмоид - краситель резорциновый синий, который отличается от природного лакмуса и по строению, но сходен с ним по окраске: в кислой среде он красный, а в щелочной - синий.
Индикатор фенолфталеин в кислой и нейтральной среде – бесцветен, а в щелочной имеет малиновую окраску. Поэтому фенолфталеин используют лишь для определения щелочной среды. В зависимости от кислотности среды изменяет окраску и краситель бриллиантовый зеленый (его спиртовой раствор используется как дезинфицирующее средство – зеленка). В сильнокислой среде его окраска желтая, а в сильнощелочной среде раствор обесцвечивается. Однако в последнее время в лабораторной практике используется универсальный индикатор- смесь нескольких индикаторов. Он позволяет легко определить не только характер среды, но и значение кислотности (рН) раствора. Кейс
Руководитель проекта уже был готов прекратить поиски. После тщетных усилий исследователи переключились на тестирование других веществ. Как-то раз молодой работник лаборатории взял стеклянную палочку и вытянул из капли клейкого вещества длинную нить. Это занятие так захватило команду исследователей, что однажды во время отсутствия руководителя группы они устроили соревнование – кто вытянет самую длинную нить. И когда соревнующиеся уже заплели нитями весь коридор, их осенила мысль, что вот он, способ переведения вещества из жидкого состояния в твердое. Нити оказались достаточно крепкими, чтобы их можно было ткать. А первую полностью синтетическую ткань назвали нейлон. Вывод: игривое развлечение привело к открытию первой синтетической ткани, которое, в свою очередь, перевернуло жизнь человека. В науке, как мы видим, есть место для несерьезности и легкой безответственности, ведь в правильном соотношении со знаниями и упорством они могут сотворить чудеса. Кейс Представьте себе, что ваша группа из 4-5 человек – это маленькая лаборатория по производству парфюмерной продукции… Безусловно, в будущем, ваше имя станет всемирно известным, но пока вам только предстоит завоевать популярность, как это сделали многие другие фирмы. Каких известных производителей духов вы знаете? Выберите название для своей группы, производящей парфюмерные ароматы.
Для начала ознакомимся с некоторыми приемами работы. Парфюмеры никогда не нюхают душистые вещества прямо из банки. Они слишком сильно пахнут, и можно не только потерять на время способность ощущать все детали запахов, но и даже заработать насморк. К тому же вещество в банке пахнет совсем по-другому, чем на коже. Поэтому специалисты используют бумажные полоски, на которые наносят каплю раствора душистого вещества. У вас на столе набор из нескольких таких полосок. Не старайтесь перенюхать все ваши и соседские – обоняние человека «насыщается» запахами. После 4-5 ароматов вы просто перестанете их различать, а чтобы придумать красивый запах, нужно обладать очень хорошим обонянием. В парфюмерной композиции для начала нужно выбрать основной компонент. Полоски на столах предназначены именно для этого. Пользуясь ими, выберите тот из ароматов, который вам понравится больше всего. Это эфирное масло станет основой для вашей композиции. Найдите его название в первой колонке таблицы совместимости эфирных масел. Из второй колонки выберите несколько совместимых с ним дополнительных ароматов. Выберите по бумажным полоскам те дополнительные ароматы, которые вам кажутся наиболее интересными для вашей композиции. Не увлекайтесь, составить приятно пахнущую композицию из большого числа компонентов бывает очень сложно, поэтому используйте 1-2 дополнительных эфирных масла. Безусловно, вы можете попробовать добавлять и несовместимые эфирные масла, но в этом случае полученная композиция может пахнуть не слишком приятно. Запишите состав композиции в таблицу. Обратите внимание, общий объем всех эфирных масел в сумме должен быть 1.3 мл. Оптимально, чтобы в вашей смеси объем основного аромата был 0.8-1 мл, а остальное приходилось на дополнительные ароматы.
Внимание! Вся дальнейшая работа проводится только в перчатках. С готовым рецептом ароматической смеси подойдите к преподавателю и получите нужные количества эфирных масел. Добавьте к эфирным маслам смесь спирта и воды. По составу ваша композиция соответствует туалетной воде. Тщательно перемешайте ваш продукт. Для того, чтобы оценить получившийся запах, нанесите 1-2 капли на бумажную полоску, подождите, когда она высохнет и понюхайте, что получилось. Придумайте название вашей парфюмерной композиции. Таблица совместимости эфирных масел
Кейс У восьмиклассника Никиты есть младшая сестра Маша – ученица первого класса. На линейке последнего звонка они с интересом наблюдали, как выпускники 11 класса запускали в небо воздушные шары, прощаясь со школой. В руках у Маши тоже был воздушный шарик, но когда Маша отпустила ниточку, за которую держала шарик, он никуда не взлетел, а упал на асфальт школьного двора. Никита попытался объяснить Маше, что 11 – классники запускали гелиевые шарики, а у Маши был шарик, надутый воздухом, но Маша сказала, что наверно ее шарик бракованный и очень расстроилась. Как Никита должен объяснить Маше, почему ее шарик не взлетает в небо, используя простейшие математические расчеты, понятные первокласснику? Относительные молекулярные массы (Mr) сложных молекул можно определить, просто складывая относительные атомные массы ( Ar) входящих в них элементов. Например, молекулярная масса воды (H2O) есть Mr H2O = 2 Ar H + Ar O = 2·1+16 = 18 Mr воздуха = 29 (смесь газов) Задания: 1. Расставьте относительные молекулярные массы веществ в соответствующие клетки с формулами веществ.
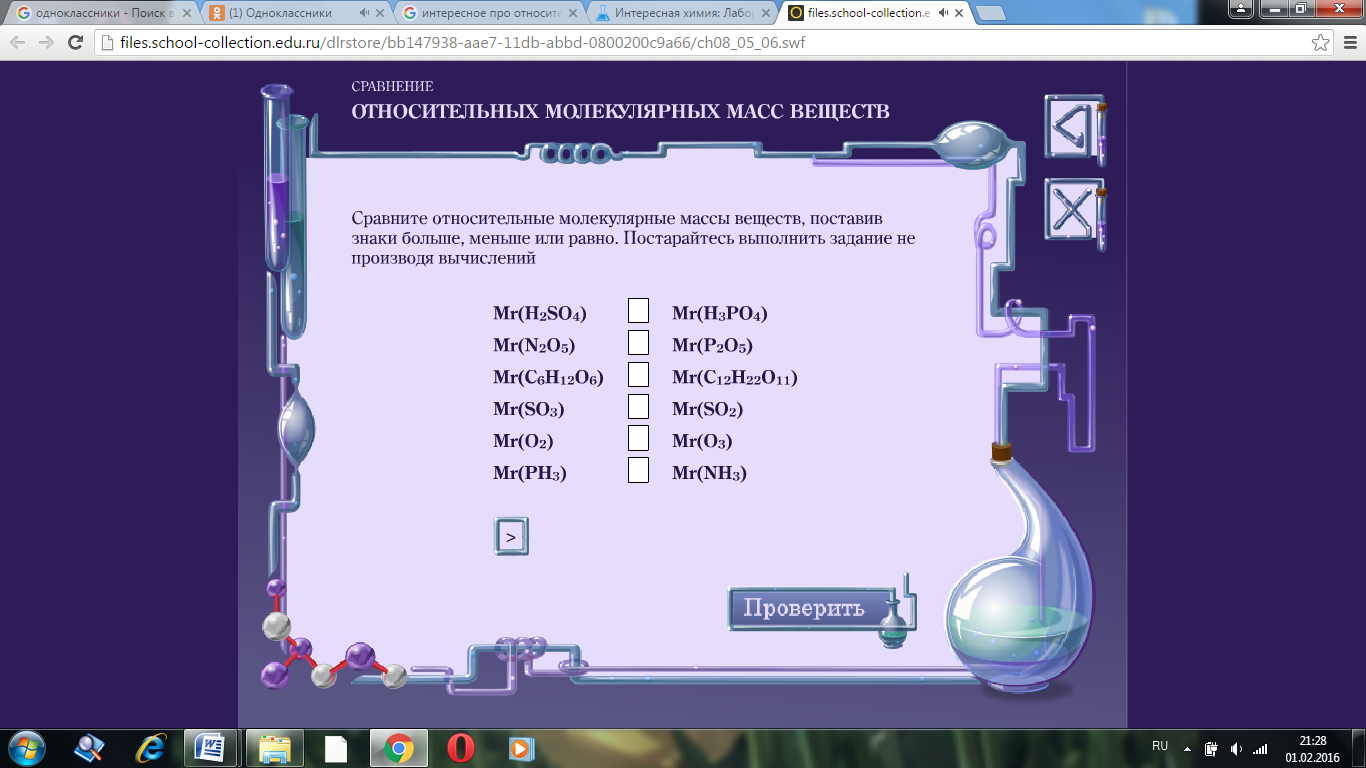
2. Сравните относительные молекулярные массы веществ, поставив знаки больше, меньше или равно.
Кейс Два друга Вася и Виталик летом поехали к бабушке в деревню. Однажды к ним в гости пришел сосед дядя Андрей и посетовал на то, что урожай на его полях в текущем году несколько ниже, чем был в прошлом году, и цвет растений желто – зеленый. Анализируя данную ситуацию, дядя Андрей пришел к выводу, что растениям не хватает полезных веществ и решил к следующему сезону закупить удобрения. Но вот только какие из них будут самыми эффектными, фермер не знал. Друзья решили помочь соседу, нашли всю необходимую информацию в Интернете, провели необходимые расчеты, и на следующий день отправились с дядей Андреем в магазин. В магазине в наличии имелись:а ммиачная селитра, мочевина, аммофос, ка́лиевая сели́тра. Какие же удобрения приобрел дядя Андрей по совету Васи и Виталика? Задача 1. Какова массовая доля водорода и кислорода в воде (Н2О)? Решение: 1) Вычисляем относительную молекулярную массу воды: Mr(Н2О) = 2.Аr(Н) + 1.Аr(О) = 2.1 + 1.16 = 18 2) Вычисляем массовую долю водорода в воде:
3) Вычисляем массовую долю кислорода в воде. Так как в состав воды входят атомы только двух химических элементов, массовая доля кислорода будет равна:
Минера́льные удобре́ния — неорганические соединения, содержащие необходимые для растений элементы питания. · А ммиачная селитра — NH4NO3; · Мочевина – CO(NH2)2; · Аммофос — NH4H2PO4; · Ка́лиевая сели́тра KNO3.
Кейс Лесные звери варили клюквенный компот. Клюквенный отвар получился очень кислым, пришлось добавлять сахар. В 4 кг отвара медведь высыпал пакет (1 кг) сахара, барсук — 1 стакан (200 г) сахара, заяц – 5 столовых ложек (по 15 г), белочка и ёжик – по 10 чайных ложек (5 г). После этого звери попробовали компот и решили, что он получился очень вкусным. Однако заяц сказал, что ему все – таки непонятно: сколько же в следующий раз надо насыпать сахара, чтобы компот был сладким и вкусным? Задание: Определите массовую долю сахара в полученном растворе. Массовая доля растворенного вещества – это отношение массы растворенного вещества mр.в. к общей массе раствора mр-ра, выраженное в процентах.
Заключение Зачем нам нужна эта химия? Что же полезного в ней? Ведь алгебра, музыка, физика, Намного, наверно, важней. Ведь алгебра, музыка, физика, Ведут человека вперед. Без них наша жизнь немыслима, Без них человек не живет. Но химия – самая важная, И больше других нам нужна. Откуда у нас напитки? Откуда посуда, еда? Откуда у нас лекарства, Косметика, мыло, духи, Ткани, квартиры, убранство? Всем химии обязаны мы.
Зачем же нужна нам химия? Нужна она, чтобы жить!
Занятие № 1. Что такое химия
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2020-11-11; просмотров: 319; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.222.111.24 (0.145 с.) |
 Вещество – то, из чего состоят физические тела. Бумага, из которой сделана книга, есть вещество, которое химик назовет целлюлозой. Из смеси различных веществ сделана краска, которой напечатаны буквы. Вода, налитая в стакан – тоже вещество, как и стекло, из которого сделан сам стакан.
Вещество – то, из чего состоят физические тела. Бумага, из которой сделана книга, есть вещество, которое химик назовет целлюлозой. Из смеси различных веществ сделана краска, которой напечатаны буквы. Вода, налитая в стакан – тоже вещество, как и стекло, из которого сделан сам стакан.
 Есть такая сказка. Два осла шли по дороге с кладью. Один был навьючен солью, а другой — ватой. Первый осёл едва передвигал ноги: так тяжела была его ноша. Второй — шёл весело и легко. Вскоре животным пришлось переходить речку. Осёл, навьюченный солью, остановился в воде и стал купаться: он то ложился в воду, то снова становился на ноги. Когда осёл вышел из воды, ноша его стала гораздо легче. Другой осёл, глядя на первого, тоже стал купаться. Но чем дольше он купался, тем тяжелее становилась навьюченная на него вата.
Есть такая сказка. Два осла шли по дороге с кладью. Один был навьючен солью, а другой — ватой. Первый осёл едва передвигал ноги: так тяжела была его ноша. Второй — шёл весело и легко. Вскоре животным пришлось переходить речку. Осёл, навьюченный солью, остановился в воде и стал купаться: он то ложился в воду, то снова становился на ноги. Когда осёл вышел из воды, ноша его стала гораздо легче. Другой осёл, глядя на первого, тоже стал купаться. Но чем дольше он купался, тем тяжелее становилась навьюченная на него вата.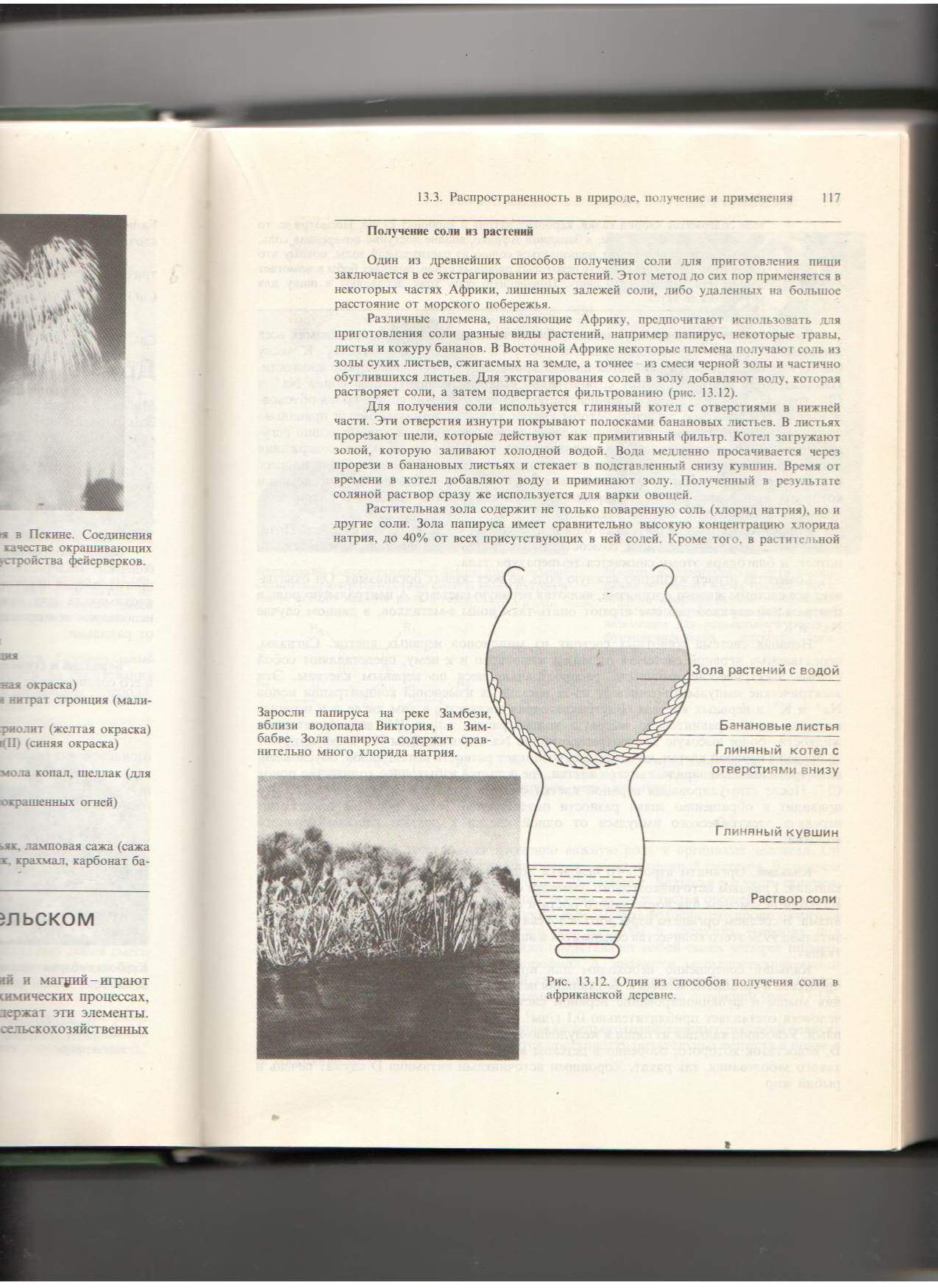 Один из древнейших способов получения соли для приготовления пищи заключается в ее экстрагировании из растений. Этот метод до сих пор применяется в некоторых частях Африки, лишенных залежей соли, либо удаленных на большое расстояние от морского побережья.
Один из древнейших способов получения соли для приготовления пищи заключается в ее экстрагировании из растений. Этот метод до сих пор применяется в некоторых частях Африки, лишенных залежей соли, либо удаленных на большое расстояние от морского побережья. Михаил Семёнович Цвет является творцом этого метода анализа, открывшего широчайшие возможности для тонкого химического исследования.
Михаил Семёнович Цвет является творцом этого метода анализа, открывшего широчайшие возможности для тонкого химического исследования. То кружились, то мелькали, то водили хоровод,
То кружились, то мелькали, то водили хоровод, Химическая формула вещества отражает состав его молекул. Например, молекула оксида серы состоит из одного атома серы и двух атомов кислорода, формула – SО2.
Химическая формула вещества отражает состав его молекул. Например, молекула оксида серы состоит из одного атома серы и двух атомов кислорода, формула – SО2. Соберите из спичек (или зубочисток) и пластилина модели следующих веществ: кислород O2, азот N2, вода H2O, аммиак NH3, метан CH4, этан С2Н6, этилен C2H4, ацетилен C2H2.
Соберите из спичек (или зубочисток) и пластилина модели следующих веществ: кислород O2, азот N2, вода H2O, аммиак NH3, метан CH4, этан С2Н6, этилен C2H4, ацетилен C2H2.  Оно имеет жуткий запах и обладает удушающим действием на человека. Жрецы использовали это вещество для проведения разных обрядов и священных курений, а военные добавляли в состав различных горючих смесей.
Оно имеет жуткий запах и обладает удушающим действием на человека. Жрецы использовали это вещество для проведения разных обрядов и священных курений, а военные добавляли в состав различных горючих смесей. Впервые этот газ был замечен Парацельсом в первой половине XVI века, но только Лемери в конце XVII века выделил его из обыкновенного воздуха, показав его горючесть. В дальнейшем это вещество было изучено Кавендишом. Лавуазье назвал этот газ - «рождающий воду».
Впервые этот газ был замечен Парацельсом в первой половине XVI века, но только Лемери в конце XVII века выделил его из обыкновенного воздуха, показав его горючесть. В дальнейшем это вещество было изучено Кавендишом. Лавуазье назвал этот газ - «рождающий воду». Впервые индикаторы обнаружил в 17 веке английский физик и химик Роберт Бойль. Бойль проводил различные опыты. Однажды, когда он проводил очередное исследование, зашел садовник. Он принес фиалки. Бойль любил цветы, но ему необходимо было проводить эксперимент. Бойль оставил цветы на столе. Когда ученый закончил свой опыт он случайно посмотрел на цветы, они дымились. Чтобы спасти цветы, он опустил их в стакан с водой. И – что за чудеса- фиалки, их темно- фиолетовые лепестки, стали красными. Бойль заинтересовался и проводил опыты с растворами, при этом каждый раз добавлял фиалки и наблюдал, что происходит с цветками. В некоторых стаканах цветы немедленно начали краснеть. Ученый понял, что цвет фиалок зависит от того, какой раствор находится в стакане, какие вещества содержатся в растворе. Лучшие результаты дали опыты с лакмусовым лишайником. Бойль опустил в настой лакмусового лишайника обыкновенные бумажные полоски. Дождался, когда они пропитаются настоем, а затем высушил их. Эти хитрые бумажки Роберт Бойль назвал словом, которое в переводе с латинского означает «указатель», так как они указывают на среду раствора. Именно эти вещества помогли ученому открыть новую кислоту - фосфорную, которую он получил при сжигании фосфора и растворении образовавшегося белого продукта в воде.
Впервые индикаторы обнаружил в 17 веке английский физик и химик Роберт Бойль. Бойль проводил различные опыты. Однажды, когда он проводил очередное исследование, зашел садовник. Он принес фиалки. Бойль любил цветы, но ему необходимо было проводить эксперимент. Бойль оставил цветы на столе. Когда ученый закончил свой опыт он случайно посмотрел на цветы, они дымились. Чтобы спасти цветы, он опустил их в стакан с водой. И – что за чудеса- фиалки, их темно- фиолетовые лепестки, стали красными. Бойль заинтересовался и проводил опыты с растворами, при этом каждый раз добавлял фиалки и наблюдал, что происходит с цветками. В некоторых стаканах цветы немедленно начали краснеть. Ученый понял, что цвет фиалок зависит от того, какой раствор находится в стакане, какие вещества содержатся в растворе. Лучшие результаты дали опыты с лакмусовым лишайником. Бойль опустил в настой лакмусового лишайника обыкновенные бумажные полоски. Дождался, когда они пропитаются настоем, а затем высушил их. Эти хитрые бумажки Роберт Бойль назвал словом, которое в переводе с латинского означает «указатель», так как они указывают на среду раствора. Именно эти вещества помогли ученому открыть новую кислоту - фосфорную, которую он получил при сжигании фосфора и растворении образовавшегося белого продукта в воде. В наши дни известны несколько сот кислотно-основных индикаторов, искусственно синтезированных начиная с середины 19 века. Индикатор метиловый оранжевый (метилоранж) в кислой среде красный, в нейтральной – оранжевый, а в щелочной – синий.
В наши дни известны несколько сот кислотно-основных индикаторов, искусственно синтезированных начиная с середины 19 века. Индикатор метиловый оранжевый (метилоранж) в кислой среде красный, в нейтральной – оранжевый, а в щелочной – синий. В 1934 году в лабораториях корпорации DuPont ученые пытались создать искусственный шелк. Несколько месяцев напряженной работы не принесли результатов: полимер, который получали после экспериментов, не могли перевести из жидкого состояния в твердое.
В 1934 году в лабораториях корпорации DuPont ученые пытались создать искусственный шелк. Несколько месяцев напряженной работы не принесли результатов: полимер, который получали после экспериментов, не могли перевести из жидкого состояния в твердое. Практическая работа № 15 «Получение духов».
Практическая работа № 15 «Получение духов».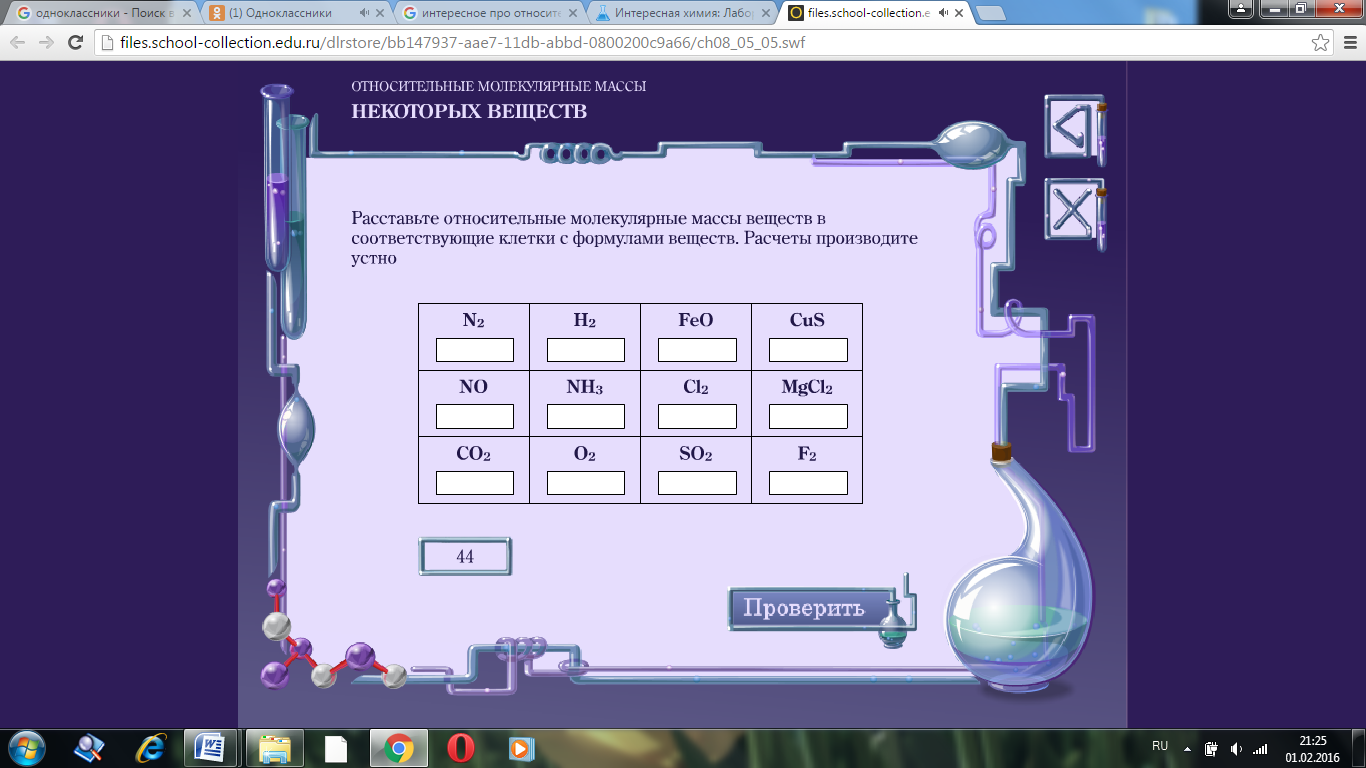
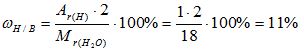
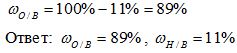
 Занятие № 27 – 28 Растворы. Массовая доля растворенного вещества
Занятие № 27 – 28 Растворы. Массовая доля растворенного вещества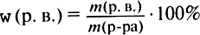
 Она интересна. Загадочна, Но нужно ее учить,
Она интересна. Загадочна, Но нужно ее учить,


