Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
II. Методика исследований крови рыб 1. Оборудование.
Наблюдения за изменением морфологического состава крови помогают контролировать физиологическое состояние организма рыбы, что крайне важно при проведении различных ихтиологических, ихтиопатологических и других исследованиях. Для сбора материала при морфологическом анализе крови рыб в полевых условиях необходимо иметь элементарную походную лабораторию, в составе которой могут находиться складной рабочий столик любой конструкции и небольшой ящик с материалами и оборудованием. Для забора крови необходимы шприцы типа "Рекорд" с иглами. Для безмеланжерного взятия крови используют серологические пробирки, заранее заполненные соответствующими растворами и закрытые резиновыми пробками. Кроме того, необходимо иметь набор инструментов и реактивов, дорожный микроскоп, предметные стекла, которые следует тщательно подготовить. Обработка предметных стекол. Микроскопические исследования форменных элементов крови рыб, как и других позвоночных и человека, проводят на окрашенных препаратах с применением иммерсионного объектива. Следовательно, кроме знаний морфологического строения клеток крови рыб успех работы зависит еще и от того, как приготовлены препараты, каково их качество, насколько они удачно зафиксированы и окрашены. Большое значение в этой работе имеют качество предметных стекол, их толщина, обработка. Предметные стекла, используемые для изготовления мазков крови и отпечатков органов, исследуемых на гемопоэз, готовят и тщательно обрабатывают заранее. Препараты, изготовленные на толстых предметных стеклах, для работ с иммерсионным объективом малопригодны. Качественные мазки получаются только в том случае, если стекла хорошо обезжирены. Не бывшие в употреблении новые стекла рекомендуется заливать не менее чем на 1 сутки насыщенным раствором двухромовокислого калия в технической серной кислоте (хромовая смесь). По истечении срока указанный раствор сливают в другой сосуд, а стекла тщательно отмывают от хромовой смеси в течение 2 ч и более сильной струёй водопроводной воды. Затем стекла тщательно просушивают чистой хлопчатобумажной салфеткой и, переложив бумажными прокладками, упаковывают небольшими пачками по 5-10 шт. в каждой. Чтобы избежать загрязнения стекол при самой обработке, их следует брать только пинцетом, а при протирке и других операциях держать только за ребра, не касаясь их рабочих поверхностей.
Остававшуюся хромовую смесь используют многократно до полного расходования. При повторном использовании обработку предметных стекол начинают с освобождения их от иммерсионного и другого масла, применявшегося при работе иммерсией. Эти масла легко снимают с помощью эфира, ксилола, толуола, бензина. Дальнейшая обработка не отличается от уже описанной. За неимением хромовой смеси стекла кипятят в мыльном растворе. Затем с помощью щетки для рук их отмывают, тщательно прополаскивают сильной струёй водопроводной воды и протирают насухо чистым полотенцем или простой чистой тряпочкой. Для полного обезжиривания предметные стекла заливают смесью спирта с эфром 1:1 на 2-3 суток, можно и дольше вплоть до употребления. Предметные стекла, предназначенные для фазово-контрастных исследований, стерилизуют при высокой температуре в термостате или духовом шкафу при температуре не ниже 70°С. Герметизируют предметные стекла, заклеивая их в бумажные пакеты по 5-10 шт.
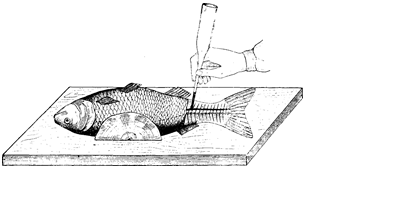
ВЗЯТИЕ КРОВИ Существует несколько методов взятия крови у рыб. Так, ее получают непосредственно из сердца с помощью шприца [11]. При этом инъекционную иглу, наклоненную в сторону головы, рекомендуется вводить по средней линии тела между грудными плавникам (рис.1). Из хвостовой артерии кровь берут иглой Франка. У сеголетков кровь получают из подкожной артерии также инъекционной иглой или пастеровской пипеткой. Прокол проводят в точке пересечения средней горизонтальной и вертикальной линии, идущей от передней части анального плавника (рис.2).
Рис. 1 Место введения иглы при взятии крови из сердца рыб по Кудрявцеву и др., 1969)
Рис. 2 Место прокола для получения крови и кроветворной ткани у рыб (по Кудрявцеву и др., 1969): 1- у сеголетков; 2- у рыб старшего возраста; 3 -место прокола для взятая кроветворной ткани у костистых рыб Рис. 3 Взятие крови у рыб.
У рыб старших возрастных групп кровь берут из хвостовой артерии. Иглу от шприца или пастеровскую пипетку вводят в точке пересечения средней продольной линии и линии, идущей перпендикулярно ей от задней границы анального плавника (см. рис. 2). Из жаберной и хвостовой артерии кровь забирают иглой от шприца или системы забора крови в зависимости от возраста рыбы. Позади анального плавника вытирают полотенцем покрывающую кожу слизь, в этом месте делают препаровальной иглой прокол кожи, в который вводят иглу или пастеровскую пипетку вглубь тканей под углом 45° по направлению несколько вперед к голове до встречи с позвоночным столбом. Здесь проходит ствол хвостовой артерии. Наклоненную вперед иглу вращают до поступления в нее крови. Во всех случаях полученную кровь переносят на часовое стекло, из которого ее берут микропипеткой для дальнейших анализов.
Кровь можно получить и путем отсечения хвостового стебля. Для прижизненного исследования кроветворной ткани рыб также используют шприц, снабженный прочной иглой с относительно широким просветом, или специальную иглу, применяемую в медицине для взятия костного мозга. У хрящевых и костных ганоидов кроветворные органы располагаются под крышей черепа над продолговатым мозгом в месте его перехода в спинной мозг. У костных рыб кроветворная ткань концентрируется в затылочной части черепа с внешней стороны. Так, у щуки кроветворные органы расположены от второго до шестого позвонка. В этой же области органы гемопоэза концентрируются у ряда различных представителей карповых и многих других костистых рыб. Они надежно защищены мышечной, соединительной и другими тканями. Полученную каплю пунктата помещают на предметное стекло. Препарат изготовляют и обрабатывают подобно мазку сосудистой крови.
Свойства крови в зависимости от способа ее взятия. Состав крови рыб различается в зависимости от способа ее взятия. При пункции сердца получают венозную кровь в конце ее полного круга обращения. Из жаберной артерии получают ту же кровь, что и из сердца, но после ее обогащения кислородом в жабрах и частичного освобождения от метаболитов. Кровь, взятая пастеровской пипеткой из гемального канала хвостового стебля, — это артериальная кровь вместе с некоторой примесью венозной; при этом разрушаются хвостовая артерия, хвостовая вена и сосуды хвостовой мускулатуры. При взятии крови путем отрезания хвостового стебля к ней примешивается тканевая жидкость, что может исказить показатели. Так, в крови, взятой у карпов путем отсечения хвоста, была выше активность глутама-токсало-ацетат-трансаминазы, лактатдегидрогеназы; выше содержание креатина, неорганического фосфора; ниже активность кислой фосфатазы. Не зависят от способа взятия крови содержание белка, глюкозы, мочевины, холестерина, креатинина, магния, активность глутамат-пируват-трансаминазы, щелочной фосфатазы, лейцин-аминопептидазы, амилазы, холинэстеразы. После взятия крови в количестве 1% от массы тела в плазме форели отмечено увеличение содержания калия и уменьшение общего белка, холестерина, фосфора, кальция, магния. Анализируемая кровь должна быть свежевыпущенной, жидкой. Для получения сравнимых результатов исследования необходимо проводить в сходных условиях. Общее количество крови у рыб варьирует от 1,1 до 7,3% [14].
Стабилизация крови, ее причины. Для предотвращения свертывания взятой крови применяют стабилизаторы. Кровь, лишенная способности свертываться, называется стабилизированной. Стабилизаторы устраняют ионы кальция и препятствуют образованию тромбина. При взятии крови для обработки инструментов используются следующие водные растворы: лимоннокислого натрия (цитрат) или щавелевокислого натрия (оксалат) - 0,2%-й, гепарин (антикоагулянт быстрого действия) — 1000 ЕД/мл. Гепарин используют для обработки гематокритных капилляров, и для этой же цели применяют раствор Геллера и Пауля: 1,2% оксалата аммония в смеси с оксалатом калия — 0,8%. Кроме того, можно применять с целью стабилизации раствор трилона Б. При получении плазмы кровь сразу же смешивают со стабилизатором из расчета на 100 мл крови 0,3 г цитрата или 0,15 оксалата, однако лучше пользоваться гепарином (примерно 0,01%). Можно проводить стабилизацию полученной крови посредством омывания пробирок несколькими каплями трилона Б с последующей их просушкой. При обработке рабочих игл гепарином непосредственно перед взятием крови, как правило, дополнительных средств для стабилизации не требуется. Сыворотку крови получают без стабилизации, когда образовался сгусток (фибрин + форменные элементы), путем ее отсасывания после отстаивания или центрифугирования. Сыворотка — это дефибринированная плазма. Быстрое отделение от клеточной массы — непременное условие максимального сохранения свойств плазмы (сыворотки). Для полного отделения форменных элементов крови от плазмы на обычных центрифугах достаточно центрифугирования в течение 10 мин при 3000 об/мин. Используются и другие режимы с учетом фактора разделения. Плазма имеет плотность 1,022-1,029 г/см3. Ее можно хранить несколько месяцев при температуре —20°С и до года при температуре –80°С, однако при повторном замораживании и оттаивании происходит денатурация и выпадение в осадок белка. Следует учитывать, что верхний слой сыворотки после оттаивания и центрифугирования не содержит белка, а в нижнем его в 1,5-2 раза больше, чем в не замороженной. Этим можно пользоваться для его концентрирования. Количество плазмы варьирует в зависимости от условий сезона. Гемолиз и выход содержимого эритроцитов в плазму (сыворотку) происходит при ряде отравлений и заболеваний, стрессе рыб, длительном (более суток) хранении сыворотки на сгустке крови в обычном холодильнике, а также небрежном взятии и обращении с кровью и по другим причинам. Гемолиз искажает результаты электрофореза (усиление в области -глобулинов) увеличивает значение общего белка при рефрактометрии; изменяет показатели электролитного состава вызывает (даже следы) повышенное содержание ферментов. Во избежание гемолиза кровь разбавляют физиологическими растворами - чаще изотоничными растворами хлористого натрия различных концентраций. Осмотическая резистентность эритроцитов (ОРЭ) такова, что в норме они выносят разбавление плазмы до солености, эквивалентной 0,33-0,39%-му раствору хлористого натрия.
|
||||||||||
|
Последнее изменение этой страницы: 2020-11-11; просмотров: 715; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.138.174.174 (0.011 с.) |