
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Это свойство материальных систем позволило в свою очередь определить целый ряд новых свойств материи.Стр 1 из 7Следующая ⇒
Все материальные системы, от самых малых до самых больших, считаются открытыми, обменивающимисяэнергией и веществом с окружающей средой и находящимися, как правило, в состоянии, далеком от термодинамического равновесия. Это свойство материальных систем позволило в свою очередь определить целый ряд новых свойств материи. Вот некоторые из них. - все процессы необратимы, так как они всегда сопровождаются потерями энергии; - энтропия S в открытых системах имеет две составляющие: deS – характеризует обмен энтропией с внешним миром; diS – характеризует необратимые процессы внутри; - материя обладает свойством самоорганизации 5) Классическая формула средней теплоёмкости. Под удельной теплоёмкостью вещества понимают количество теплоты, необходимое для нагревания единицы в-ва, чтобы изменить его температуру на 1 К.
С-удельная теплоемкость, Т1-Т2 диапазон температур. Холодильный цикл - термодинамический цикл, осуществляемый системой, которая передает тепло от тела с низкой температурой к телу с высокой температурой. Холодильная установка Совокупность одной или нескольких холодильных машин и всех узлов, агрегатов, элементов, трубопроводов и жидкостей, необходимых для их функционирования, а также распределения и использования холода и это к нему Аналитическое выражение 1 закона термодинамики. В каком случае теплота, работа и изменение внутренней энергии считаются положительными. А когда – отрицательными. Первый закон термодинамики представляет собой закон сохранения и превращения энергии для термодинамических систем. Он устанавливает количественную связь между изменением внутренней энергии системы и внешними воздействиями на нее. Любая форма движения способна и должна превращаться в любую другую форму движения. Теплота и работа – это две единственные возможные формы перехода энергии от одного тела к другому. q = Если теплота сообщается рабочему телу, то dq>0; если же теплота отнимается от рабочего тела, то dq < 0. При расширении газа, т.е. когда он совершает работу по преодолению сил внешнего сопротивления, dl > 0; при сжатии газа конечный объем его меньше начального, а на это затрачивается работа из вне и dl < 0. Изменение внутренней энергии
Истечение. газов. Истечение. газов следует тем же основным законам, что и Истечение. жидкостей; но в случае газов мы имеем дело с веществом, объем и плотность которого зависят от давления, поэтому нельзя, как в случае жидкостей, считать среду несжимаемой. И. всегда происходит под влиянием разности давления, а следовательно, истекающая струя газа, попадающая в среду с меньшим давлением, занимает больший объем, расширяется. Расширение же газа всегда сопровождается охлаждением его, охлаждение же зовет за собой опять изменения в объеме, плотности и давлении. Ввиду этого решение общих задач об И. газов представляет вопрос весьма сложный и одну из самых трудных глав аэродинамики — науки о движениях газов; полное рассмотрение вопросов И. газов должно было бы вестись не только на основании принципов гидродинамики, но и на основании механической теории тепла и кинетической теории газов. Если пренебречь охлаждением газа от расширения и действием силы тяжести, то для скорости V истечения газа, под влиянием одной разности давления, получим формулу, аналогичную формуле (2):
где a — постоянная Мариоттова зак. (см. Газы), p 0, q 0 и ω0 — давление, сечение и плотность для сосуда, из которого истекает газ, p 1, q 1 и ω1 — те же величины для места наименьшего сечения струи. Более простое выражение для V получим из формулы Торричелли, применив ее к газам:
При течении по трубам законы И. для газов те же, что и для жидкостей; скорость И. замедляется и выражается уже формулой
где d — диаметр трубки, l — длина трубки, а
где p выражено в давлении ртутного столба. При И. газов из волосных трубок они следуют, как и жидкости, закону Пуазейля. И. газов из волосных трубок пользуются для определения внутреннего трения их. При И. газы образуют струи, представляющие все особенности жидких струй — реакцию (ракеты, отдача от выстрелов), удар струи и т. д. (см. Струя). При действии мгновенных сил И. газов происходит в виде вихря (при взрывах, при образовании фосфористого водорода и т. д.). Теория И. газов весьма важна для техники — газопроводного дела, устройства пневматической передачи, воздуходувных приборов, вентиляционных и дымовых труб; в науке она важна для теоретической метеорологии (ветры). Значительные математические трудности замедляют пока полную разработку вопросов об И. газов и паров. 17) Анализ политропных процессов по энергетическим показателям (∆U, q, l) Политропный – процессы, в кот. теплоемкость имеет любое, но постоянное на протяжении всего процесса значение. P *
Изменение энтропии: Энтропия является функцией состояния. Ее изменение в пределах процесса определяется как разность конечного и начального значений. Энтропия, и ее изменение не поддается физическому определению и измерению, а является расчетной величиной.
Работа расширения /сжатия в политропном процессе: Количество теплоты: Внутренняя энергия термодинамической системы зависит от температуры рабочего тела:
Энтальпия представляет собой сумму внутренней энергии тела и работы, которую необходимо затратить, чтобы тело объемом V ввести в окружающую среду, имеющую давление p и находящуюся c телом в равновесном состоянии:
18 Цикл Ренкина - термодинамический цикл преобразования тепла в работу с помощью водяного пара КПД цикла Термодинамические исследования цикла Ренкина показывают что его эффективность в большей степени зависит от величин начальных и конечных параметров (давления и температуры) пара.
Процессы
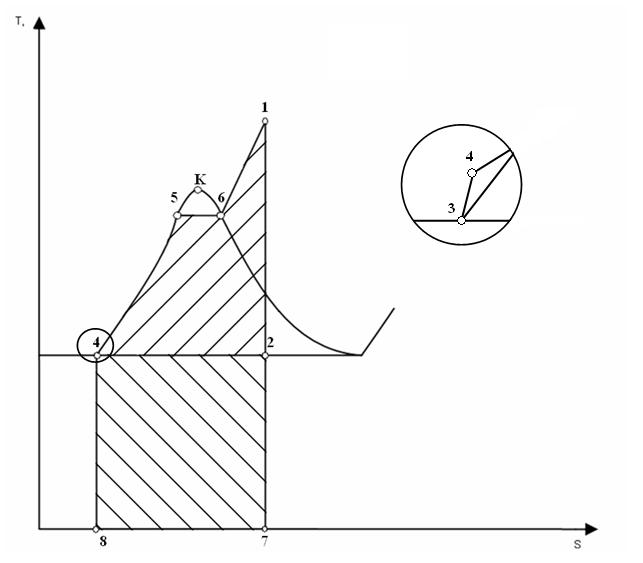
Диаграмма T-S Цикл Ренкина состоит из следующих процессов: изобара линия 4-5-6-1. Происходит нагрев и испарение воды, а затем перегрев пара. В процессе затрачивается теплота q 1. адиабата линия 1-2. Процесс расширения пара в турбине, то есть её вращение паром ( изобара линия 2-3Конденсация отработанного пара с отводом теплоты q 2 охлаждающей водой. адиабата линия 3-4. Сжатие сконденсировавшейся воды до первоначального давления в парогенераторе с затратой работы Применение Цикл Ренкина нашёл применение в современных тепловых электростанциях большой мощности использующих в качестве рабочего тела водяной пар (такие электростанции называют конденсационными или КЭС). Обратный цикл Ренкина При прохождении цикла Ренкина в обратном направлении (1—6—5—4—3—2—1) он описывает рабочий процесс холодильной машины с двухфазным рабочим телом (т.е. претерпевающим в ходе процесса фазовые переходы от газа к жидкости и наоборот). Холодильные машины, работающие по этому циклу, с фреоном в качестве рабочего тела широко используются на практике в качестве бытовых холодильников, кондиционеров и промышленных рефрижераторов с температурой морозильника до -40°C.
20. Теплопроводность — это молекулярный перенос теплоты между непосредственно соприкасающимися телами или частицами одного тела с различной температурой, при котором происходит обмен энергией движения структурных частиц (молекул, атомов, свободных электронов). При выводе дифференциального уравнения теплопроводности считаем, что тело однородно и изотропно (то есть физические свойства тела не зависят от выбранного в нём направления), физические параметры l, с (теплоемкость), и r (плотность) постоянны, внутренние источники теплоты равномерно распределены в теле. Под внутренними источниками теплоты понимаются тепловыделения, например, в тепловыделяющих элементах атомных реакторов, или при прохождении тока в электрических проводниках. Внутренние источники теплоты характеризуются величиной qv — количеством теплоты, которое выделяется в единице объема в единицу времени. Величину Существуют различные условия однозначности: геометрические — характеризующие форму и размеры тела, в котором протекает процесс теплопроводности; физические — характеризующие физические свойства тела; временные — характеризующие распределение температуры тела в начальный момент времени; граничные — характеризующие взаимодействие тела с окружающей средой. Граничные условия в свою очередь бывают трех родов:
1) первого рода, задается распределение температуры на поверхности тела в функции времени;
2) второго рода, задается плотность теплового потока для всей поверхности тела в функции времени;
3) третьего рода, задаются температура окружающей среды tж и закон теплоотдачи между поверхностью тела и окружающей средой — закон Ньютона—Рихмана:
21. Классиф-я циклов: циклы тепловых двигателей и холодильных машин. Осн. Условия преобразования теплоты в работу. Простейший способ получения температуры раб. тела ниже температуры окружающей среды зак-ся в том, что это рабочее тело, называемой иначе хол. агентом (хладагентом), сжимают в компрессоре, затем охлаждают до температуры окружающей среды и после этого заставляют адиабатически расширяться. При этом рабочее тело совершает работу засчет своей внутренней энергии и тем-ра его умен-ся по сравнению с тем-рой окр. среды, т.е. такое рабочее тело становиться источником получения холода. В хол.установках применяют пары легкокипящих жидкостей высокой степени влажности, поэтому для них неприменимы законы для идеальных газов. Аналит. зав-сть м/у параметрами для этих паров также сложны, как и для водяного пара, когда он рассматривается как реальный газ. Идеальным циклом для хол.установки явл. обратный цикл Карно. В компрессоре вследствие затраты мех. энергии сжимается влажный пар хладоагента. В рез-те этого получается сухой насыщенный или перегретый пар. Обычно степень перегрева не превышает 130-140С. Из компрессора (для паровых компрессорных хол. установок) перегретый пар с параметрами p2и t2 поступает в охладитель (конденсатор). В нем при постоянном давлении перегретый пар отдает охлаждающей воде теплоту перегрева, тем-ра его становится равной тем-ре насыщения tH2.Отдавая в дальнейшем теплоту парообразования, насыщенный пар превращается в кипящую жидкость. Эта жидкость поступает к дроссельному вентилю, пройдя ч/з кот. Она превращается в насыщенный пар небольшой степени сухости. Пар с параметрами состояния, характеризуемыми точкой в начальном состоянии, засасывается в компрессор, и работа установки повторяется. Показателем энерг.эффективности хол.установой служит хол. коэфициент, представляющий собой отношение удельной холодопроизводительности к внешней работе цикла:
В зав-ти от способа подвода теплоты к рабочему телу все существующие тепловые двигатели делят на двигатели внешнего и внутреннего сгорания. К 1гр.относятся такие тепловые двигатели, у кот. Подвод теплоты к рабочему телу, т.е. процесс сгорания, оущ-ся вне самого двигателя (паровые турбины). Для них раб. телом служит водяной пар, получаемый в кот. установках и подаваемый к соплам рабочих колес турбины или в парораспределительное устройство паровых машин. Ко 2гр. относятся такие двигатели, в кот. подвод теплоты к раб. телу осущ-ся при непосредственном сжигании топлива в смеси с необход. кол-вом коздуха внутри самого двигателя. В рез-те хим. соед-я горючих частей топлива и кислорода воздуха образуется продукты сгорания топлива – газовая смесь, кот. и явл. раб. телом в д.в.с. По существу в д.в.с. не происходит круговых процессов, т.к. газообразные продукты горения после расширения и отдачи с помощью поршня энергии на коленчатый вал удаляются из цилиндра двигателя, а на их место поступает свежая порция горючей смеси, хим. состав кот. в рез-те последующего процесса сгорания меняется. Однако условно можно говорить о круговом процессе работы д.в.с., если не принимать в расчет хим. изменений и определять его КПД по формуле
23) Второй закон термодинамики. Осн. формулировки. Второе начало термодинамики — физический принцип, накладывающий ограничение на направление процессов передачи тепла между телами. Этот закон устанавливает особенность превращения теплоты в работу в тепловых двигателях. Второе начало термодинамики запрещает так называемые вечные двигатели второго рода, показывая невозможность перехода всей внутренней энергии системы в полезную работу. Существуют несколько эквивалентных формулировок второго начала термодинамики: Вечный двигатель 2-го рода можно осуществить, если теплоту Q2 передать от холодного источника к горячему. Но для этого теплота самопроизвольно должна перейти от холодного тела к горячему, что невозможно. Отсюда следует 2-я формулировка (Клаузиуса):"Теплота не может самопроизвольно переходит от более холодного тела к более нагретому". Для работы теплового двигателя необходимы 2 источника – горячий и холодный. 3-я формулировка (Карно): "Там где есть разница температур, возможно совершение работы". Фор-ка Больцмана: «Все естественные процессы в природе идут в направлении равновесия с окружающей средой».
24. в учебнике стр 182 25. Обратимый процесс (то есть равновесный) — термодинамический процесс, который может проходить как в прямом, так и в обратном направлении, проходя через одинаковые промежуточные состояния, причем система возвращается в исходное состояние без затрат энергии, и в окружающей среде не остается макроскопических изменений. Обратимый процесс можно в любой момент заставить протекать в обратном направлении, изменив какую-либо независимую переменную на бесконечно малую величину. Обратимые процессы дают наибольшую работу. Бо́льшую работу от системы вообще получить невозможно. Это придает обратимым процессам теоретическую важность. На практике обратимый процесс реализовать невозможно. Он протекает бесконечно медленно, и можно только приблизиться к нему. Следует отметить, что термодинамическая обратимость процесса отличается от химической обратимости. Химическая обратимость характеризует направление процесса, а термодинамическая — способ его проведения. Понятия равновесного состояния и обратимого процесса играют большую роль в термодинамике. Все количественные выводы термодинамики применимы только к равновесным состояниям и обратимым процессам. 26)основные виды теплообмена. Теория теплообмена представляет собой науку, которая изучает законы распространения и передачи теплоты м/у телами в пространстве. Теплообмен - самопроизвольный процесс переноса внутренней энергии от тел с большей температурой к телам с меньшей температурой. Различают три элементарных вида теплообмена: теплопроводность, конвекцию и тепловое излучение (радиация). Теплопроводность - это процесс переноса теплоты м/у непосредственно соприкасающимися телами или частями одного итого же тела. Она обусловлена тепловым движением и энергетическим взаимодействием структурных частиц (молекул, атомов, электронов). Конвекция наблюдается в жидкостях (в теории теплообмена под термином «жидкость» понимают любую среду, имеющую текучесть - собственно жидкости, газы, расплавленные металлы). Перенос теплоты в жидкостях происходит просто за счет перемешивания объемов с различной температурой. Тепловым излучением наз. явление переноса теплоты в виде электромагнитных волн или фотонов, возникающих в результате сложных молекулярных и атомных возмущений. При тепловом излучении происходит двойное превращение энергии: внутренняя энергия излучающего тела переходит в лучистую и обратно - лучистая энергия, поглощаясь телом, переходит во внутреннюю энергию. Элементарные виды теплообмена в отдельности на практике встречаются редко, а действуют, как правило, в каком либо сочетании. Различают следующие сложные виды теплообмена. Совместный процесс конвекции и теплопроводности называется конвективным теплообменом. Частный случай конвективного теплообмена, когда теплообмен происходит между жидкостью и поверхностью твердого тела называется конвективной теплоотдачей или просто теплоотдачей. Совокупность значений температуры для всех точек пространства в данный момент времени наз. температурным полем, t=f(x,y,z,τ). Уравнение явл. математическим выражением такого поля. При этом, если t-ра меняется во времени, поле называется нестационарным, а если не меняется —стационарным. Т-ра может быть функцией одной, двух и трех координат. Соответственно этому и температурное поле называется одно-, двух- и трехмерным. Наиболее простой вид имеет уравнение одномерного стационарного температурного поля: t = t(x). При любом температурном поле в теле всегда имеются точки с одинаковой t-рой. Геометрическое место таких точек образует изотермическую поверхность. Тепловой поток. Количество теплоты, переносимое ч/з какую-либо изотермическую пов-ть в ед. времени, наз. тепловым потоком Q, Вт. Тепловой поток, отнесенный к ед. площади изотермической пов-ти, наз. плотностью теплового потока q, Вт/м2.
27. Теорема о возрастании энтропии. В термодинамике и кинетической теории, H-теорема, полученная Больцманом в 1872 году, описывает возрастание энтропии идеального газа в необратимых процессах, исходя из уравнения Больцмана. На первый взгляд может показаться, что она описывает необратимое возрастание энтропии исходя из микроскопических обратимых уравнений динамики. В свое время этот результат вызвал бурные споры. Величина H определяется как интеграл по пространству скоростей:
где P(v) — вероятность. В некотором смысле H является предшественником Шенноновской информационной энтропии[источник не указан 252 дня]. Используя уравнение Больцмана, можно показать, что H не может возрастать. Для системы из N статистически независимых частиц, H соотносится с термодинамической энтропией S посредством:
таким образом, согласно H-теореме, S не может убывать. Однако Лошмидт выдвинул возражение, что невозможно вывести необратимый процесс из симметричных во времени уравнений динамики. Решение парадокса Лошмидта заключается в том, что уравнение Больцмана основано на предположении «молекулярного хаоса», то есть для описания системы достаточно одночастичной функции распределения. Это допущение по сути и нарушает симметрию во времени.
28. в учебнике стр 294
29. Максимальная работоспособность системы. Эксергия – это максимальная работа, которую может выполнить рабочее тело с параметрами V1,T1,P1,u1.
Для анализа термодинамических процессов используют КПД эксергии. КПД эксергии: ἠ=l окруж./l максим
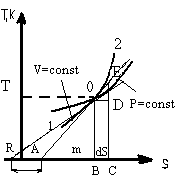
Св-ва диаграммы: (sb-Sa)T=dF=dS*T=Δq; Δq=dST. 1) Площадь под кривой процесса равна количеству подведенной или отведенной теплоты в процессе. AOB подобен EOD; AB/OB=OD/ED, следовательно АВ=(OD*BO)/ED; OD=dS; BO=T; DE=dT; m=(dS*T)/dT=Δq/dT=C. AB-подкасательная, дает теплоемкость в точке, через которую проведена касательная. Δq=dh-Vdu; CpdT=CvdT+pdV; PV=RT; pdV=RdT; CpdT=CvdT+RdT; Cp=Cv+R; 2)Изохора в TS диаграмме, проведенная из какой либо точки О, идет более круче, чем изобара, проведенная через эту же точку.
30. влажный воздух. Анализ процесса сушки в I - d диаграмме. Атмосферный воздух, сост из кислорода, азота, угл. газа и небольшого кол-ва инертных газов (аргон, неон, гелий, ксенон и криптон), всегда сод-т некоторое кол-во водяного пара. Мех. смесь сухого воздуха с водяным паром – вл. воздух. (воздушно0паровая смесь). При атмосферном давлении в интервале тем-р, огран. снизу тем-рой обычно не ниже -50С, сухой воздух может быть только в газообразном сост-и, тогда как вода встречается в виде пара, жид-ти или тв. фазы в зав-ти от тнм-р смеси и может выпадать из смеси. Поэтому кол-во водяного пара в смеси с сухим воздухом не может превышать опред. вел-ы – в этом и состоит принципиальное отличие вл. воздуха от обычных газовых смесей. B= pв+рп, где В-барометр.давление, pв и рп – Диаграмма строится для барометрич. давления 98 кПа. На оси абцисс откладывают влагосодержание воздуха d, а на оси ординат – энтальпию I. В области ненасыщенного воздух в соотв-и с урав-м I=iв+diп изотермы явл. прямыми линиями, угловой коэф-т кот. выражается уравнением
Энтальпия. H=U+pV если m не равна 1кг. h=u+pv если m = 1кг. U-внутр.энергия. р-абсолютное давление, V-объем. V-удельный объем. Энтальпия является функцией внутренней энергии и термических параметров состояния и поэтому сама является функцией состояния. Δq=du+Δe; Δq=du+pdv; v=const; du=0; Δq=du; Cv*dT=du. Не смотря на то что формула изменения внутр.энергии выведена для изохорного процесса она справедлива для любого другого, т.к. внутр.энергия является функцией состояния. H=u+pv; dh=du+pdv+vdp; Δq=dh-vdp-вторая форма записи 1 з-на термодинамики. -vdp=ΔL0-располагаемая работа. р=const; dp=0; Δq=dh; Δq=CpdT; dh=CpdT. Не смотря на то что зависимость выведена для изобарного процесса она справедлива и для других процессов. 50.Термодинамические основы получения холода. Согласно второму началу термодинамики, указанный выше перенос теплоты самопроизвольно не происходит, требуя затрат работы. В термодинамич. процессах подвод или отвод теплоты q описывается через изменение энтропии dS системы: dq = TdS, где Т - т-ра. Отсюда следует, что при подводе к телу теплоты его энтропия возрастает, а при отводе теплоты -уменьшается. В непрерывных холодильных процессах хладагент должен принять теплоту от охлаждаемого тела на ниж. температурном уровне, отдать теплоту на верх. уровне к.-л. теплоприемнику и вернуться в исходное состояние. Поэтому в установившемся процессе суммарная энтропия хладагента не изменяется (dS=0). В учебнике стр 213-214. 52. Энтропия рабочего тела. Одним из функций состояния термодинамической системы является энтропия. Энтропией называется величина определяемая выражением:dS = dq / T. [Дж/К] или для удельной энтропии:ds = dq / T. [кДж/(кг·К)] Так как энтропия не зависит от вида процесса и определяется начальными и конечными состояниями рабочего тела, то находят только его изменение в данном процессе, которые можно найти по следующим уравнениям: Ds = cv·ln(T2/T1) + R·ln(υ 2/υ 1); Если энтропия системы возрастает (Ds > 0), то системе подводится тепло. Все материальные системы, от самых малых до самых больших, считаются открытыми, обменивающимисяэнергией и веществом с окружающей средой и находящимися, как правило, в состоянии, далеком от термодинамического равновесия. Это свойство материальных систем позволило в свою очередь определить целый ряд новых свойств материи. Вот некоторые из них. - все процессы необратимы, так как они всегда сопровождаются потерями энергии; - энтропия S в открытых системах имеет две составляющие: deS – характеризует обмен энтропией с внешним миром; diS – характеризует необратимые процессы внутри; - материя обладает свойством самоорганизации 5) Классическая формула средней теплоёмкости. Под удельной теплоёмкостью вещества понимают количество теплоты, необходимое для нагревания единицы в-ва, чтобы изменить его температуру на 1 К.
С-удельная теплоемкость, Т1-Т2 диапазон температур.
|
|||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2020-10-24; просмотров: 131; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.117.216.229 (0.079 с.) |

 + l*, для идеальных газов l* = l
+ l*, для идеальных газов l* = l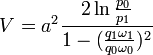 ,
,
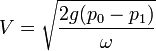 .
.
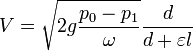
 — величина, характеризующая трение воздуха о стенки трубки. По Вейсбаху,
— величина, характеризующая трение воздуха о стенки трубки. По Вейсбаху, 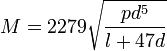 ,
,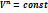 -уравнение состояния.
-уравнение состояния.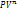 =const – Ур-е политропного (обобщающего) процесса, где
=const – Ур-е политропного (обобщающего) процесса, где 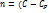 )/(
)/(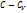 ) – показатель полит.процесса.
) – показатель полит.процесса.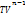 =const
=const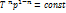 – соотношения м/у параметрами T и υ, p и T.
– соотношения м/у параметрами T и υ, p и T.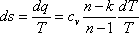 ;
; 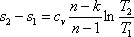
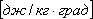 ;
;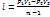 ;
;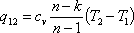 , q – удельное количество теплоты.
, q – удельное количество теплоты.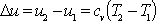 ;
;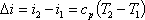 ;
;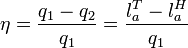

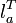 ).
).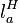 .
.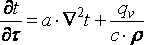
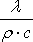 называют коэффициентом температуропроводности и обозначают буквой a.
называют коэффициентом температуропроводности и обозначают буквой a.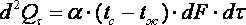
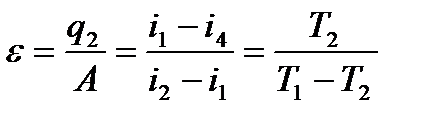
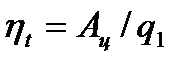 , где Ац – работа и q1 – расход тепла.
, где Ац – работа и q1 – расход тепла. 
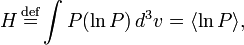
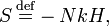
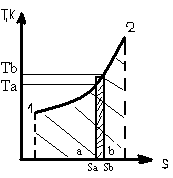 35. Диаграмма T - S. В этой диаграмме проводят анализ термодинамических процессов с целью выяснения энергетических возможностей каждого из процессов для определения и использования их в различных энергетических устройствах.
35. Диаграмма T - S. В этой диаграмме проводят анализ термодинамических процессов с целью выяснения энергетических возможностей каждого из процессов для определения и использования их в различных энергетических устройствах.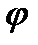 ) – отношение абс. влаж-ти ненасыщ. возхуха при дан. тем-ре к абс. влаж-ти насыщ. воздуха при той же тем-ре.
) – отношение абс. влаж-ти ненасыщ. возхуха при дан. тем-ре к абс. влаж-ти насыщ. воздуха при той же тем-ре. 
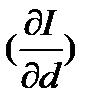 =2500+1,96t и представляет собой для каждой изотермы постоянную величину. С ростом тем-ры наклон изотерм увел-ся. Для удобства пользования диаграмму заменяют косоугольной с углом между абцисс и ординат 1350. При этом изотерма 0С в ненасыщ. области располагается горизонтально. Затем наносят кривую парциального давления водяного пара, используя урав-е рп=Вd/(0,622+d), d=0, рп=0 при d=d1, рп= рп1. Задаваясь опред. масштабом для парциальных давлений, в нижней части диаграммы в прямоугольной системе осей ординат по укуз. точкам строят кривую рп=f(d). После этого на диаграмме наносят линии
=2500+1,96t и представляет собой для каждой изотермы постоянную величину. С ростом тем-ры наклон изотерм увел-ся. Для удобства пользования диаграмму заменяют косоугольной с углом между абцисс и ординат 1350. При этом изотерма 0С в ненасыщ. области располагается горизонтально. Затем наносят кривую парциального давления водяного пара, используя урав-е рп=Вd/(0,622+d), d=0, рп=0 при d=d1, рп= рп1. Задаваясь опред. масштабом для парциальных давлений, в нижней части диаграммы в прямоугольной системе осей ординат по укуз. точкам строят кривую рп=f(d). После этого на диаграмме наносят линии 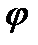 =const. Кривая насыщения разделяет диаграмму на верхнюю область влажного ненасыщ. воздуха и нижнюю область пересыщ. воз-а, в кот. влага может нах-ся в капельном сост-и. Одновременно она показывает макс. возможное насыщение воздуха влагой при данной тем-ре.
=const. Кривая насыщения разделяет диаграмму на верхнюю область влажного ненасыщ. воздуха и нижнюю область пересыщ. воз-а, в кот. влага может нах-ся в капельном сост-и. Одновременно она показывает макс. возможное насыщение воздуха влагой при данной тем-ре.


