
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Первое начало термодинамики как математическоеСтр 1 из 3Следующая ⇒
Работа. Количественное выражение элементарной работы δL в общем виде определяется как произведение проекции Fs силы F на элементарное перемещение точки приложения силы (рис. 3.4).
Рис. 3.4. Определение элементарной работы
Работа есть эффект перемещения силы, она зависит от вида процесса. Следовательно, выражение элементарной работы не является полным дифференциалом и знак δ как общий символ бесконечно малых величин указывает на это. Рассмотрим работу в цилиндре поршневой машины. Элементарная работа сжимаемых тел определяется в зависимости от давления и изменения объема: Fs=P×f; dS=1/f×dV; dL=Fs×dS=P×f×(1/f)×dV=P×dV; dL=P×dV. (3.13) Работу изменения объема называют термодинамической работой (рис. 3.5). Эта работа в P-V координатах определяется площадью, ограниченной линией процесса и координатами точек начала и конца процесса. Работа считается положительной (L1,2>0), если система совершает ее над внешними телами, т. е. при dV>0, и отрицательной (L1,2<0), если внешние тела совершают работу над системой, т. е. при dV<0 (рис. 3.6).
Рис. 3.5. Определение термодинамической Рис. 3.6. Графическое изображение работы термодинамической работы
Часто в термодинамике оперируют понятием удельной термодина-мической работы, т. е. работы изменения объема, отнесенной к 1 кг: d l =1/G×dL=1/G×P×dV=P×du, l 1,2= Интегральное определение полной L1,2 и удельной l 1,2 термодинамической работы возможно лишь при наличии уравнений связи между давлением и объемом: j (P, V)=0; j (P, υ)=0. Эффективная работа реального процесса (dL*, d l *) определяется как разность между обратимой работой изменения объема (dL, d l) и работой необратимых потерь (dL**, d l **). dL*=dL-dL**; d l *=d l -d l **. (3.15) Работа, потерянная в необратимых процессах, превращается в теплоту внутреннего теплообмена.
Рис. 3.7. К определению потенциальной работы Потенциальная работа (W1,2) — работа по обратимому перемещению жидкостей, паров и газов из области одного давления Р1 в область другого давления Р2. Слагаемые потенциальной работы по перемещению газа из области давления Р1 в область давления Р2 изображены на схеме 3.7.
Основные условные слагаемые потенциальной работы — это наполнение LI, расширение (сжатие) LII и выталкивание LIII.
Рис. 3.8. Этапы совершения потенциальной работы
dW = -V×dP. (3.17) Элементарная удельная потенциальная работа: dw = (1/G)×dW = -u×dP. (3.18) Потенциальная работа имеет положительный знак при перемещении жидкости или газа из области большего давления в область меньшего давления (Р1>Р2) и наоборот, т. е. при расширении положительна, при сжатии — отрицательна. Как и термодинамическая работа, потенциальная измеряется площадью в P-V координатах (рис. 3.8).
аналогично, для удельной потенциальной работы:
При вычислении интегральной величины потенциальной работы, как и при вычислении интегральной термодинамической работы, необходимо иметь уравнение процесса изменения состояния вещества j (P, V)=0, или j1 (P, u)=0 для удельной потенциальной работы. Потенциальная работа dW, dw — это сумма эффективной работы dW* и работы необходимых потерь dW**. dW=δW*+δW**; соответственно, dw=dw*+dw**. Потенциальная работа необратимых потерь dW* превращается в теплоту внутреннего теплообмена. Эффективная потенциальная работа dW*=dW-dW** непосредственно передается телам внешней системы dLc* и используется для изменения внутренней энергии внешнего положения рабочего тела dEcz. dW*=dEc*+dEcz. (3.21) Газовые смеси Смесь представляет собой систему тел, химически не взаимодействующих между собой. Структура отдельных компонентов смеси в процессах смесеобразования и стабилизации смеси не изменяется. Различают два основных способа задания смеси: весовыми (массовыми) и мольными (объемными) концентрациями. Весовая (массовая) концентрация смеси mi представляет собой отношение стандартного веса или массы компонента к стандартному весу или массе всей смеси:
Мольная (объемная) концентрация ri есть величина отношения количества молей компонентов
ri=
Количество молей компонента Молекулярный (кажущийся) вес смеси равен в зависимости от способа задания смеси: через объемные доли:
через массовые доли:
Пересчет весовых и объемных концентраций можно осуществить из уравнения: mi/ri=mi/mm; mi/ri=mi/mm=Rm/Ri, где Rm — газовая постоянная смеси Rm=
Давление смеси представляет собой сумму давлений компонентов, входящих в смесь Законы идеальных газов Идеальным газом является газ, подчиняющийся уравнению Клапейрона при любых плотностях и давлениях. 1. Закон Бойля — Мариотта (1622 г.). Если температура газа постоянна, то давление газа и его удельный объем связаны зависимостью: P1u1=P2u2=idem, или u2/u1=P1/P2. (3.25) 2. Закон Гей — Люссака (1802 г.). При постоянном давлении объем газа при нагревании изменяется прямо пропорционально повышению температуры: u=u0(1+at), (3.26) где u — удельный объем газа при температуре t°C, u0 — удельный объем газа при температуре t=0°С, a — температурный коэффициент объемного расширения идеальных газов при t=0°C одинаковый для различных газов и сохраняющий одно и то же значение: a=1/273,16=0,00366 1/°С. 3. Закон (уравнение) Клапейрона (1834 г.). Сопоставление законов Бойля — Мариотта и Гей — Люссака приводит к уравнению состояния идеальных газов: u=u0(1+at)=const/P=a×const/P(1/a+t); 1/a+t=T; a×const=R; T=273,16+t°C; Pu=RT; PV=GRT=MRT, (3.27) где R — газовая постоянная идеального газа. Представляет собой удельную работу газа в изобарном процессе (P — idem) при изменении температуры газа на 1°С. 4. Закон Авогадро (1811 г.). Объем киломоля идеального газа (
Объем 1 кмоля идеального газа в нормальных физических условиях (температура 0°С, давление 101,325 кПа)
Уравнение Клапейрона для одного кмоля идеального газа имеет вид
тогда mR не зависит от природы газа и в силу этого называется универсальной газовой постоянной:
Удельные газовые постоянные газов R определяются по значению их молярной массы:
Таким образом, уравнение состояния идеального газа (уравнение Клапейрона) может быть записано в следующих видах: для 1 кг газа Pu=RT, для G кг газа PV=GRT, для 1 кмоля газа (уравнение Клапейрона — Менделеева)
для Первое начало термодинамики Понятие теплоёмкости Теплоемкостью называется отношение количества тепла по балансу рабочего тела к изменению температуры этого тела в рассматриваемом процессе (z), включающем внешний и внутренний теплообмен.
Величина qz в уравнении зависит не только от интервала температур t2 — t1, но и от вида процесса подвода теплоты. Индекс z обозначает тот параметр, который сохраняется постоянным в данном процессе. В термодинамике обычно пользуются понятием теплоемкости при Р=idem и u=idem. u=idem
P=idem Различают теплоемкость массовую, мольную и объемную: массовая теплоемкость: Cz Дж/(кг×К); мольная теплоемкость: объемная теплоемкость: средняя теплоемкость: Сzm Если Сz является линейной функцией от температуры, то Cz=a0+ +a1×tma, т. е. Сzm=Cz(tma). Например, в (h, t) координатах при P=idem (рис. 3.9): Сp=tgj=
Рис. 3.9. Определение массовой тепло- емкости при постоянном давлении Если теплоемкость не является линейной функцией от температуры, то осреднение производится известными методами Гаусса, Чебышева, Ньютона. В случае смеси идеальных газов в расчетные соотношения термодинамики входит теплоемкость смеси.
Рис. 3.10. Схемы смешения при постоянном объеме и давлении Различают две схемы смешения: при V=idem и P=idem (рис. 3.10). При V=idem смешение осуществляется при неизменном уровне внутренней энергии, а при P=idem — при неизменном уровне энтальпии. На основании I начала термодинамики определяется средняя температура смеси:
где
Закон Майера Для идеальных газов справедливо утверждение, что внутренняя энергия U и энтальпия h являются функциями только одной температуры (закон Джоуля): U=u(t); h=u+P×u=u(t)+RT=h(t). (3.43) В этих условиях упрощаются выражения теплоемкости: u=idem CV=(¶u/¶t)V=dU(t)/dt=CV(t); P=idem Cp=(¶h/¶t)p=dh(t)/dt=Cp(t); dU=CV×dt; dh=Cp×dt. Тогда первое начало термодинамики для идеального газа по балансу рабочего тела: dq=dq*+dq**=CV×dt+P×du=Cp×dt-u×dP. (3.44) Из этого соотношения следует закон Майера, устанавливающий равенство между разностью теплоемкостей Ср и Сu и удельной газовой постоянной R.
Сp-CV=R. (3.45) Для молярных теплоемкостей:
Термодинамические процессы Круговые процессы (циклы) Холодильного коэффициента Тепловыми машинами в термодинамике называют тепловые двигатели и холодильные машины. Тепловым двигателем принято называть непрерывно действующую систему, осуществляющую прямые круговые процессы (циклы), в которых теплота превращается в работу. В холодильных машинах, работающих по обратному круговому циклу, за счет подводимой извне работы осуществляется перенос теплоты от тела с низшей температурой к телу с высшей температурой.
Круговыми процессами или циклами тепловых машин называют непрерывную последовательность термодинамических процессов, в результате которых рабочее тело возвращается в исходное состояние. Прямой термодинамический цикл — когда к рабочему телу подводится большее количество теплоты при большей температуре и отводится меньшее количество теплоты при более низкой температуре, разность же этих теплот равна совершенной работе. Обратный термодинамический цикл — когда к рабочему телу подводится меньшее количество теплоты при меньшей температуре, а отводится большее количество теплоты и при более высокой температуре, разность этих теплот равна затраченной работе. Итоговое изменение любой функции состояния рабочего тела z в круговом процессе будет равно нулю.
По внешнему балансу теплоты и работы из первого начала термодинамики для кругового цикла
В цикле теплового двигателя от «горячего источника» с температурой t1 отбирается теплота Q1* (рис. 1.13). Холодному источнику с температурой t2 отдается теплота Q2*, а разность этих теплот Q1*-Q2* превращается в полезную работу L*>0. На пути 1 в 2 идет работа расширения газа, определяемая площадью е1 в 2d при подводе Q1* теплоты. На пути 2с1 идет работа сжатия, определяемая площадью е1с2d при отводе Q2* теплоты. Площадь 1b2с характеризует работу L*, которая отдается внешнему потребителю. Работа расширения при этом всегда больше работы сжатия.
Рис. 3.13. Произвольные циклы тепловых машин в P-V координатах Качественной характеристикой тепловых двигателей является термический коэффициент полезного действия ht (отношение полученной работы к затраченному количеству тепла):
В цикле холодильной машины осуществляется перенос теплоты от источника низшей температуры t2 к источнику высшей t1. Циклы холодильных машин называют обратными, в отличие от циклов тепловых двигателей, которые называют прямыми. Качественной характеристикой холодильных машин является холодильный коэффициент c, определяемый как отношение количества теплоты, отводимой от источника низших температур Q2*, к подведенной извне работы L*.
Цикл Карно В 1824 г. французский инженер Карно, исследуя эффективность работы тепловых машин, предложил обратимый цикл, состоящий из 2-х адиабат и 2-х изотерм и осуществляемый между двумя источниками постоянных температур — нагревателем Т1 и холодильником Т2 (рис. 3.14). В качестве рабочего тела используется идеальный газ. В процессе 1-2 к рабочему телу с температурой Т1 подводится теплота от горячего источника, также имеющего температуру Т1. Рабочее тело (газ) расширяется, совершая полезную работу, например, перемещая поршень машины из точки 1 в точку 2. При этом температура на участке 1-2 все время остается неизменной за счет подвода теплоты, несмотря на величины объема и снижения давления. В точке 2 подвод теплоты к рабочему телу заканчивается и дальнейшее расширение рабочего тела осуществляется по адиабате 2-3, т. е. при полной тепловой изоляции рабочего тела от внешней среды. При этом температура рабочего тела снижается до Т2, равной температуре холодного источника. В точке 3 рабочее тело начинает сжиматься по изотерме Т2 (линия 3-4), причем при этом температура остается постоянной за счет отвода теплоты к холодному источнику. В точке 4 отвод теплоты прекращается и дальнейшее сжатие газа происходит по адиабате 4-1 с повышением температуры до Т1. В точке 1 цикл замыкается. Для холодильных машин, работающих по циклу Карно, расположение процессов аналогично рассмотренному, но направление самих процессов будет противоположно направлению процессов в цикле Карно для тепловых двигателей.
Рис. 3.14. Цикл Карно в P-V и T-S координатах В T-S координатах цикл Карно изображается прямоугольником. При этом количество подведенной Q1 и отведенной Q2 теплоты изображается площадями а12ва и а43ва. Площадь прямоугольника 1234 характеризует получаемую в цикле работу:
т. к. в круговом процессе
Выводы 1. Повсюду, где есть разность температур, можно получить полезную механическую работу. 2. Теплоту нельзя полностью превратить в работу ни в каких реальных и идеально достижимых условиях, т. к. невозможно иметь Т2=0 (абсолютный нуль термодинамической шкалы недостижим). 3. К.п.д. цикла Карно не зависит от вида рабочего тела, а определяется соотношениями граничных температур процессов отвода и подвода теплоты. 4. Теплота может быть причиной полезной механической работы в том случае, когда она заставляет тела менять свой объем или форму.
Работа. Количественное выражение элементарной работы δL в общем виде определяется как произведение проекции Fs силы F на элементарное перемещение точки приложения силы (рис. 3.4).
Рис. 3.4. Определение элементарной работы
Работа есть эффект перемещения силы, она зависит от вида процесса. Следовательно, выражение элементарной работы не является полным дифференциалом и знак δ как общий символ бесконечно малых величин указывает на это. Рассмотрим работу в цилиндре поршневой машины. Элементарная работа сжимаемых тел определяется в зависимости от давления и изменения объема: Fs=P×f; dS=1/f×dV; dL=Fs×dS=P×f×(1/f)×dV=P×dV; dL=P×dV. (3.13) Работу изменения объема называют термодинамической работой (рис. 3.5). Эта работа в P-V координатах определяется площадью, ограниченной линией процесса и координатами точек начала и конца процесса. Работа считается положительной (L1,2>0), если система совершает ее над внешними телами, т. е. при dV>0, и отрицательной (L1,2<0), если внешние тела совершают работу над системой, т. е. при dV<0 (рис. 3.6).
Рис. 3.5. Определение термодинамической Рис. 3.6. Графическое изображение работы термодинамической работы
Часто в термодинамике оперируют понятием удельной термодина-мической работы, т. е. работы изменения объема, отнесенной к 1 кг: d l =1/G×dL=1/G×P×dV=P×du, l 1,2= Интегральное определение полной L1,2 и удельной l 1,2 термодинамической работы возможно лишь при наличии уравнений связи между давлением и объемом: j (P, V)=0; j (P, υ)=0. Эффективная работа реального процесса (dL*, d l *) определяется как разность между обратимой работой изменения объема (dL, d l) и работой необратимых потерь (dL**, d l **). dL*=dL-dL**; d l *=d l -d l **. (3.15) Работа, потерянная в необратимых процессах, превращается в теплоту внутреннего теплообмена.
Рис. 3.7. К определению потенциальной работы Потенциальная работа (W1,2) — работа по обратимому перемещению жидкостей, паров и газов из области одного давления Р1 в область другого давления Р2. Слагаемые потенциальной работы по перемещению газа из области давления Р1 в область давления Р2 изображены на схеме 3.7. Основные условные слагаемые потенциальной работы — это наполнение LI, расширение (сжатие) LII и выталкивание LIII.
Рис. 3.8. Этапы совершения потенциальной работы
dW = -V×dP. (3.17) Элементарная удельная потенциальная работа: dw = (1/G)×dW = -u×dP. (3.18) Потенциальная работа имеет положительный знак при перемещении жидкости или газа из области большего давления в область меньшего давления (Р1>Р2) и наоборот, т. е. при расширении положительна, при сжатии — отрицательна. Как и термодинамическая работа, потенциальная измеряется площадью в P-V координатах (рис. 3.8).
аналогично, для удельной потенциальной работы:
При вычислении интегральной величины потенциальной работы, как и при вычислении интегральной термодинамической работы, необходимо иметь уравнение процесса изменения состояния вещества j (P, V)=0, или j1 (P, u)=0 для удельной потенциальной работы. Потенциальная работа dW, dw — это сумма эффективной работы dW* и работы необходимых потерь dW**. dW=δW*+δW**; соответственно, dw=dw*+dw**. Потенциальная работа необратимых потерь dW* превращается в теплоту внутреннего теплообмена. Эффективная потенциальная работа dW*=dW-dW** непосредственно передается телам внешней системы dLc* и используется для изменения внутренней энергии внешнего положения рабочего тела dEcz. dW*=dEc*+dEcz. (3.21) Газовые смеси Смесь представляет собой систему тел, химически не взаимодействующих между собой. Структура отдельных компонентов смеси в процессах смесеобразования и стабилизации смеси не изменяется. Различают два основных способа задания смеси: весовыми (массовыми) и мольными (объемными) концентрациями. Весовая (массовая) концентрация смеси mi представляет собой отношение стандартного веса или массы компонента к стандартному весу или массе всей смеси:
Мольная (объемная) концентрация ri есть величина отношения количества молей компонентов ri=
Количество молей компонента Молекулярный (кажущийся) вес смеси равен в зависимости от способа задания смеси: через объемные доли:
через массовые доли:
Пересчет весовых и объемных концентраций можно осуществить из уравнения: mi/ri=mi/mm; mi/ri=mi/mm=Rm/Ri, где Rm — газовая постоянная смеси Rm=
Давление смеси представляет собой сумму давлений компонентов, входящих в смесь Законы идеальных газов Идеальным газом является газ, подчиняющийся уравнению Клапейрона при любых плотностях и давлениях. 1. Закон Бойля — Мариотта (1622 г.). Если температура газа постоянна, то давление газа и его удельный объем связаны зависимостью: P1u1=P2u2=idem, или u2/u1=P1/P2. (3.25) 2. Закон Гей — Люссака (1802 г.). При постоянном давлении объем газа при нагревании изменяется прямо пропорционально повышению температуры: u=u0(1+at), (3.26) где u — удельный объем газа при температуре t°C, u0 — удельный объем газа при температуре t=0°С, a — температурный коэффициент объемного расширения идеальных газов при t=0°C одинаковый для различных газов и сохраняющий одно и то же значение: a=1/273,16=0,00366 1/°С. 3. Закон (уравнение) Клапейрона (1834 г.). Сопоставление законов Бойля — Мариотта и Гей — Люссака приводит к уравнению состояния идеальных газов: u=u0(1+at)=const/P=a×const/P(1/a+t); 1/a+t=T; a×const=R; T=273,16+t°C; Pu=RT; PV=GRT=MRT, (3.27) где R — газовая постоянная идеального газа. Представляет собой удельную работу газа в изобарном процессе (P — idem) при изменении температуры газа на 1°С. 4. Закон Авогадро (1811 г.). Объем киломоля идеального газа (
Объем 1 кмоля идеального газа в нормальных физических условиях (температура 0°С, давление 101,325 кПа)
Уравнение Клапейрона для одного кмоля идеального газа имеет вид
тогда mR не зависит от природы газа и в силу этого называется универсальной газовой постоянной:
Удельные газовые постоянные газов R определяются по значению их молярной массы:
Таким образом, уравнение состояния идеального газа (уравнение Клапейрона) может быть записано в следующих видах: для 1 кг газа Pu=RT, для G кг газа PV=GRT, для 1 кмоля газа (уравнение Клапейрона — Менделеева)
для Первое начало термодинамики Первое начало термодинамики как математическое
|
|||||||||
|
Последнее изменение этой страницы: 2020-10-24; просмотров: 121; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.188.40.207 (0.157 с.) |

 . (3.12)
. (3.12)
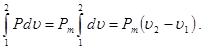 (3.14)
(3.14)

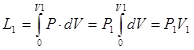 ; (3.16)
; (3.16)

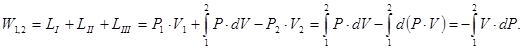
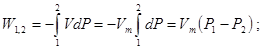 (3.19)
(3.19)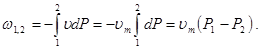 (3.20)
(3.20) ;
;  ;
; 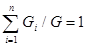 .
.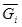 к количеству молей смеси:
к количеству молей смеси:
 ;
; 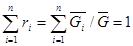 .
.
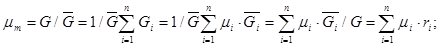 (3.22)
(3.22) (3.23)
(3.23) (3.24)
(3.24)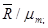

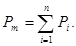 Давление одного компонента устанавливается на основании закона Дальтона (закона диффузионного равновесия) Pi=Pm×ri, где Pi — парциальное давление газов, входящих в смесь.
Давление одного компонента устанавливается на основании закона Дальтона (закона диффузионного равновесия) Pi=Pm×ri, где Pi — парциальное давление газов, входящих в смесь. ) не зависит от его природы и вполне определяется параметрами физического состояния газа (P, t):
) не зависит от его природы и вполне определяется параметрами физического состояния газа (P, t):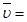 ƒ(P, t).
ƒ(P, t).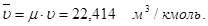
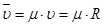 ,
, . (3.28)
. (3.28) (3.29)
(3.29)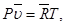
 кмолей газа
кмолей газа  (3.30)
(3.30)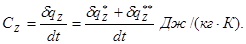 (3.39)
(3.39)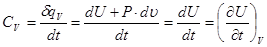 , (3.40)
, (3.40)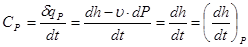 . (3.41)
. (3.41)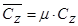 Дж/(кмоль×К);
Дж/(кмоль×К);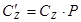 Дж/(м3×К);
Дж/(м3×К);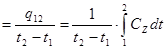
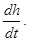
 Средняя теплоемкость определяется из уравнения по таблицам средних теплоемкостей. Меньшие интервалы находятся методом интерполирования.
Средняя теплоемкость определяется из уравнения по таблицам средних теплоемкостей. Меньшие интервалы находятся методом интерполирования.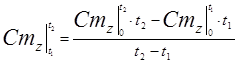 (3.42)
(3.42)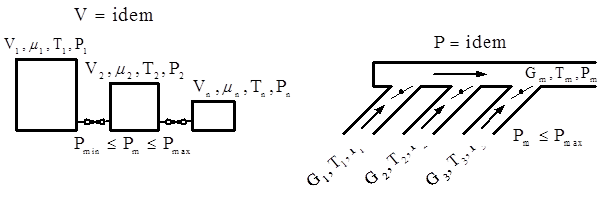
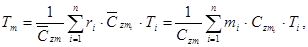
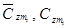 — средние мольные (объемные) и весовые теплоемкости компонентов в интервале температур (Ti — Tm) берутся из справочных таблиц;
— средние мольные (объемные) и весовые теплоемкости компонентов в интервале температур (Ti — Tm) берутся из справочных таблиц;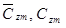 — средние мольные (объемные) и весовые теплоемкости смеси в том же интервале температур (Ti — Tm):
— средние мольные (объемные) и весовые теплоемкости смеси в том же интервале температур (Ti — Tm):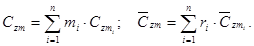


 8314 Дж/(кмоль×К).
8314 Дж/(кмоль×К).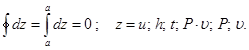 (3.54)
(3.54) (3.55)
(3.55)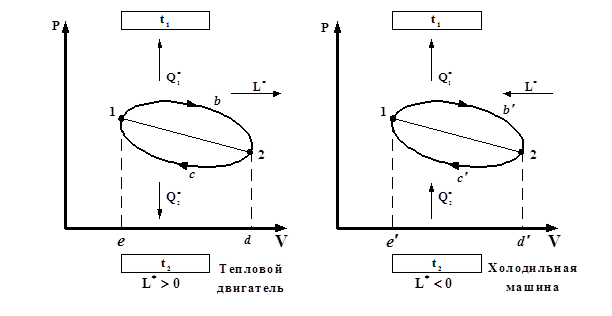
 (3.56)
(3.56) (3.57)
(3.57)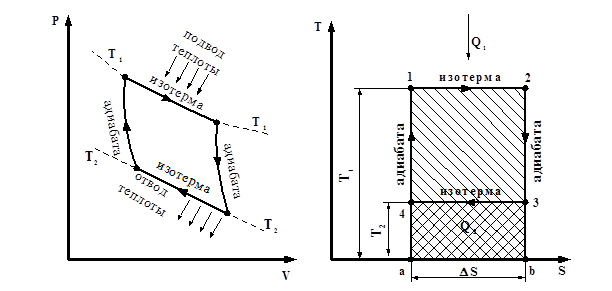



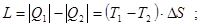
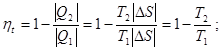 (3.58)
(3.58)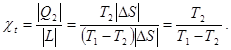 (3.59)
(3.59)


