
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Получение и направления химической модификации хлорофилла а и его ближайших производныхСтр 1 из 4Следующая ⇒
КУРСОВАЯ РАБОТА Исследование реакций восстановления метилфеофорбида (а)
Научный руководитель: к.х.н., доцент А.Л. Тулаева Исполнитель: Студентка 240 группы И.В. Маркова
Сыктывкар 2012
Содержание
Структура метилфеофорбида (А) Введение . Обзор литературы Получение и направления химической модификации хлорофилла (а) и его ближайших производных Реакции восстановления производных хлорофилла Восстановление винильной группы Восстановление сложноэфирных групп Восстановление карбонильных групп Другие реакции производных хлорофилла Реакции нуклеофильного замещения при карбонильном атоме углерода в положении 13(1) форбиновых производных хлорофилла Положение сигналов спектров ЯМР1Н метилфеофорбида (а) . Экспериментальная часть Приборы и реактивы Получение феофитинов из спирулины Получение метилфеофорбида(а) из феофитинов Хроматографическое исследование соединений Обсуждение результатов Получение метилфеофорбида (а) Выводы Список использованной литературы Приложения Структура метилфеофорбида (а) Нумерация атомов углерода производных хлорофилла (а)
Введение реакция восстановление метилфеофорбид хлорофилл Порфирины - природные и синтетические тетрапиррольные соединения, формально - производные порфина азотосодержащие пигменты, входят в состав небелковой части молекулы гемоглобина, хлорофилла, ряда ферментов. Относятся к высшим гетероциклам. Благодаря уникальному набору физических и химических свойств порфирины и их аналоги привлекают интерес исследователей в области химии, биологии, медицины, оптики и материаловедения. На основе порфиринов созданы катализаторы, сенсоры, лекарственные средства, органические полупроводники, жидкие кристаллы и материалы для нелинейной оптики. Прежде всего, уникальным представителем этого класса являются хлорофилл - важнейший природный порфирин, участвующий в процессе фотосинтеза в зеленых растениях, и гем крови - красный пигмент, осуществляющий транспортировку кислорода в живом организме. Известны также пирропорфирины - синтетические пиррольные соединения и их модификации, простейшим представителем которых является тетрафенилпорфирин, по применению не уступающий природным порфиринам.
Большой практический интерес составляют модификации хлорофилла. В ходе установления его строения было получено большое количество хлоринов: феофетины, феофорбиды, хлорин е6 феопорфирины и др. Изучение свойств этих модельных соединений способствовало исследованию механизмов фотосинтеза и позволило выявить новые области применения. Целью данной работы является исследование реакций восстановления метилфеофорбида а. Задачи: 1. Получение метилфеофорбида а из сухой спирулины; . Исследование восстановления метилфеофорбида (а) .Провести литературный обзор на тему: ”Исследование реакций восстановления метилфеофорбида а” 1. Обзор литературы Реакции восстановления производных хлорофилла Другие реакции производных хлорофилла Реакция с ацетилацетоном a-метоксильное производное т.м.э. хлорина е6 (11) используется для синтеза фотосенсибилизаторов с удаленной гидроксильной группой. Одна из стадий этого синтеза заключается в реакции с ацетилацетоном (см. рис.4) [9]:
Рис. 4. Взаимодействие 3-(a-метоксиэтил)-хлорин е6 т.м.э. с ацетилацетоном.
Ацетатат цинка в этой реакции вводится в качестве слабого основания, необходимого для ионизации и для образования цинкового комплекса. Реакция Вильсмейера Активность безметальных производных хлорофилла в реакциях электрофильного замещения по раскрытию цикла невелика, поэтому такие преврашения проводят с соответствующими металлокомплексами [14-16]. В случае реакции Вильсмейера используют комплексы меди (II), никеля (II) и железа (III). При формилировании по Вильсмейеру производных хлорофилла, не содержащих винильной и карбонильной групп, замещение происходит в 20-положении. При действии комплекса Вильсмейера на Cu (II) дезоксо-метилмезопирофеофорбида (а) образуется соответствующее формильное производное в положении 20 [17]:
Рис. 5. Формилирование по Вильсмейеру Cu (II) дезоксо-метилмезопирофеофорбида (а).
Винильная группа более реакционноспособна, чем метиновый мостик в положении 20. При обработке формилирующей смесью комплекса Fe(III)- хлорина е6 т.м.э. образуются моноформильное (по винильной группе) и диформильное (по винильной группе и по 20-положению) производные с выходами 7% и 30%.
Рисунок 6. Формилирование по Вильсмейеру Fe(III)-хлорина е6 т.м.э.
При формилировании Fe(III)-изохлорина е4 д.м.э. (12) образуется только продукт реакции по винильной группе.
Рисунок 7. Формилирование по Вильсмейеру
При действии формилирующей смеси на Cu(II)-метилмезопирофеофорбид (а) происходит замена гидроксила енольной формы на хлор с последующим формилированием енольной формы. Реакция производных хлорофилла и комплекса Вильсмейера с N,N-диметиламиноакролеином проходит по 20-положению хлоринового цикла, даже если в молекуле исходного соединения есть карбонильная и винильная группа. При действии этого комплекса на Ni (II) 9-дезоксо-метилмезопирофеофорбид (а) (13) [17] или комплекса Ni (II) мезохлорина е6 т.м.э. (14) дает 20-формилвинильное производное (выходы 80% и 75% соответственно). В случае комплексов Ni (II) метилмезопирофеофорбида (а) (15) и метилпирофеофорбида (а) (16) замещение идет также в 20-положение (выходы 83% и 63%).
Рисунок 8. Синтез формил-винильных производных по Вильсмееру.
Цианирование комплекса Cu (II) метилмезопирофеофорбида (а) проводилось при помощи бромциана в хлороформе в присутствии хлорида олова и суспендированного карбоната калия. Реакция обычно заканчивается через 7-9 часов с выходом 40-50% после деметаллирования.
Рис. 9. Цианирование Cu (II) метилмезопирофеофорбида (а)
Действием на Cu (II) метилмезопирофеофорбид (а) хлорметилметилсульфида в присутствии хлорида титана в сухом хлористом метилене при 40оС было получено 20-СН2SCH3 производное с выходом 74-77% после ПТСХ.
Рис. 10. Получение 20-СН2SCH3 Cu (II) метилмезопирофеофорбида (а)
Экспериментальная часть Приборы и реактивы
Для получения производных хлорофилла в качестве сырья использовали высушенные листья спирулины, которые предварительно подвергали механическому измельчению. Для проведения колоночной и тонкослойной хроматографии использовали четыреххлористый углерод марки “ч”, ацетон марки “ч”. Для приготовления элюентов соотношение растворителей брали по объему. При проведении колоночной хроматографии, колонку наполняли “мокрым способом”, используя четыреххлористый углерод. Для экстракции производных хлорофилла из спирулины использовали этанол марки “ч” без дополнительной очистки. Для получения метилфеофорбидов использовали метанол марки “ч” без дополнительной очистки. Для осаждения феофитинов использовали разбавленную соляную кислоту квалификации “ч” в соотношении 1:10 (по объему). При получении метилфеофорбидов использовали концентрированную серную кислоту марки “ч”. Для переосаждения из хлороформа выделенных соединений использовали пентан, квалификации “ч” без дополнительной очистки. Безводный сульфат натрия, квалификации “х.ч.” использовали для удаления остатков воды из растворов. Колоночную хроматографию проводили на силикагеле L 100/400. Обсуждение результатов 3.1 Получение метилфеофорбида (а)
Получение метилфеофорбида а из спирулины через феофитины см. Рисунок 15.
Рисунок 15. Схема получения метилфеофорбида а
Для получения метилфеофорбида а сухую спирулину экстрагировали настаиванием с этанолом и полученный этанольный экстракт подкисляли разбавленной соляной кислотой (7%). Феофитины в отличие от хлорофиллов плохо растворимы в этаноле. Поэтому, когда при подкислении густого этанольного экстракта спирулины соляной кислотой, происходит удаление магния из координационной сферы хлорофиллов, образующиеся феофитины выпадают в осадок. Считается, что, поскольку кислота добавляется в относительно небольшом количестве, другие вещества осаждаются с феофитинами незначительно. Далее экстракт подкисляли соляной кислотой и выпавшие при этом в осадок феофитины обрабатывали метанолом в присутствии концентрированной серной кислоты. Превращения хлорофиллов, происходящие при этом, можно представить следующим образом (см. 16)
Рисунок 16 Получение метилфеофорбида а из хлорофиллов (где С20H39 - фрагмент спирта фитола, этерифицирующего фитилпропионатный заместитель хлорофиллов высших растений).
Колоночной хроматографией и кристаллизацией был выделен метилфеофорбид а массой 70 мг. Строение полученного соединения подтверждено данными ПМР- и ИК-спектроскопии (приложение А, приложение Б).
Выводы 1. Проведен анализ литературы по реакциям восстановления метилфеофорбида а. 2. Отработана методика выделения производных хлорофилла а изспирулины. 3. Методом колоночной хроматографии выделен метилфеофорбид а. Структура полученного соединения подтверждена методом ИК- и ЯМР-спектроскопии. Список использованной литературы
1 Kenner G. V., Mac Combie S. W., Smith K. M. Pyrrols end related compounds. Part XXIV. Separation and oxidative degradation of chlorophyll derivatives. // J. Chem. Soc. Percin Trans 1 (1973) p. 2517-2523. Smith K. M., Bushell M.J., Rimmer J, Unsworth J.F. Bacteriochlorophylls (c) from Chloropseudomonas etilenium. Comparation and NMR studies of the pheophorbides and derivatives.// J. Chem. Soc. (1980) v 102, p. 2437-2448 Seely G. R. The structure and chemistry of functional groups. In “The chlorophylls” //ed. By L. P. Seely and C.R. Vernon,N-Y., Acad. Press (1966) p. 67-108 Миронов А. Ф. Разработка сенсибилизаторов второго поколения на основе природных хлорофиллов. // Росс. Хим. Журн. (1998) №5, с. 23-26 Mironov A. N., Efremov A. V., Efremova O. A., Bonnet R. Novel chlorines with δ-lacton ring.// Mendeleev Commun. (1997) p. 244-245 6 Abraham R.J., Rowan A.E., Smith N.N., Smith K. M. NMR spectra of the porphyrins. Part 42. The synthesis and aggregation behavior of some chlorophylls analogous. // J. Chem. Soc. Perkin Trans 2 (1993) p. 1047-1059 Osuka A., Wada U., Shinoda S. Covalently linked pyropheophorbide dimmers as model of thr special pair in the photosynthetic reaction center. // Tetragedron (19960 v. 52., № 12, p. 4311-4326 Fuscher R., Engel N., Henseleler A., Gossauer A. Synthesis of chlorophyll (a) labeled at C(32) from pheophorbide (a) methyl ester. // Helv. Chem. Acta (1994) v. 77, p. 1046-1050
Smith K. M., Bisset J. M.F., Bushell M.J. partial synthesis of optically pure methyl bacteriopheophorbides (c) and (D) from methyl pheophorbides (a). // J. Org. Chem.(19800 v. 45, p. 2218-2224 Tamiaki H., Miyatake T., Tanicaga R. Self-aggregation of synthetic zinc chlorines possessing “invers” keto-hydroxyl groups.// Tetragedron Lett. (1997) voll. 38, № 2, p. 267-270. Mettath S., Shibata M., Alderfer J. L., Seng M.O., Smith K. M., Rein R., Dougherty T.J., Pandey R.K. Synthesis and spectroscopic properties of novel benzochlorines derived from chlorophyll (a).// J. Org. Chem. (1998) v. 63, p. 1646-1656. Бажанова, Н.В., Маслова, Т.Г., Попова, И.А., Попова, О.Ф., Сапожников, Д.И., Эйдельман, З.М. При участии Черноморского, С.М. и Меницкой, Я.М. Пигменты пластид зеленых растений и методика их исследования. - М.-Л.: Наука, 1964. - 120 с. Порфирины: структура, свойства, синтез. / Под ред. Н.С. Ениколопяна - М.: Наука, 1985. - 334 с. Wasielewski M.R., Johnson D.J., Neimczuc M.P., Gaines G.l., O’Neil M.P., Svec W.A. Chlorophyll-porphyrin heterodimers with orthogonal π-systems: solvents polarity dependent photophysics.// J.Am. Chem. Soc. (1990) v. 112, p. 6482-6488. Tamiaki H., Kouba M. Synthesis of chlorophyll (a) homologos by Wittig and Knoevenagel reaction with methyl pyropheophorbide (d).// Tetragedron (1997) v. 53, №31, p. 10677-10688. Ломова Т. Н. Основы синтеза и механизмы химических превращений порфиринов и их аналогов. Часть 1,2 Текст лекций. Иваново 2007, с.78. Smith K. M., Goff D.A., Simpson D. J. Mesosubstitution of chlorophyll derivatives: direct rote for transformation of bacteriopheophorbides (d) into bacteriopheophorbides (c).// J. Am. Chem. Soc. (1985) v. 107, p. 7946-4954
Приложение А
Положение и мультиплетность сигналов спектров ПМР метилфеофорбида а
Приложение Б
Положение полос в ИК-спектре (ν, см-1) метилфеофорбида а
КУРСОВАЯ РАБОТА Исследование реакций восстановления метилфеофорбида (а)
Научный руководитель: к.х.н., доцент А.Л. Тулаева Исполнитель: Студентка 240 группы И.В. Маркова
Сыктывкар 2012
Содержание
Структура метилфеофорбида (А) Введение . Обзор литературы Получение и направления химической модификации хлорофилла (а) и его ближайших производных Реакции восстановления производных хлорофилла Восстановление винильной группы
Восстановление сложноэфирных групп Восстановление карбонильных групп Другие реакции производных хлорофилла Реакции нуклеофильного замещения при карбонильном атоме углерода в положении 13(1) форбиновых производных хлорофилла Положение сигналов спектров ЯМР1Н метилфеофорбида (а) . Экспериментальная часть Приборы и реактивы Получение феофитинов из спирулины Получение метилфеофорбида(а) из феофитинов Хроматографическое исследование соединений Обсуждение результатов Получение метилфеофорбида (а) Выводы Список использованной литературы Приложения Структура метилфеофорбида (а) Нумерация атомов углерода производных хлорофилла (а)
Введение реакция восстановление метилфеофорбид хлорофилл Порфирины - природные и синтетические тетрапиррольные соединения, формально - производные порфина азотосодержащие пигменты, входят в состав небелковой части молекулы гемоглобина, хлорофилла, ряда ферментов. Относятся к высшим гетероциклам. Благодаря уникальному набору физических и химических свойств порфирины и их аналоги привлекают интерес исследователей в области химии, биологии, медицины, оптики и материаловедения. На основе порфиринов созданы катализаторы, сенсоры, лекарственные средства, органические полупроводники, жидкие кристаллы и материалы для нелинейной оптики. Прежде всего, уникальным представителем этого класса являются хлорофилл - важнейший природный порфирин, участвующий в процессе фотосинтеза в зеленых растениях, и гем крови - красный пигмент, осуществляющий транспортировку кислорода в живом организме. Известны также пирропорфирины - синтетические пиррольные соединения и их модификации, простейшим представителем которых является тетрафенилпорфирин, по применению не уступающий природным порфиринам. Большой практический интерес составляют модификации хлорофилла. В ходе установления его строения было получено большое количество хлоринов: феофетины, феофорбиды, хлорин е6 феопорфирины и др. Изучение свойств этих модельных соединений способствовало исследованию механизмов фотосинтеза и позволило выявить новые области применения. Целью данной работы является исследование реакций восстановления метилфеофорбида а. Задачи: 1. Получение метилфеофорбида а из сухой спирулины; . Исследование восстановления метилфеофорбида (а) .Провести литературный обзор на тему: ”Исследование реакций восстановления метилфеофорбида а” 1. Обзор литературы Получение и направления химической модификации хлорофилла а и его ближайших производных Хлорофилл (от греч. chloros - зеленый и phyllon - лист), зеленый пигмент растений, с помощью которого они улавливают энергию солнечного света и осуществляют фотосинтез, т. е. превращают солнечную энергию в энергию химических связей органических соединений. Хлоропласты высших растений и зеленых водорослей содержат два типа хлорофиллов, близких по структуре молекул, - хлорофиллы (a) и (b) (I,II). Хлорофилл (а) (I) является самым доступным из всех хлорофиллов, встречающихся в живых организмах. Этот пигмент и его ближайшие производные могут быть препаративно получены из высших растений (крапива, шпинат и водоросли). Источником производных хлорофилла (а) могут служить разного рода отходы переработки зеленых частей растений, такие как смола наперстянки и липидная фракция экстракта серпухи венценосной. Получение производных хлорофилла (а) из всех этих источников осложняется тем, что помимо хлорофилла (а) в них содержится хлорофилл (b) (II). Наличие хлорофилла (b) обуславливает необходимость использования хроматографии при получении индивидуальных соединений. Этого недостатка лишена сине-зеленая водоросль (спирулина), промышленное получение которой налажено относительно недавно. Доступность спирулины, выращиваемой как в промышленных реакторах, так и на плантациях, обуславливает ее перспективность как источника тетрапиррольных соединений. Сам хлорофилл (а) редко используется в качестве исходного соединения в химических превращениях ввиду его относительной неустойчивости и трудностей, возникающих при получении в чистом виде. Более удобными исходными соединениями для химических превращений являются феофитин (а) (III) и метилфеофорбид (а) (IV), а так же ряд получаемых из них хлоринов (V-VIII) (рисунок 1):
М = Mg (I) Хлорофилл (а): R1 = CH3; R2 = Phyt; R3 = CO2CH3; R4 = Н. (II) Хлорофилл (b): R1 = CH=О; R2 = Phyt; R3 = CO2CH3; R4 = Н. М = 2Н (III) Феофитин (a): R1 = CH3; R2 = Phyt; R3 = CO2CH3; R4 = Н. (V) Пирофеофитин (a): R1 = CH3; R2 = Phyt; R3 = R4 = Н. (VI) Феофорбид (a): R1 = CH3; R2 = Н; R3 = CO2CH3; R4 = Н. (VII) Пирофеофорбид (a): R1 = CH3; R2 = Н; R3 = CO2CH3; R4 = Н. (IV) Метилфеофорбид (a): R1 = R2 = CH3; R3 = CO2CH3; R4 = Н. (VIII) Метилпирофеофорбид (a): R1 = R2 = CH3; R3 = CO2CH3; R4 = Н.
(IX) Хлорин е6: R1 = CO2CH3; R2 = CH2CO2CH3. (X) Хлорин р6: R1 = R2 = CO2CH3. (XI) Пурпурин 18 Рисунок 1. Формула производных хлорофилла
Химическая модификация хлорофилла (а) и его производных предпринималась как в связи с решением ряда фундаментальных проблем (построение моделей фотосинтеза, установление строения хлорофиллов и др.), так и для решения ряда практических задач, важнейшая из которых заключается в синтезе противоопухолевых препаратов с различным механизмом действия. Для химической модификации с целью внедрения дополнительных заместителей на периферию хлоринового макроцикла в большинстве случаев используют реакции винильной группы в положении 3 и карбометоксильной группы пропионатного заместителя в положении 17. В связи с тем, что атом углерода карбонильной группы в положении 13 (1) доступен для нуклеофильной атаки и имеется возможность делокализации отрицательного заряда на атоме углерода в положении 13 (2) возможно раскрыть экзоцикл при действии нуклеофилов, или ввести в структуру производной хлорофилла какую-либо функциональную группу. Однако, эти реакционные центры используется в химических превращениях в основном хлорофилла (а), феофитина (а), метилфеофорбида (а).
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2020-03-26; просмотров: 375; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.128.206.91 (0.11 с.) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||


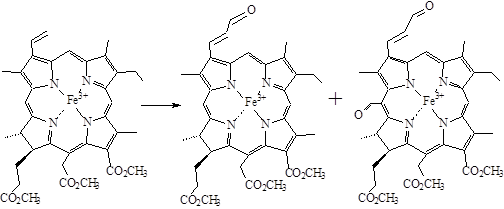
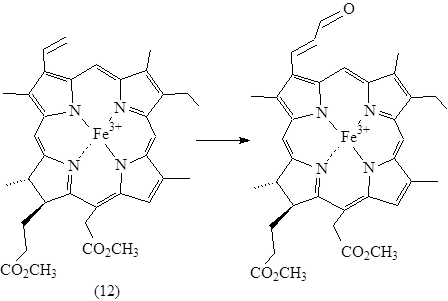



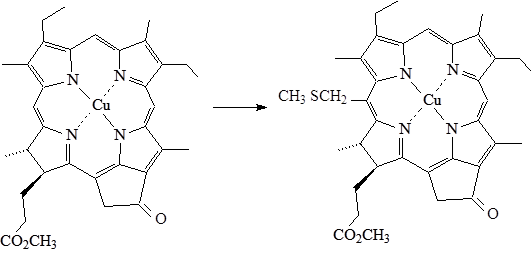



 фитол (PhytOH)
фитол (PhytOH)




