
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Параметры состояния и уравнения состояния.Стр 1 из 10Следующая ⇒
Истинная и средняя теплоемкости веществ. Теплоемкостью называется количество теплоты, которое надо сообщить единице массы, количества или объема вещества, чтобы его температура повысилась на 1 градус. Различают массовую теплоемкость с, измеряемую в Дж/(кг × К), молярную Связь между массовой, молярной и объемной теплоемкостью представлена следующими соотношениями: Теплоемкость газов зависит от термодинамического процесса, в котором подводится или отводится теплота. Если процесс задан условием
Экспериментальное определение теплоемкости проводится в двух процессах: при постоянном объеме (изохорная теплоемкость cv) и постоянном давлении (изобарная теплоемкость cp). Теплоемкость реального газа зависит от температуры и давления. Теплоемкость идеального газа зависит только от температуры. Для практических расчетов вводится понятие средней теплоемкости в интервале температур от t 1 до t 2, значение которой принимается неизменной для всего рассматриваемого интервала температур (с zm). Количество теплоты, подведенной к телу (или отведенной от него) в процессе 1 –2 (изобарном или изохорном), определяется соотношением
Средняя теплоемкость численно равна истинной теплоемкости при среднеарифметической температуре процесса. Смеси жидкостей, паров и газов, расчет характеристик смеси веществ. Термодинамическая смесь – система, состоящая из
Для смеси нужно уметь определять среднюю молекулярную массу
Если смесь является идеальным газом, то Если смесь является реальным газом, то Псевдокритические параметры:
Схемы смешения. Закон Дальтона.
Схемы смешивания газов: 1.
2.
Закон Дальтона: давление смеси равно сумме парциальных давлений компонентов.
Парциальное давление.
Теплопроводность через однослойные и многослойные плоские стенки. Расчетное выражение удельного теплового потока получается из уравнения Фурье
В общем случае для стенки, состоящей из n – слоев имеем
См. предыдущий вопрос. Параметры состояния и уравнения состояния. Параметры состояния - физические величины, характеризующие внутреннее состояние термодинамической системы. Параметры состояния термодинамической системы подразделяются на два класса: интенсивные и экстенсивные. Интенсивные свойства не зависят от массы системы, а экстенсивные - пропорциональны массе. Термодинамическими параметрами состояния называются интенсивные параметры, характеризующие состояние системы. Простейшие параметры: 1. 2. 3. Уравнение состояния для простого тела- Термодинамический процесс – непрерывная последовательность равновесных состояний. Уравнение термодинамического процесса – уравнение вида Внутренняя энергия – полный запас энергии, определяемый внутренним состоянием. Удельная энергия - Элементарное изменение внутренней энергии - Количество теплоты - Удельная теплота - Элементарное количество теплоты - Теплообмен – процесс передачи энергии путём передачи теплоты. Термодинамическая работа – работа, вызванная изменением объёма, Удельная работа -
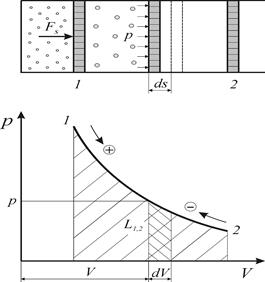
3.Термодинамическая работа. Координаты Р-v.
Термодинамическая работа – работа, вызванная изменением объёма, Удельная элементарная термодинамическая работа обратимого изменения объема
Поскольку термодинамическая работа зависит от пути (вида) процесса, для вычисления интегральных значений полной ( Работа определяется площадью под кривой процесса независимо от вида рабочего тела и его свойств. В силу этого координаты р – V и р – v называются универсальными координатами работы. В частном случае для изобарного процесса (p = idem) интегральные значения полной и удельной термодинамической работы определяются по следующим соотношениям L 1,2 = Работа расширения считается положительной ( 4. Потенциальная работа. Координаты Р-v. Распределение работы. Потенциальная работа - работа по перемещению сплошных масс (газа, пара или жидкости) из области одного давления (p1) в область другого давления (p2). Элементарная потенциальная работа простого тела определяется из соотношения Удельная потенциальная работа в элементарном процессе Для определения интегральных значений полной ( Работа определяется в кооординатах р – V площадью независимо от вида рабочего тела и его свойств.
В частном случае для изохорного процесса (v = idem) интегральные значения полной и удельной потенциальной работы определяются по следующим соотношениям: Потенциальная работа (+) при снижении давления ( Потенциальная работа в обратимом процессе ( Эффективная т/д работа ( В условиях механических процессов (dEcz = G × c Е × dc Е + G × g × dz) уравнение распределения термодинамической и потенциальной работ формулируется:
где cE – скорость движения тела, dz – изменение высоты центра тяжести тела в поле тяготения.
|
|||||||||||||||||||||
|
Последнее изменение этой страницы: 2020-10-24; просмотров: 77; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.141.41.187 (0.024 с.) |
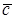 – Дж/(кмоль × К) и объемную с' – Дж/(м3 × К).
– Дж/(кмоль × К) и объемную с' – Дж/(м3 × К). ;
;  .
.  . - Эта теплоемкость называется истинной.
. - Эта теплоемкость называется истинной. .
.  .
. 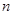 химически невзаимодействующих друг с другом компонентов. Состав смеси задаётся либо массовой концентрацией компонентов -
химически невзаимодействующих друг с другом компонентов. Состав смеси задаётся либо массовой концентрацией компонентов -  , либо молярным составом -
, либо молярным составом -  (объёмный).
(объёмный). , где
, где  - масса одного компонента смеси,
- масса одного компонента смеси, 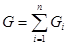 - масса всей смеси.
- масса всей смеси.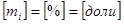 ,
, 
 , где
, где 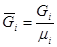 - число киломолей вещества,
- число киломолей вещества,  - число киломолей смеси,
- число киломолей смеси, 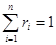
 и среднюю газовую постоянную
и среднюю газовую постоянную 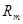 :
:
 .
. .
.
 , следовательно
, следовательно 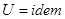 .
.
 , следовательно
, следовательно 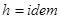 .
.
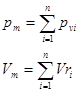

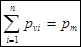


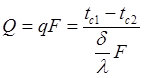
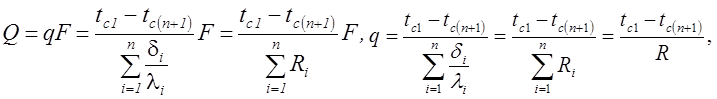
 Температура на стыке двух слоев:
Температура на стыке двух слоев:
 - абсолютное давление - численно равно силе F, действующей на единицу площади f поверхности тела ┴ к последней, Па=Н/м2
- абсолютное давление - численно равно силе F, действующей на единицу площади f поверхности тела ┴ к последней, Па=Н/м2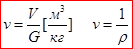 - удельный объём -это объем единицы массы вещества.
- удельный объём -это объем единицы массы вещества. Температура есть единственная функция состояния термодинамической системы, определяющая направление самопроизвольного теплообмена между телами.
Температура есть единственная функция состояния термодинамической системы, определяющая направление самопроизвольного теплообмена между телами. .
. .
.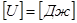 .
. ,
,  .
. .
. ,
,  .
. ,
,  .
.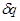 .
.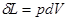 .
. .
.
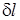 (Дж/кг) определяется:
(Дж/кг) определяется: 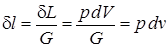 . (1.1)
. (1.1) ), или удельной (
), или удельной ( ) работы должны быть заданы уравнения процессов изменения состояния тела в форме,
) работы должны быть заданы уравнения процессов изменения состояния тела в форме, 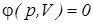 либо его графическое изображение в диаграммах состояния р – V(v).
либо его графическое изображение в диаграммах состояния р – V(v).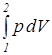 =
=  ; l 1,2 =
; l 1,2 =  =
=  .
. ,
,  ), а работа сжатия – отрицательной (
), а работа сжатия – отрицательной ( ).
). .
. определяется по формуле:
определяется по формуле:  .
.  ) или удельной (
) или удельной ( ) работы надо знать уравнение процесса изменения состояния рабочего тела
) работы надо знать уравнение процесса изменения состояния рабочего тела 
 ;
;  .
. )и (-) – (
)и (-) – ( ).
). ) есть сумма эффективной работы
) есть сумма эффективной работы 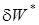 и необратимых потерь работы
и необратимых потерь работы  :
:  +
+  ) простого тела в замкнутом пространстве и эффективная потенциальная работа (
) простого тела в замкнутом пространстве и эффективная потенциальная работа ( или
или  ) и используются для изменения энергии внешнего положения тела (dEcz):
) и используются для изменения энергии внешнего положения тела (dEcz): 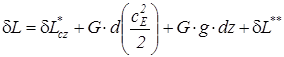 ;
;  ,
, 


