
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Параметры, уравнение состояния идеального газа
Задача 1. Ртутный вакууметр, присоединенный к сосуду с метаном СН4, показывает разряжение 0,056 МПа. Атмосферное давление по ртутному барометру составляет 768 мм рт. ст. (0,102 МПа). Определить абсолютное давление в сосуде и плотность метана, если температура в сосуде равна 20°С. Показания вакуумметра и барометра приведены к температуре 0°С. Решение. Абсолютное давление в сосуде определяется по формуле Рабс=В0-Рвак=0,102-0,056=0,046 МПа. Плотность газа находим из уравнения состояния, предварительно определив газовую постоянную:
Задача 2. Баллон с кислородом емкостью 20 л находится под давлением 1,0 МПа при t=15°С. После израсходования части кислорода давление понизилось до 0,76 МПа, а температура уменьшилась до 10°С. Определить массу израсходованного кислорода. Решение. Из уравнения состояния PV=GRT находим, что до расходования кислорода его масса в баллоне была равна:
После израсходования части кислорода масса его в баллоне будет равна:
следовательно, расход кислорода составит:
Задача 3. Определить удельный объем пропана (С3Н8) как идеального газа при следующих условиях: температура газа t=20°С, манометрическое давление газа в баллоне 5,6 МПа, абсолютное давление газа в помещении равно 0,099 МПа. Решение. Абсолютное давление газа в баллоне Рабс=Рман+В0=5,6+0,099=5,699 МПа; удельная газовая постоянная пропана
абсолютная температура газа Т=273+20=293 К; удельный объем пропана в рассматриваемых условиях
удельный молярный объем пропана при тех же условиях равен:
или, что то же самое:
Газовые смеси Задача 1. По данным анализа установлен следующий объемный состав природного газа: СН4=96%; С2Н6=3%; С3Н8=0,3%; С4Н10=0,2%; СО2=0,1%; N2=0,4%. Определить среднюю молекулярную массу природного газа (mm), плотность газа в нормальных условиях (r), массовые концентрации компонентов (mi), их парциальные давления (Pi), средние теплоемкости (Сpm, Cvm) и показатель адиабаты. Решение. Молекулярные массы составляющих смеси газов находим по данным физических характеристик компонентов газа из справочных таблиц:
Молекулярная масса природного газа определяется по уравнению
где mi — молекулярная масса компонентов смеси; ri — молярная (объемная) концентрация компонентов смеси;
mi — массовая концентрация компонентов смеси. Так как в условии задачи дан объемный состав газа, то удобнее воспользоваться первым уравнением соотношения:
+0,001×44,01+0,004×28,02=16,704 (кг/кмоль). Плотность газа при нормальных условиях (0°С и 0,1 МПа) можно определить из уравнения Клапейрона PV=RT или из закона Авогадро, утверждающего, что удельный молярный объем газа в нормальных условиях- величина постоянная и равна:
Из уравнения Клапейрона при t=0°C и Р=0,1 МПа
где Массовые и объемные концентрации газа связаны между собой соотношением
cледовательно, массовые концентрации отдельных компонентов смеси равны:
Сумма массовых концентраций, как и молярных (объемных), равна единице:
Парциальные давления отдельных компонентов газа определяются по закону Дальтона из соотношения Pi=ri×P. Находим давление каждого компонента, входящего в смесь:
Сумма парциальных давлений равна давлению смеси:
Средняя теплоемкость смеси определяется по уравнениям: массовая теплоемкость смеси: молярная теплоемкость смеси: где
При температуре 0°С и давлении 0,1 МПа можно принять, что теплоемкость метана
+0,0027×0,815+0,0069×1,039=2,18 кДж/(кг×К). Молярная теплоемкость смеси газов при постоянном давлении
Из уравнения Майера
Показатель адиабаты природного газа указанного состава (как идеального газа)
Задача 2. До какого давления необходимо сжать смесь газов, состоящую по весу из СО2=12%, О2=8%, N2=80%, чтобы при температуре t=20°С ее плотность была 1,6 кг/м3. Решение. Находим молекулярную массу смеси через массовые концентрации компонентов смеси:
Давление смеси определим из уравнения состояния
Задача 3. Определить весовой состав газовой смеси, состоящей из углекислоты СО2 и азота N2, если известно, что парциальное давление углекислого газа Решение. Определим парциальное давление азота:
Объемная концентрация азота по закону Дальтона
Объемная концентрация углекислого газа
Молекулярная масса смеси
Используя соотношение mi/mm=mi/ri, определим весовую концентрацию азота и углекислого газа:
Проверка: Первое начало термодинамики Задача 1. При движении природного газа по трубопроводу его параметры изменяются от t1=50°C и P1=5,5 МПа до t2=20°C и P2=3,1 МПа. Средняя молекулярная масса газа mm=16 кг/кмоль. Средняя теплоемкость газа Сpm=1,62 кДж/(кг×°С). Считая газ идеальным и принимая во внимание, что внешняя полезная работа на участке трубопровода равна нулю (w*1,2=0), определить удельную величину внешнего (q*1,2) и внутреннего (q*1,2) теплообмена. Решение. Из уравнения первого начала термодинамики по внешнему балансу тепла и работы для потока в условиях, когда w*1,2=0, имеем Q*1,2=i2-i1=Cpm(T2-T1)=Cpm(t2-t1)=1,62(50-20)=48,6 кДж/кг. Снижение давления газа в газопроводе с 5,5 МПа до 3,1 МПа вызывает внутренний теплообмен в трубе. Вся работа, связанная с падением давления, идет на необратимые потери. Величину этих потерь можно определить из уравнения изотермического процесса движения газа по газопроводу. Потенциальная работа изотермического процесса расширения (T2=idem) определяется уравнением
средняя теплоемкость газа в газопроводе
следовательно, внутренний теплообмен
Приведенный теплообмен в трубопроводе q1,2=q*1,2+q**1,2=48,6+93,2=141,8 кДж/кг. Задача 2. 3 кг метана (СН4) сжимаются при затрате работы 800 кДж. Внутренняя энергия при этом изменяется на 595 кДж. Молярная теплоемкость при постоянном объеме 26,5 кДж/(кмоль×К). Определить количество теплоты, разность температур и изменение энтальпии. Решение. Количество тепла, отведенного при сжатии газа, определяется из уравнения первого начала термодинамики: Q1,2=DU+L1,2=595-800=-205 кДж. Изменение внутренней энергии М кг газа отсюда изменение температуры Изменение энтальпии
Задача 3. В газотурбинной установке (ГТУ) за сутки ее работы сожжено 38000 м3 природного газа, имеющего теплоту сгорания Qнр=56000 кДж/кг. Определить среднюю мощность ГТУ, если к.п.д. ее составил h=25%. Плотность газа в данном случае равна r=0,76 кг/м3. Решение. Массовый расход топливного газа за сутки по ГТУ равен: G=rV=0,76×38×103=28880 кг. Количество тепла, превращенного ГТУ в работу за сутки, Q=G×Qнр×ht=28880×56000×0,25=4043×105 кДж. Эквивалентная этому количеству тепла работа в кВт×ч составит:
Средняя мощность ГТУ за сутки составит
|
||||||
|
Последнее изменение этой страницы: 2020-10-24; просмотров: 373; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.189.22.136 (0.02 с.) |
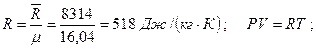
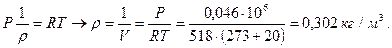
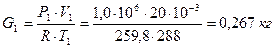

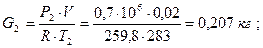

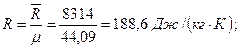



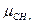 =16,04;
=16,04; 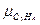 =30,07;
=30,07; 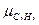 =44,09;
=44,09;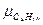 =58,12;
=58,12; 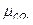 =44,01;
=44,01; 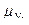 =28,02.
=28,02.
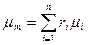 =0,96×16,04+0,03×30,07+0,003×44,09+0,002×58,12+
=0,96×16,04+0,03×30,07+0,003×44,09+0,002×58,12+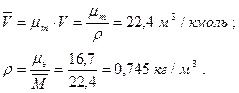
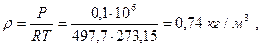
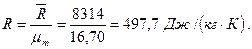
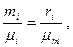 отсюда
отсюда 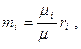
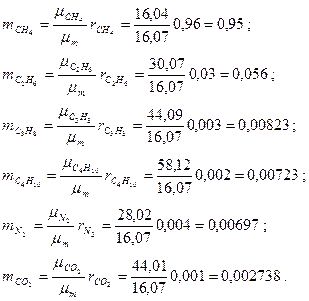
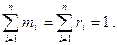
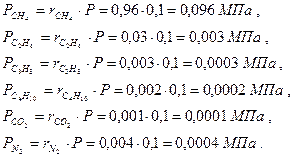
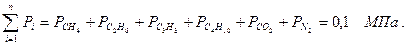
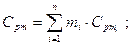
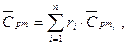
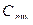 — массовая теплоемкость компонентов смеси при данной температуре;
— массовая теплоемкость компонентов смеси при данной температуре;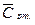 — молярная теплоемкость компонентов смеси при данной температуре.
— молярная теплоемкость компонентов смеси при данной температуре.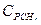 = 2,17 кДж/(кг×К); этана
= 2,17 кДж/(кг×К); этана 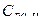 = 1,65 кДж/(кг×К); пропана
= 1,65 кДж/(кг×К); пропана 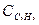 = 1,56 кДж/(кг×К); бутана
= 1,56 кДж/(кг×К); бутана 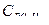 = 1,58 кДж/(кг×К); углекислого газа
= 1,58 кДж/(кг×К); углекислого газа 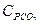 = 0,815 кДж/(кг×К); азота
= 0,815 кДж/(кг×К); азота 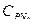 = 1,039 кДж/(кг×К). Следовательно, массовая теплоемкость смеси при постоянном давлении равна:
= 1,039 кДж/(кг×К). Следовательно, массовая теплоемкость смеси при постоянном давлении равна: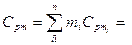 0,95×2,17+0,056×1,65+0,008×1,56+0,007×1,58+
0,95×2,17+0,056×1,65+0,008×1,56+0,007×1,58+ кДж/(кмоль×К).
кДж/(кмоль×К).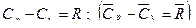 можно определить теплоемкость смеси при постоянном объеме:
можно определить теплоемкость смеси при постоянном объеме: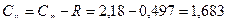 кДж/(кг×К);
кДж/(кг×К); кДж/кг×К.
кДж/кг×К.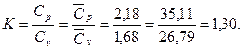
 кг/кмоль.
кг/кмоль.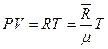 :
: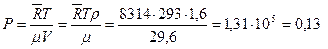 МПа.
МПа.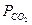 =1,1 ат, а давление смеси равно 3 ат.
=1,1 ат, а давление смеси равно 3 ат.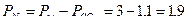 ат.
ат.

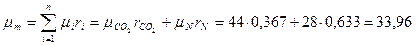 кг/кмоль.
кг/кмоль.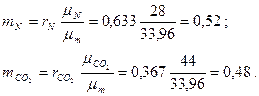
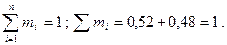
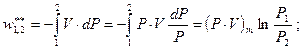
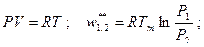

 кДж/кг.
кДж/кг.
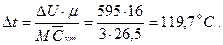
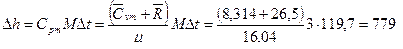 кДж.
кДж.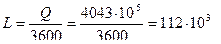 кВт×ч.
кВт×ч.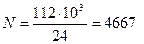 кВт.
кВт.


