
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Соотношения между единицами давленияСтр 1 из 6Следующая ⇒
В технике давление измеряется манометрами и вакуумметрами. Давление, превышающее атмосферное, называют избыточным и измеряют манометрами. Атмосферное давление измеряют барометрами. Давление ниже атмосферного называют разрежением (вакуумом) и измеряют вакуумметрами. Термодинамическим параметром состояния является абсолютное давление*. Если в сосуде давление больше атмосферного, то абсолютное давление складывается из избыточного и атмосферного давлений, т. е. равно сумме показаний манометра и барометра рабс = ризб + ратм = рман + рбар. Если в сосуде разрежение, т. е. давление ниже атмосферного, то абсолютное давление равно разности показаний барометра и вакуумметра рабс = ратм — рразр = рбар — рвак. Удельный объем — это объем единицы массы данного вещества, м3/кг
где V — объем вещества, м3; М — масса этого вещества, кг. Плотность — это масса вещества, заключенная в единице его объема, кг/м 3
Плотность вещества — величина обратная удельному объему.
Следует отличать плотность вещества от его удельного веса, определяемого по формуле
где g — ускорение силы тяжести, м/с2. Удельный объем в Британской системе единиц измеряют в кубических футах на фунт массы (ft3/lb). Температура — степень нагретоcти тела, зависящая от скорости движения молекул. При измерении температуры используется международная стоградусная температурная шкала (термометрическая шкала Цельсия), в которой интервал температур от точки плавления льда до точки кипения воды при атмосферном давлении разбит на сто равных частей (°С). Термодинамическая абсолютная шкала (шкала Кельвина), в которой 1 К (кельвин) равен 1/273,16 частей интервала от абсолютного нуля температуры, когда прекращается тепловое движение молекул, до температуры тройной точки воды, т. е. температуры, при которой могут одновременно существовать лед, вода и пар.
За параметр состояния в термодинамике принимают термодинамическую абсолютную температуру Т К ≈ t °С + 273. В некоторых странах используются шкалы Фаренгейта (°F), Ренкина (°Rа), Реомюра (°R), для пересчета которых можно использовать следующие соотношения:
T °R = 0,8t °С. Количество рабочего тела, участвующего в термодинамических процессах, может быть задано в кг, м3 и в молях (киломолях). В термодинамических расчетах иногда бывает удобнее в качестве количественной единицы рабочего тела использовать кубический метр при нормальных физических условиях V, м3, характеризуемых давлением 1,013 × 105 Па (760 мм рт. ст.) и температурой 0 °С. Количество рабочего тела может измеряться также киломолями. Киломолем называется масса вещества в кг, численно равная его молекулярной массе, μ *. Объем моля V в μ раз больше удельного объема v, м3/кмоль
Пример. Определить абсолютное давление в конденсаторе, если вакуумметр, установленный на нем, показывает разрежение, рразр = 660 мм рт. ст. Показание барометра рбар = 744 мм рт. ст. Решение. рабс = рбар – рразр = ЗАДАЧИ
1-1. Давление в паровом котле р = 1 МПа при барометрическом давлении 735 мм рт. ст. Как изменится избыточное давление в котле, если показание барометра понизится до 450 мм рт. ст., а состояние пара в котле останется прежним? Ответ: рман = 10,38 × 105 Па. 1-2. Пневматический пресс, поршень которого имеет диаметр 400 мм, должен действовать с силой 50 кН. Каково должно быть абсолютное давление воздуха в цилиндре при атмосферном давлении 750 мм. рт. ст. Ответ: рабс = 1,4 × 105 Па. 1-3. К дымоходу парового котла для измерения разрежения присоединен тягомер (рис. 1-3), угол наклона трубки которого a = 30 є. Длина столба воды воды, отсчитанная по наклонной шкале, l = 200 мм. Определить абсолютное давление газа, если показание ртутного барометра 745 мм рт. ст. при температуре столба ртути t = 25 °C.
Ответ: рабс = 0,978 × 105 Па. 1-4. 5 кг воздуха в некотором состоянии занимают объем 2,7 м3. Определить удельный объем и плотность воздуха в этом состоянии. Ответ: v = 0,54 м3/кг, ρ = 1,85 кг/м3. 1-5. 5,4 кг углекислого газа при температуре t = 15 °С и давлении p = 1 × 105 Па занимают объем 3 м3. Определить удельный объем и плотность углекислого газа при заданных условиях. Ответ: v = 0,555 м3/кг, ρ = 1,8 кг/м3. 1-6. Установленный на смазочной системе автомобильного двигателя манометр показывает давление 2,3 × 105 Па. Определить абсолютное давление смазки при барометрическом давлении 720 мм рт. ст. Ответ: рабс = 3,26 × 105 Па. 1-7. Какой объем занимают 1,3 кг воздуха при давлении, равном 1 × 105 Па, и температуре 100 °С, если, плотность воздуха при 1 × 105 Па и 15 °С равна 1,19 кг/ м3. Ответ: v = 1,42 л. 1-8. Какой объем занимают 3 т воздуха при нормальных физических условиях. Ответ: V = 2320 м3. 1-9. Какова масса 42 л кислорода при нормальных условиях? Ответ: М = 0,06 кг. 1-10. Какова масса 100 л газа, имеющего плотность 25 кг/м3? Ответ: M = 255 кг. 1-11. Определить вакуум в конденсаторе, если абсолютное давление 0,049 МПа, а барометрическое давление 750 мм рт. ст.? Ответ: р = 0,051 МПа. 1-12. Давление в баллоне 0,025 МПа при барометрическом давлении 690 мм рт. ст. Каково будет показание манометра, если атмосферное давление повысится до 775 мм рт. ст.? Ответ: р = 0,0147 МПа. 1-13. Тягомер, заполненный спиртом (ρ = 0,8 г/см3), показывает разрежение в газоходе 50 мм. сп. ст. Определить абсолютное давление дымовых газов, если показание барометра 757 мм рт. ст., приведенное к 0 ° С. Ответ: р = 0,0955 МПа. 1-14. Определить силу, действующую на поршень диаметром 150 мм, если давление в цилиндре 49 × 105 Па. Барометрическое давление 750 мм рт. ст. Ответ: Р = 9 т. 1-15. Разрежение в дымовой трубе 30 мм вод. ст., атмосферное давление 763 мм. рт. ст. при температуре 30 °С. Определить абсолютное давление дымовых газов. Ответ: р = 0,101 МПа. 1-16. Манометр показывает давление 800 мм вод. ст. при барометрическом давлении 780 мм рт. ст. При другом наблюдении показания приборов оказались соответственно 600 мм вод. ст. и 795 мм рт. ст. Как изменилось абсолютное давление? Ответ: р = 0,112 МПа не изменилось. 1-17. В машинно-котельном отделении судна давление по водяному манометру 120мм вод. ст. Барометр на палубе показывает 750 мм рт. ст. По показаниям манометра на котле рабочее давление составляет 3,0 МПа. Разрежение в конденсаторе по вакуумметру 610 мм рт. ст. Определить абсолютные давления в машинно-котельном отделении, в котле и в конденсаторе. Ответ: рмко = 0,101 МПа; рк = 3,08 МПа; рконд = 0,0196 МПа. 1-18. Определить абсолютное давление в трубопроводе, если разность уровней ртути в манометре составляет h1 = 515 мм, а высота столба воды, налитой поверх ртути, h2 = 50 мм. Давление окружающей среды 0,106 МПа (рис. 1-2). Ответ: р = 1,75 × 105 Па. 1-19. Судно на воздушной подушке имеет размеры L= 20 м, B = 5 м, масса 4 т. Какое избыточное давление в мм вод. ст. должен создавать вентилятор, чтобы оно опиралось на воздушную подушку? Ответ: р = 40 мм вод. ст. 1-20. Определить массу воздуха, заключенного в баллоне емкостью 400 л, если плотность воздуха при некоторых давлении и температуре 28,6 кг/м3. Ответ: М= 11,44 кг. 1-21. Масса 1 м3 метана при определенных условиях составляет 0,7 кг. Определить плотность и удельный объем метана при этих условиях.
Ответ: р = 0,7 кг/м3; v = 1,429 м3/кг. 1-22. Плотность воздуха при определенных условиях равна 1,293 кг/м3. Определить удельный объем воздуха при этих условиях. Ответ: v = 0,773 м3/кг. 1-23. В сосуде объемом 0,9 м3 находится 1,5 кг окиси углерода. Определить удельный объем и плотность окиси углерода при указанных условиях. Ответ: v = 0,6 м3/кг; р = 1,67 кг/м3. 1-24. Давление воздуха по ртутному барометру равно 770 мм рт. ст. при 0 °С. Выразить это давление в Паскалях. Ответ: р = 102 660 Па = 102,7 кПа. 1-25. Давление воздуха, измеренное ртутным барометром, равно 765 мм рт. ст. при температуре ртути t = 20° С. Выразить это давление в паскалях. Ответ: В = 101 640 Па. 1-26. Определить абсолютное давление в сосуде (см. рис. 1.1), если показание присоединенного к нему ртутного манометра равно 66,7 кПа (500 мм рт. ст.), а атмосферное давление по ртутному барометру составляет 100 кПа (750 мм рт. ст.). Температура воздуха в месте установки приборов равна 0 °С. Ответ: ра6с = 0,1667 МПа. 1-27. Определить абсолютное давление в паровом котле, если манометр показывает 0,245 МПа, а атмосферное давление по ртутному барометру составляет В = 93 325 Па (700 мм рт. ст.) при t = 20 °С. Ответ: р = 0,338 МПа. 1-28. Какая высота водяного столба соответствует 10 Па? Ответ:. h = 1 мм. 1-29. Какая высота ртутного столба соответствует 100 кПа? Ответ: h = 750 мм. 1-30. Определить абсолютное давление в конденсаторе паровой турбины, если показание присоединенного к нему ртутного вакуумметра равно 94 кПа (705 мм рт. ст.), а показание ртутного барометра, приведенное к 0 °С, В0 = 99,6 кПа (747мм рт. ст.). Температура воздуха в месте установки приборов t = 20 °С. Ответ: р = 60 кПа. Глава II.
Идеальными называются газы, в которых отсутствуют силы взаимодействия между молекулами, а объемом самих молекул можно пренебречь, считая его бесконечно малым по сравнению с занимаемым ими объемом. При высоких температурах и малых давлениях реальные газы практически не отличаются от идеальных. Зависимость между параметрами идеального газа описывается законами Бойля-Мариотта, Гей-Люссака. Закон Бойля — Мариотта. При постоянной температуре объем газа изменяется обратно пропорционально его давлению
Закон Гей-Люссака. При постоянном давлении удельные объемы газа изменяются прямо пропорционально абсолютным температурам
Совместное решение законов Бойля-Мариотта и Гей-Люсссака позволяет получить уравнение состояния или характеристическое уравнение идеального газа
показывающее, что произведение удельного объема газа на давление, деленное на абсолютную температуру, есть величина постоянная. Постоянную величину называют газовой постоянной R (или индивидуальной газовой постоянной)
Газовая постоянная представляет собой работу 1 кг газа при постоянном давлении и при изменении его температуры на 1 К (или на 1 °С). Уравнение состояния записывается: для 1 кг газа рv = RТ; для М кг газа рV = МRТ. Закон Авогадро. В равных объемах различных идеальных газов при одинаковых температурах и давлениях содержится одинаковое число молекул, откуда вытекает, что при одинаковых физических условиях произведение молекулярной массы газа на его удельный объем есть величина постоянная m v = const. При нормальных физических условиях объем моля газа Vμ = 22,4 м3/моль. Данное утверждение справедливо в первую очередь для двухатомных газов. Для одноатомных, трех- и более атомных газов значение V μ отличается от этого значения (см. приложение 1). Уравнение состояния для 1 моля газа, pV μ = μ RT, откуда универсальная газовая постоянная
Подставив значения параметров при нормальных физических условиях (р = 1,013 × 105 Па, Vμ = 22,4 м3/кмоль, Т = 273 К), получим уравнение состояния для 1 моля pV μ = 8314 T. Для N молей уравнение состояния имеет вид pV = 8314 NT. Зная значение универсальной газовой постоянной μ R = 8314 Дж/(кмоль × К), можно найти значение индивидуальной газовой постоянной для любого газа
Пример. Каково давление в резервуаре емкостью 0,5 м3, если в нем содержится 0,945 кг водорода при температуре 25 °С? Решение. Давление водорода находим из уравнения состояния где R = 4124 Дж/(кг × К) — газовая постоянная водорода. Пример. Какой объем занимает смесь, состоящая из 0,8 молей одного газа и 0,4 моля другого газа при давлении 2,94 × 105 Па и температуре 45 °С? Решение. Число молей смеси газа N = 0,8 + 0,4 = 1,2 моля. Из уравнения состояния для N молей газа определим объем смеси
Пример. Чему равна плотность идеального газа при 11,76 × 105 Па и 60 °С, если при 2,94 × 105 Па и 10 °С его плотность 4 кг/м3? Решение. Запишем уравнение состояния для первого и для второго состояний, зная что
Поделив почленно первое уравнение на второе, получим
из которого определяем плотность газа
Пример. Баллон с воздухом при давлении 12,26 МПа и температуре 25 ºС имеет массу 36,12 кг. В результате выпуска части воздуха масса стала равной 35,21 кг. Давление воздуха снизилось до 8,83 МПа, а температура — до 15 ºС. Каким будет давление в баллоне при температуре 25 ºС, если из него выпустить еще 0,5 кг воздуха? Решение. Масса баллона Мб и воздуха в нем Мв в начальном состоянии М6 + Мв1 = 36,12 кг; масса баллона с воздухом после выпуска первой порции воздуха М6 + Мв2 = 35,21 кг. Вычитая из первого уравнения второе, определим массу выпущенной первой порции воздуха Мв1 – Мв2 = 36,12 – 35,21 = 0,91 кг.
Используя уравнение состояния, находим
Отсюда находим емкость баллона V = 0,025 м3 = 25 л. Масса воздуха в баллоне после выпуска части воздуха масса воздуха после дополнительного выпуска 0,5 кг Мв = Мв2 – 0,5 = 2,67 – 0,5 = 2,17 кг. Давление воздуха в этом случае
ЗАДАЧИ 2-1. Определить объем 5 кг углекислого газа при температуре 17 ºС и давлении 0,147 МПа. Ответ: V = 1,86 м3. 2-2. Определить массу воздуха в баллоне емкостью 400 л, если давление по манометру 1,5 МПа, а температура 27 °С. Барометрическое давление 740 мм рт. ст. Ответ: М = 7,3 кг. 2-3. Определить давление в баллоне емкостью 100 л при температуре 15 °С, если в нем содержится 0,5 м3 кислорода при нормальных физических условиях. Ответ: р = 0,514 МПа. 2-4. Какой объем занимают 2 кг воздуха при давлении 4,9 МПа и температуре 20 °С? Ответ: V = 0,0343 м3. 2-5. При какой температуре 10 кг азота имеют объем 30 л, если его давление 14,7 × 105 Па? Барометрическое давление 760 мм рт. ст. Ответ: t = –123 °С. 2-6. Какую температуру имеет кислород, сжатый до 1,275 МПа, если объем его 30 кг равен 0,5 м3? Ответ: t = 85 °С. 2-7. Сколько килограммов воздуха израсходовано на пуск двигателя, если давление в баллоне емкостью 400 л снизилось с 2,94 до 2,45 МПа? Ответ: D М = 2,78 кг. 2-8. Как изменится объем продуктов горения топлива, если температура снизится от 1500 до 500 °С при неизменном давлении? Ответ: в 2,3 раза. 2-9. Объем газа при температуре 15 °С равен 0,8 м3. Каким будет объем этого газа, если температуру повысить до 30 °С, не изменяя давления? Ответ: V = 0,84 м3. 2-10 100 м3 воздуха при температуре 30 °С нагреваются в воздухоподогревателе до 90 °С при постоянном давлении. Какой объем будет занимать нагретый воздух? Ответ: V =120 м3. 2-11. Во сколько раз уменьшился объем газа при постоянной температуре, если давление увеличилось с 0,196 до 0,49 МП а? Барометрическое давление 735,6 мм рт. ст. Ответ: в 2 раза. 2-12. 4 м3 газа сжимаются при постоянной температуре от 2,94 × 105 Па до 6,87 × 105 Па. Каков конечный объем газа? Барометрическое давление 750 мм рт. ст. Ответ: V = 2 м3. 2-13. В резервуаре емкостью 2 м3 находится воздух при температуре — 15 °С. Вакуумметр показывает разрежение 200 мм рт. ст. барометрическое давление 740 мм рт. ст. Определить массу воздуха. Ответ: М = 1,94 кг. 2-14. Какое давление будет показывать манометр, установленный на баллоне емкостью 40 л, если баллон наполнить 1,13 кг азота при температуре 20 °С? Барометрическое давление 765 мм рт. ст. Ответ: р = 0,231 МПа. 2-15. В резервуаре емкостью 20 м3 находится смесь газов, состоящая из 0,6 моля углекислого газа и 1,3 моля азота. Давление по манометру равно 0,15 МПа. Барометрическое давление 745мм рт. ст. Какова температура смеси? Ответ: t = 38 °С. 2-16. Два баллона одинаковой емкости заполнены одинаковой массой различных газов: метана и кислорода. Температура обоих газов одинакова. Одинаково ли давление в баллонах? Ответ: Давление в баллоне, содержащем метан, приблизительно в 2 раза больше, чем в баллоне, содержащем кислород. 2-17. Чему равен объем азота при давлении 0,589 МПа и температуре 40 °С, если при температуре 0 °С и давлении 0,196 МПа он равен 3 м3? Ответ: V = 11,47 м3. 2-18. Как изменится плотность воздуха, если его абсолютное давление возрастет в два раза, а температура повысится от 5 °С до 100 °С? Ответ: увеличится в 1,49 раза. 2-19. В баллоне находится газ при температуре –15 °С и давлении 4,12 МПа. Каким будет давление в баллоне, если его перенесут в помещение, где температура газа повысится до 30 °С? Барометрическое давление при этом не остается постоянным и равно 750 мм рт. ст. Ответ: р = 4,86 МПа. 2-20. По трубопроводу протекает 4 м3/мин кислорода при давлении 1,47 × 105 Па и температуре 17 °С. Какая масса газа протечет в течение 20 мин? Ответ: М = 156 кг. 2-21. За какое время компрессор, всасывающий 3 м3/мин воздуха, заполнит резервуар емкостью 1,5 м3 до давления 3,92 × 105 Па? Температура воздуха в резервуаре повышается от 10 °С до 70 °С. Барометрическое давление 765 мм рт. ст. Ответ: τ =1,49 мин. 2-22. В баллоне емкостью 20 л находится 2,62 кг азота при температуре 20 °С. Какая масса газа выпущена из баллона, если давление понизилось в 2 раза, а температура упала до 5 °С? Ответ: М = 1,24 кг. 2-23. Производительность компрессора при давлении 0,0981 МПа и температуре 10 °С равна 250 м3/час. За какое время он наполнит воздухом резервуар емкостью 25 м3 от давления 0,049 до 0,49 МПа? Изменением температуры воздуха пренебречь. Барометрическое давление 736 мм Ответ: τ = 27,2 мин. 2-24. Открытый сосуд (сообщенный с атмосферным воздухом при давлении 0,1 МПа и температуре 17 °С) емкостью 2 м3 нагревают до 400 °С, после чего разобщают с атмосферой и охлаждают. Какое количество воздуха вытекло из сосуда при нагревании? Какое давление установится в сосуде, когда температура воздуха в нем станет равной первоначальной? Ответ: М = 1,37 кг; р2 = 0,043 МПа. 2-25. Баллон, содержащий кислород под давлением 12,75 МПа, имеет массу 35,1 кг. В результате выпуска части газа масса баллона стала равной 33,2 кг, а давление снизилось до 7,36 МПа. Какое давление установится в баллоне, если из него выпустить еще 0,85 кг кислорода? Температура газа во всех указанных случаях одинакова и равна 15 °С. Ответ: р = 4,95 МПа. 2-26. В цилиндре диаметром 0,6 м содержится 0,41 м3 воздуха при р = 0,25 МПа и t1 = 35 °С. До какой температуры должен нагреваться воздух при постоянном давлении, чтобы движущийся без трения поршень поднялся на 0,4 м? Ответ: t 2 = 117,6 °С. 2-27. В цилиндрическом сосуде, имеющем внутренний диаметр d = 0,6 м и высоту h = 2,4 м, находится воздух при температуре 18 °С. Давление воздуха составляет 0,765 МПа. Барометрическое давление (приведенное к нулю) равно 101 858 Па. Определить массу воздуха в сосуде. Ответ: М = 7,04 кг. 2-28. Баллон с кислородом емкостью 20 л находится под давлением 10 МПа при 15 °С. После израсходования части кислорода давление понизилось до 7,6 МПа, а температура упала до 10 °С. Определить массу израсходованного кислорода. Ответ: M = 0,606 кг. 2-29. В сосуде объемом 0,5 м3 находится воздух при давлении 0,2 МПа и температуре 20 °С. Сколько воздуха надо выкачать из сосуда, чтобы разрежение в нем составило 56 кПа при условии, что температура в сосуде не изменится? Атмосферное давление по ртутному барометру равно 102,4 кПа при температуре ртути в нем, равной 18 °С; разрежение в сосуде измерено ртутным вакуумметром при температуре ртути 20 °С. Ответ: М = 1,527 кг. 2-30. Резервуар объемом 4 м3 заполнен углекислым газом. Найти массу и силу тяжести (вес) газа в резервуаре, если избыточное давление газа р = 40 кПа, температура его t = 80 °С, а барометрическое давление воздуха В = 102,4 кПа. Ответ: М = 8,64 кг; G = 84,8 Н. 2-31. Определить плотность и удельный объем водяного пара при нормальных условиях, принимая условно, что в этом состоянии пар будет являться идеальным газом. Ответ: рн = 0,804 кг/м3; v = 1,243 м3/кг. 2-32. Во сколько раз больше воздуха (по массе) вмещает резервуар при 10 °С, чем при 50 °С, если давление остается неизменным? Ответ: в 1,14 раза.
Глава III. В соответствии с законом Дальтона давление смеси газов равно сумме парциальных давлений компонентов смеси р = р1 + р2 + … + р n = Σр i. Объем смеси газов равен сумме парциальных объемов, т. е. объемов отдельных компонентов, приведенных к давлению и температуре смеси: V = V 1 + V 2 + … + Vn = Σ Vi. Для газовой смеси справедливо уравнение состояния идеального газа, если в него вводится газовая постоянная смеси pV = VRcT, состав газовой смеси может быть задан: – массовыми долями
– объемными долями
Объемные доли могут быть также найдены как отношение числа молей компонента к общему числу молей всей смеси
Для перевода массовых долей в объемные и обратно могут быть использованы следующие соотношения:
Пересчет состава смеси с массовых долей в объемные и обратно наиболее часто производится по формулам
полученным из вышеприведенных соотношений. Из этого же соотношения можно получить значения параметров смеси, если задан ее массовый или объемный состав: – удельный объем смеси газов, м3 / кг
– плотность смеси газов, кг / м3
– газовая постоянная смеси газов, Дж/(кг × К)
– кажущаяся молекулярная масса смеси газов
Газовая постоянная и кажущаяся молекулярная масса смеси газов могут быть также определены из выражения μс Rc =8314 Дж/(моль × К). Парциальное давление компонентов, входящих в смесь, определяется по формуле ρ i = ri ρ. Пример. Дымовые газы, уходящие из котла, имеют следующий состав по объему: СО2 = 14,5 %; O2 = 4,5 %; СО = 2,0 %; N2 = 79 %. Определить массовые доли, газовую постоянную, кажущуюся молекулярную массу и плотность дымовых газов при температуре 220 ºС и давлении 716 мм. рт. ст. Решение. Определяем кажущуюся молекулярную массу смеси по формуле
Массовый состав дымовых газов определяем по формулам
Проверка:
Газовая постоянная дымовых газов определяется из уравнения
Плотность дымовых газов
где
Пример. Сухой генераторный газ из антрацита состоит из 12 молей углекислого газа, 64 моля окиси углерода, 24 моля водорода и 120 молей азота. Определить объемные и массовые доли и парциальные объемы компонентов при температуре 27 ºС и давлении 0,118 МПа. Решение. Число молей смеси определяется как сумма чисел молей компонентов
Объемный состав генераторного газа
Кажущаяся молекулярная масса смеси
Массовый состав генераторного газа
Парциальные объемы компонентов смеси определяются из уравнения pVi =8314NiT;
Пример. В сосуде находится смесь кислорода и азота при температуре 50 ºС. Плотность кислорода в смеси 1,81 кг/м3. Определить плотность смеси газов и давление, под которым находится смесь, если ее объемный состав следующий: Решение. Парциальное давление кислорода определяется по формуле
Давление смеси
Кажущаяся молекулярная масса смеси
Газовая постоянная смеси
Плотность смеси
Пример. Газовая смесь, состоящая из двух компонентов, находится в сосуде объемом 2 м3 под давлением 0,5 МПа при температуре 17 ºС. Определить массу смеси в сосуде. Определить также. Из каких компонентов состоит смесь, если одним из компонентов является окись углерода. Парциальное давление окиси углерода 0,3 МПа. Кажущаяся молекулярная масса смеси 17,6. Решение. Газовая постоянная смеси
Парциальное давление неизвестного газа px = p – рСО = 0,5 – 0,3 = 0,2 МПа. Объемные доли компонентов
Молекулярная масса неизвестного газа
По значению молекулярной массы определяем, что вторым компонентом является водород. Масса смеси газов
ЗАДАЧИ
3-1. Определить массовый состав и массу газовой смеси в баллоне емкостью 33 л, если давление смеси 1,2 МПа, а температура 40 ºС. Объемный состав смеси: СО2 = 15 %, N2 = 83 %, O2 = 2 %. Ответ: 3-2. Принимая, что сухой воздух состоит из 21 объемной части кислорода и 79 объемных частей азота, определить массовый состав воздуха, его газовую постоянную, кажущуюся молекулярную массу и плотность при нормальных условиях. Ответ: 3-3. Смесь газа состоит из 4 молей азота, 2 молей углекислого газа и 2 молей кислорода. Определить объемный и массовый составы смеси и его газовую постоянную. Ответ: 3-4. При сгорании 1 кг жидкого топлива образуется 20 кг дымовых газов, имеющих следующий объемный состав: CO2 = 8 %, O2 = 13 %, N2 = 79 %. Определить массу каждого компонента дымовых газов при сгорании 100 кг топлива. Ответ: 3-5. В сосуде объемом 1 м3 при давлении 0,195 МПа находится смесь азота и углекислого газа при температуре 50 ºС. Масса азота в сосуде 1,5 кг. Определить массовые и объемные доли и массу углекислого газа. Ответ: 3-6. В резервуаре объемом 20 м3 находится смесь газа, объемный состав которой СО2 = 13 %; О2 = 7 %; N2 = 80 %. Смесь находится под разрежением 250 мм. рт. ст. При температуре 20 ºС. Барометрическое давление 740 мм. рт. ст. Определить массу смеси газов в резервуаре. Ответ: М = 16 кг. 3-7. Какой объем будут занимать 10 молей газовой смеси, имеющей следующий объемный состав: Ответ: V = 100,5 м3; 3-8. Горючий газ, состоящий из водорода и метана, при давлении 0,05 МПа и температуре 25 ºС находится в сосуде емкостью 2,5 м3. Газовая постоянная горючего газа 2000 Дж/(кг∙К). Определить массовые, объемные доли и массу газа в сосуде. Ответ: 3-9. В котле при сгорании топлива образуются дымовые газы следующего состава по объему: СО2 = 12 %; СО = 1,5 %; O2 = 7 %; N2 = 79,5 %. Определить плотность и удельный объем дымового газа, если его температура 250 ºС, а давление 720 мм рт. ст. Ответ: ρ = 0,565 кг/м3, v = 1,77 м3/кг. 3-10. В баллоне объемом 30 л находится горючий газ следующего состава по объему: Ответ: τ = 11,2 ч. 3-11. Какова объемная доля азота в уходящих газах двигателя внутреннего сгорания, если объем остальных составляющих выпускных газов следующий: СО2 = 13,5; O2 = 6 %; СО = 1,0 %. Определить массовые доли компонентов смеси, газовую постоянную и кажущуюся молекулярную массу уходящих газов. Ответ: 3-12. Природный газ, имеющий следующий объемный состав: СН4 = 93 %;
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2020-10-24; просмотров: 1879; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.118.126.241 (0.284 с.) |
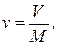

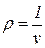 .
.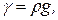
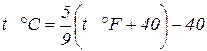 ;
;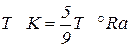 ;
;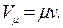
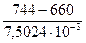 = 11 196 Па.
= 11 196 Па.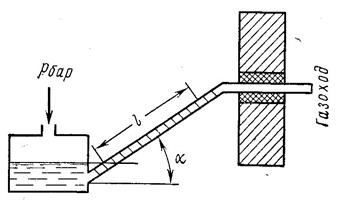
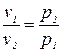 .
.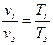
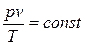 ,
,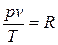 Дж/(кг × К).
Дж/(кг × К).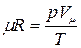 .
. Дж/(кг × К).
Дж/(кг × К).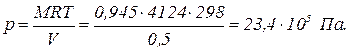
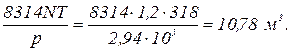
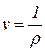 ,
,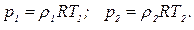
 ,
,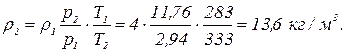

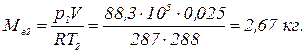


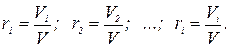

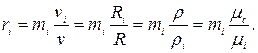
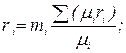
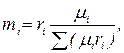




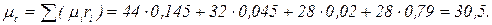


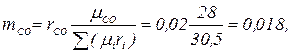
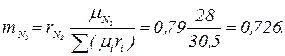
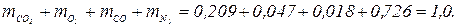
 Дж/(кг × К).
Дж/(кг × К). кг / м3,
кг / м3,

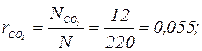
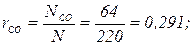




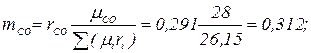

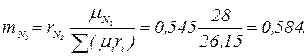

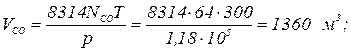
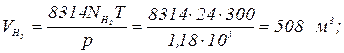


 .
.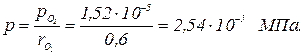
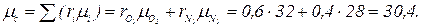
 Дж/(кг × К)).
Дж/(кг × К)).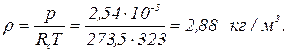
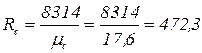 Дж/(кг × К)).
Дж/(кг × К)).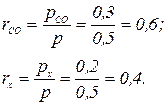

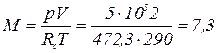 кг.
кг. = 0,216,
= 0,216,  = 0,763,
= 0,763,  = 0,021, M =0,462 кг.
= 0,021, M =0,462 кг.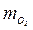 = 0,232;
= 0,232; 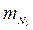 = 0,768; Rв = 287 Дж/(кг∙К); μв = 29; ρв = = 1,293 кг/м3.
= 0,768; Rв = 287 Дж/(кг∙К); μв = 29; ρв = = 1,293 кг/м3.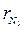 = 0,5;
= 0,5;  = 0,25;
= 0,25; 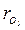 = 0,25; = 0,425;
= 0,25; = 0,425; 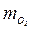 = 0,242; Rc = 253 Дж/(кг∙К).
= 0,242; Rc = 253 Дж/(кг∙К).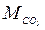 =12,8 кг;
=12,8 кг; 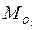 = 13,9 кг;
= 13,9 кг;  =74,3 кг.
=74,3 кг.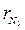 = 0,735;
= 0,735; 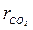 = 0,265;
= 0,265;  = 0,638;
= 0,638;  = 0,362;
= 0,362;  = 0,85 кг.
= 0,85 кг.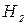 = 40 %; СН4 = 35 %; СО = 15 %; N2 = 10 % при давлении 0,3 МПа и температуре 90 ºС. Определить также массовый состав, газовую постоянную и кажущуюся молекулярную массу смеси.
= 40 %; СН4 = 35 %; СО = 15 %; N2 = 10 % при давлении 0,3 МПа и температуре 90 ºС. Определить также массовый состав, газовую постоянную и кажущуюся молекулярную массу смеси.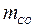 = 0,314;
= 0,314;  = 0,059;
= 0,059; 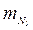 = 0,209;
= 0,209;  = 0,418; μс = 13,4; Rc = 620 Дж/(кг∙К).
= 0,418; μс = 13,4; Rc = 620 Дж/(кг∙К).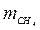 = 0,604;
= 0,604;  = 0,165;
= 0,165; 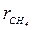 = 0,835; М = 0,64 кг.
= 0,835; М = 0,64 кг.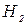 = 15 %; СН4 = 20 %; СО = 5 %; N2 = 60 %. Давление газа по манометру 1,2 МПа, температура 25 ºС. Барометрическое давление 745 мм рт. ст. Часовой расход горючего газа на горелку 0,30 кг/ч. Определить время работы газовой горелки.
= 15 %; СН4 = 20 %; СО = 5 %; N2 = 60 %. Давление газа по манометру 1,2 МПа, температура 25 ºС. Барометрическое давление 745 мм рт. ст. Часовой расход горючего газа на горелку 0,30 кг/ч. Определить время работы газовой горелки.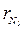 = 0,8;
= 0,8; 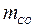 = 0,009;
= 0,009; 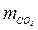 = 0,189;
= 0,189; 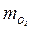 = 0,063; μс = 30,32; Rc = 275 Дж/(кг∙К).
= 0,063; μс = 30,32; Rc = 275 Дж/(кг∙К).


