
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Укажите уравнение обратимой реакции.Стр 1 из 2Следующая ⇒
Химическое равновесие Химическое равновесие – состояние системы, при котором скорость прямой реакции равна скорости обратной реакции. аА + вВ
В состоянии равновесия прямая и обратная реакция не прекращаются, поэтому равновесие называют динамичным. Концентрации всех веществ остаются постоянными. При изменении давления, температуры, концентрации веществ происходит смещение химического равновесия. Направление смещения равновесия определяется принципом Ле Шателье: если на систему, находящуюся в равновесии, производится внешнее воздействие (изменяется давление, температура, концентрация вещества), то оно способствует протеканию той из двух противоположных реакций, которая ослабляет воздействие. Факторы влияющие на смещение равновесия: 1.Котцентрация. При увеличении концентрации реагирующих веществ химическое равновесие смещается в сторону образования продуктов реакции ( 2.Давление. При увеличении давления химическое равновесие системы смещается в сторону той реакции, при которой объем образующихся газообразных веществ меньше. При увеличении давления равновесие смещается в сторону меньшего объема, а при уменьшении - в сторону большего объема. 2H3N
2V 4V Если исходные вещества и продукты реакции занимают одинаковый объем, то давление не будет влиять на смещение равновесия, например: А + В 2 3. Температура. При повышении температуры химическое равновесие системы смещается в сторону эндотермической реакции (-Q); N2 + O2 ⇄ 2NO – 180,8 кДж при понижении температуры – в сторону экзотермической реакции (+Q). H2 + Cl2
Вопросы для закрепления знаний по данной теме: Инструкция для обучающихся. При выполнении заданий уровня А (часть 1 ЕГЭ) - задания 1- 5 нужно выбрать среди предложенных ответов один верный и указать его номер, а при выполнении задании 6 – впи-шите слово, заканчивающее данное утверждение. При выполнении заданий уровня Б (часть 2 ЕГЭ) - задание 7 нужно установить соответствие между буквой и цифрой. Цифры в ответе могут повторяться. I Вариант: Укажите уравнение обратимой реакции. 1) 2NaOH + H2SO4 = Na2SO4 + 2H2O; 2) N2 + 3H2 = 2NH3; 3) AlCl3 + 3NaOH = Al(OH)3↓ + 3NaCl; 4) Li2O + 2HCl = 2LiCl + H2O. Установите соответствие между названием вещества и видом химической связи, с помощью которой оно образовано. НАЗВАНИЕ ВЕЩЕСТВА ВИД ХИМИЧЕСКОЙ СВЯЗИ 1) алюминий А) ковалентная полярная 2) хлорид калия Б) ионная 3) азот В) ковалентная неполярная 4) аммиак Г) металлическая Д) водородная Критерии оценки: Оценка «5» - написание конспекта и ответы на семь вопросов «4» - написание конспекта и ответы на пять – шесть вопросов «3» - написание конспекта и ответы на три - четыре вопроса
Вопросы для закрепления знаний по данной теме: Инструкция для обучающихся. При выполнении заданий уровня А (часть 1 ЕГЭ) - задания 1- 5 нужно выбрать среди предложенных ответов один верный и указать его номер, а при выполнении задании 6 – впи-шите слово, заканчивающее данное утверждение. При выполнении заданий уровня Б (часть 2 ЕГЭ) - задание 7 нужно установить соответствие между буквой и цифрой. Цифры в ответе могут повторяться.
II Вариант: Критерии оценки: Оценка «5» - написание конспекта и ответы на семь вопросов «4» - написание конспекта и ответы на пять – шесть вопросов «3» - написание конспекта и ответы на три - четыре вопроса
Вопросы для закрепления знаний по данной теме: Инструкция для обучающихся. При выполнении заданий уровня А (часть 1 ЕГЭ) - задания 1- 5 нужно выбрать среди предложенных ответов один верный и указать его номер, а при выполнении задании 6 – впи-шите слово, заканчивающее данное утверждение. При выполнении заданий уровня Б (часть 2 ЕГЭ) - задание 7 нужно установить соответствие между буквой и цифрой. Цифры в ответе могут повторяться. III Вариант:
Критерии оценки: Оценка «5» - написание конспекта и ответы на семь вопросов «4» - написание конспекта и ответы на пять – шесть вопросов «3» - написание конспекта и ответы на три - четыре вопроса
Химическое равновесие Ключ к ответам: I Вариант: 1. 2; 2. 3; 3. 1; 4. 4; 5. 4; 6 .ингибиторы; 7. Г, Б, В, А.
II Вариант: 1. 1; 2. 1; 3. 2; 4. 4; 5. 1; 6. гетерогенной; 7. В, А, Г, Б. III Вариант: 1. 4; 2. 2; 3. 1; 4. 3; 5. 2; 6. температуры; 7. Д, В, Г, Б. Критерии оценки: Оценка «5» - написание конспекта и ответы на семь вопросов «4» - написание конспекта и ответы на пять – шесть вопросов «3» - написание конспекта и ответы на три - четыре вопроса
Химическое равновесие Химическое равновесие – состояние системы, при котором скорость прямой реакции равна скорости обратной реакции. аА + вВ
В состоянии равновесия прямая и обратная реакция не прекращаются, поэтому равновесие называют динамичным. Концентрации всех веществ остаются постоянными. При изменении давления, температуры, концентрации веществ происходит смещение химического равновесия. Направление смещения равновесия определяется принципом Ле Шателье: если на систему, находящуюся в равновесии, производится внешнее воздействие (изменяется давление, температура, концентрация вещества), то оно способствует протеканию той из двух противоположных реакций, которая ослабляет воздействие. Факторы влияющие на смещение равновесия: 1.Котцентрация. При увеличении концентрации реагирующих веществ химическое равновесие смещается в сторону образования продуктов реакции ( 2.Давление. При увеличении давления химическое равновесие системы смещается в сторону той реакции, при которой объем образующихся газообразных веществ меньше. При увеличении давления равновесие смещается в сторону меньшего объема, а при уменьшении - в сторону большего объема. 2H3N
2V 4V Если исходные вещества и продукты реакции занимают одинаковый объем, то давление не будет влиять на смещение равновесия, например: А + В 2 3. Температура. При повышении температуры химическое равновесие системы смещается в сторону эндотермической реакции (-Q);
N2 + O2 ⇄ 2NO – 180,8 кДж при понижении температуры – в сторону экзотермической реакции (+Q). H2 + Cl2
Вопросы для закрепления знаний по данной теме: Инструкция для обучающихся. При выполнении заданий уровня А (часть 1 ЕГЭ) - задания 1- 5 нужно выбрать среди предложенных ответов один верный и указать его номер, а при выполнении задании 6 – впи-шите слово, заканчивающее данное утверждение. При выполнении заданий уровня Б (часть 2 ЕГЭ) - задание 7 нужно установить соответствие между буквой и цифрой. Цифры в ответе могут повторяться. I Вариант: Укажите уравнение обратимой реакции. 1) 2NaOH + H2SO4 = Na2SO4 + 2H2O; 2) N2 + 3H2 = 2NH3; 3) AlCl3 + 3NaOH = Al(OH)3↓ + 3NaCl; 4) Li2O + 2HCl = 2LiCl + H2O.
|
|||||||
|
Последнее изменение этой страницы: 2020-10-24; просмотров: 80; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.191.44.23 (0.023 с.) |
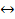 сС + dD
сС + dD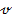 пр. =
пр. =  𝓋обр.); при увеличении концентрации продукции реакции – в сторону образования исходных веществ (𝓋пр.
𝓋обр.); при увеличении концентрации продукции реакции – в сторону образования исходных веществ (𝓋пр.  𝓋обр.).
𝓋обр.).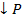
 3H2 + N2
3H2 + N2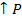
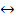 2
2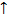 t
t t
t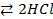 + 184,6кДж
+ 184,6кДж


