
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Урок: Теория электролиза. Электролиз расплавов и растворов.Стр 1 из 2Следующая ⇒
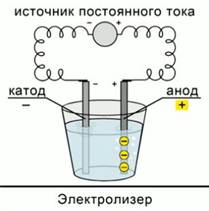
Урок: Теория электролиза. Электролиз расплавов и растворов. Цели: Изучение процесса электролиза Использование информационно–компьютерных технологий с целью повышения эффективности усвоения учебного материала. Задачи: -научить учащихся определять процессы, происходящие на электродах, составлять суммарные уравнения реакции электролиза; - научить учащихся пользоваться опорными знаниями, составлять опорный конспект урока; - углубить знания окислительно-восстановительных процессов, понимания практического значения электролиза в природе и жизни человека; -развивать мышление учащихся,научить их делать логические выводы из наблюдений; -закрепить умения работы с опорными конспектами и учебной литературой Тип урока: изучение нового материала Вид урока: проблемно-исследовательский Оборудование: Компьютер, проектор, экран. Ход урока Понятие электролиза Электролиз – это окислительно-восстановительная реакция, которая протекает под действием электрического тока на электродах, погруженных в раствор или расплав электролита. Существует два типа электродов. Анод – это электрод, на котором происходит окисление. Катод – это электрод, на котором происходит восстановление. К аноду стремятся анионы, так как он имеет положительный заряд. К катоду стремятся катионы, потому что он заряжен отрицательно и, согласно законам физики, разноименные заряды притягиваются. В любом электрохимическом процессе присутствуют оба электрода. Прибор, в котором осуществляется электролиз, называется электролизер. Рис. 1.
Рис. 1 Электролиз расплава I. Процессы, происходящие при электролизе расплавов электролитов В расплавах электролиты диссоциируют на ионы. Это термическая диссоциация электролитов. При пропускании электрического тока катионы восстанавливаются на катоде, так как принимают от него электроны. Анионы кислотного остатка и гидроксид-анионы окисляются на катоде, так как отдают ему свои электроны. Пример №1. Электролиз расплава хлорида натрия При термической диссоциации хлорида натрия образуются ионы натрия и хлора. Na Cl → Na+ + Cl−
– на катоде выделяется натрий: 2 Na+ + 2 e− → 2 Na – на аноде выделяется хлор: 2 Cl− − 2 e− → Cl2 – суммарное ионное уравнение реакции (уравнение катодного процесса помножили на 2) 2 Na+ + 2 Cl− → 2 Na0 + Cl02 – суммарная реакция: 2 NaCl Пример №2. Электролиз расплава гидроксида калия При электролизе расплавов щелочей и солей на катоде осаждается металл. 2. Анионы бескислородных кислот окисляются на аноде, давая соответствующее соединение, например, хлорид-анионы образуют хлор. Анионы кислородсодержащих кислот образуют соответствующий оксид и кислород. Электролиз раствора II. Процессы, происходящие при электролизе растворов электролитов При электролизе растворов электролитов, кроме интересующих нас соединений есть еще и вода, которая также может подвергаться электролизу. Поэтому, исходя из строения соединения, электролиз может протекать либо с ионами соли, либо с водой. Процессы, происходящие на катоде 1. Катионы активных металлов, стоящие в ряду напряжений до алюминия, не разряжаются на катоде. См. рис. 2. В этом случае происходит только восстановление воды.
Рис. 2 2Н2О+2 e− → Н2 + 2ОН− 2. Катионы металлов, расположенных в ряду напряжений от алюминия до водорода, разряжаются в той или иной степени одновременно с молекулами воды. При этом одновременно происходят следующие процессы: Men++ne- → Me 2Н2О+2 e− → Н2 + 2ОН− 3. При наличии в растворе катионов металлов, расположенных в ряду напряжений после водорода, на катоде, прежде всего, происходит восстановление катионов этих металлов. Men++ne- →Me Процессы, происходящие на аноде Различают два типа анодов: инертный и активный. Инертный анод – это анод, материал которого не окисляется в процессе электролиза (Pt). Активный анод – это анод, который окисляется в процессе электролиза. Например, графит. Электролиз с инертным анодом В анодном процессе могут принимать участие анионы некоторых бескислородных кислот Cl-,Br-,I-, S2-и гидроксид-ионы ОН -(разряжаются только эти анионы), например: 2Br- - 2е- →Br2; 4ОН− − 4 e− → О2 +2Н2О (в щелочной среде) Если в растворе присутствуют анионы F-,SO2-4, NO-3, PO43-, CO32- и некоторые другие, то окислению подвергается только вода:
2Н2О - 4 e− → О2 + 4Н+(в нейтральной и кислой среде) Электролиз с активным анодом В случае с активным анодом, число конкурирующих окислительных процессов увеличивается до трех: - Электрохимическое окисление материала анода - Окисление воды с выделением кислорода - Окисление анионов растворенного соединения Примеры написания уравнений электролиза Приведем примеры электролиза раствора некоторых веществ. Пример №1. Электролиз раствора хлорида натрия Список литературы 1. Рудзитис Г.Е. Химия. Основы общей химии. 11 класс: учебник для общеобразовательных учреждений: базовый уровень / Г.Е. Рудзитис, Ф.Г. Фельдман. – 14-е изд. – М.: Просвещение, 2012. Домашнее задание 1. №№2-4 (с. 89) Рудзитис Г.Е. Химия. Основы общей химии. 11 класс: учебник для общеобразовательных учреждений: базовый уровень / Г.Е. Рудзитис, Ф.Г. Фельдман. – 14-е изд. – М.: Просвещение, 2012. Что такое катод? Анод? Урок: Теория электролиза. Электролиз расплавов и растворов. Цели:
|
||||||
|
Последнее изменение этой страницы: 2020-11-11; просмотров: 53; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.222.21.30 (0.011 с.) |
 2 Na + Cl2
2 Na + Cl2



