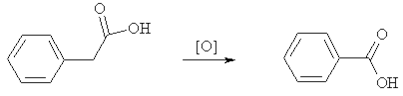Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Гомологический ряд, номенклатураСтр 1 из 3Следующая ⇒
Содержание Введение 1. Гомологический ряд, номенклатура 2. Получение карбоновых кислот 3. Строение карбоксила и карбоксилат-иона 4. Свойства карбоновых кислот 5. Основность 6. Восстановление 7. Окисление 8. Декарбоксилирование 9. Реакции углеводородного радикала Литература Введение
Класс карбоновых кислот объединяет соединения с функциональной группой - COOH, называемой карбоксилом. Карбоксильную группу можно рассматривать как симбиоз двух функциональных групп, изучавшихся нами ранее, а именно, карбонила и гидроксила.
В результате взаимного влияния эти группы придают карбоновым кислотам совокупность химических свойств, однако лишь часть из них имеет аналогию со свойствами спиртов и оксосоединений. Получение карбоновых кислот
Реакции окисления Ввиду того, что атом углерода карбоксильной группы находится в максимально возможной для функциональных групп степени окисления, равной +3, кислоты могут быть получены окислением терминального звена углеродной цепи. Действительно, спирты и альдегиды (но не алканы) легко окисляются до карбоновых кислот. Для этого используют широкий спектр окислителей - от таких мягких, как соли Cu (II) до сильнейших (CrO3 в серной кислоте, KMnO4). Как правило, альдегиды окисляются легче спиртов, поэтому окисление первичного спирта сильными окислителями идет до карбоновой кислоты, не останавливаясь на стадии промежуточного образования альдегида.
Кислоты ароматического ряда могут быть получены окислением углеводородных боковых цепей. Это связано с тем, что на первой стадии окисления происходит одного электрона или отрыв гидрид-иона от a-углеродного атома и образование катион-радикала или катиона, соответственно, которые резонансно-стабилизированны ароматическим кольцом. При окислении боковой цепи, содержащей 2, 3 и более атомов углерода, в карбоксил превращается лишь связанный с кольцом С-атом, все другие окислятся до СО2 и Н2О ("отгорание боковой цепи"). Среди ароматических соединений легче всего окисляются альдегиды, особенно, орто-замещенные. Бензальдегид быстро превращается в бензойную кислоту на воздухе.
Свойства карбоновых кислот
Водородные связи Кислоты в большей степени, чем спирты, образуют водородные связи, т.к. их молекулы более полярны и имеют карбонильный кислород, который является более основным, чем спиртовый гидроксил. Поэтому кислоты имеют более высокие температуры кипения, чем соединения других классов, имеющие такую же молекулярную массу. Например, температура кипения масляной кислоты и амилового спирта, имеющих молекулярную массу 88, составляет соответственно 162 и 138oС. В разбавленных растворах в неполярных средах и в газовой фазе карбоновые кислоты существуют в виде димеров.
Межмолекулярные водородные связи образуются между кислотами и водой, либо другими соединениями, имеющими неподеленные пары электронов и кислые протоны: вода, спирты. Поэтому безводная уксусная кислота, известная также по названием "ледяная", используется как водоотнимающий реагент средней силы.
Основность
Замещение гидроксила В молекулах карбоновых кислот возможно замещение гидроксильной группы, что используется для получения различных функциональных производных. Превращение протекает при действии нуклеофилов. Однако, большинство сильных нуклеофилов являются основаниями, поэтому они в первую очередь депротонируют карбоксильную группу, т.е. превращают кислоту в анион. В карбоксилат-ионе атом углерода не обладает необходимым дефицитом электронной плотности, и реакция останавливается. Применение более слабых нуклеофилов также не приводит к положительным результатам, так как электрофильность карбоксильного углерода кислоты меньше, чем в оксосоединениях, т.к. она погашается +М-эффектом гидросильного кислорода. К примеру, слабый нуклеофил - гидросульфит натрия - к карбоксильной группе не присоединяется.
Поэтому для нуклеофильного замещения гидроксильной группы (реакции ацилирования) подбирают специальные условия. Так, реакцию кислот со спиртами для получения сложных эфиров (этерификация кислот) проводят в присутствии серной кислоты или газообразного хлороводорода, которые выполняют роль катализаторов. Катализ заключается в протонировании карбонильного атома кислорода на первой стадии, что повышает эффективный положительный заряд на углероде и облегчает атаку нуклеофила. На одной из последующих стадий происходит протонирование уже гидроксила и превращение его в хорошую уходящую группу - молекулу H2O.
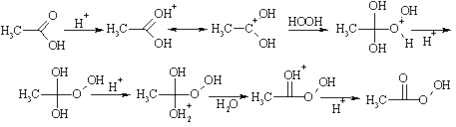
Все стадии реакции этерификации обратимы, поэтому для получения сложного эфира с хорошим выходом необходимо удалять выделяющуюся воду. В классическом варианте синтеза для связывания воды используется та же серная кислота; в других случаях применяют избыток нуклеофила (спирта). Очевидно, что реакция, если рассматривать ее с другой стороны, протекает как замещение в молекуле спирта атома водорода на ацил, поэтому превращение называют ацилированием спирта. Оно относится к большому классу реакций, которые объединены общим названием "реакции ацилирования". По аналогичному механизму протекает взаимодействие карбоновых кислот с пероксидом водорода в кислой среде. В результате этой реакции получаются так называемые надкислоты, имеющие важное значение для органического синтеза: они используются в качестве источников свободных радикалов и окислителей.
В рассмотренных примерах гидроксил путем протонирования превращается в хорошую уходящую группу - молекулу воды, а на первой стадии имеет место активация электрофильного центра кислотой. Аналогично, ацилирование катализируется кислотами Льюиса. Так, при действии на кислоты пентахлорида фосфора или тионилхлорида происходит замещение гидроксильной группы хлором и образуются хлорангидриды кислот. В ходе превращения протон замещается на сильный акцептор электронов, превращающий гидроксил в хорошую уходящую группу.
Однако нужно иметь в виду, что атомы кислорода в этих реакциях меняются местами, т.е. фактически замещается не гидроксильный, а карбонильный, т.к. именно к нему присоединяется кислота Льюиса на первой стадии. Аналогично, превращение кислот в ангидриды при действии пентаоксидом фосфора идет через стадию замещены карбонила на хорошую уходящую группу.
Гидроксил не удается заместить аминогруппой при действии аммиака или аминов на кислоту в мягких условиях. Указанные реагенты являются более сильными основаниями, чем карбонильная группа. Поэтому катализ кислотами, как в реакции этерификации, или замена протона сильным электроноакцептором, как при образовании ацилгалогенидов и ангидридов, в этом случае невозможны. Аммиак и амины образуют соли с карбоновыми кислотами, а карбоксилат-ион электрофилом не является. Тем не менее, при высокой температуре карбоксилаты аммония превращаются в амиды. Это объясняется тем, что соль диссоциирует при нагревании на кислоту и аммиак (амин), который как нуклеофил атакует карбоксильный атом углерода, но процесс этот требует жестких условий.
Можно сказать, что данная реакция идет благодаря термодинамическому фактору: возрастание энтальпии за счет образования стабильного амида и возрастание энтропии за счет образования газообразной в этих условиях воды. Восстановление
Восстановление карбоксильной группы осуществляется действием натрия в спирте (реакция Буно-Блава) или алюмогидридом лития. В обоих случаях восстановление завершается образованием спиртовой молекулы.
Нужно иметь в виду, что восстановление кислот всегда протекает труднее, чем их производных, поэтому на практике превращение группы COOH в CH2OH чаще всего проводят через стадию хлорангидрида или сложного эфира.
Окисление
Карбоновые кислоты вообще устойчивы к действию окислителей. Лишь муравьиная кислота, которую можно рассматривать как кислоту и альдегид одновременно, легко окисляется, и ее соли иногда используют в качестве восстановителей, например, для превращения нитрилов в альдегиды.
Другим исключением являются арилзамещенные алифатические кислоты, типа фенилуксусной, которые окисляются до бензойных с разрывом С-С связи.
Декарбоксилирование
Термическое декарбоксилирование кислот используется для получения алканов - происходит замена карбоксила на водород. В то же время, разложение солей карбоновых кислот в зависимости от условий проведения реакции приводит к образованию продуктов различного строения - могут быть получены как алканы, так и кетоны (из кальциевых солей). Наконец, электролитическое восстановление (реакция Кольбе), тоже сопровождающееся выделением CO2, приводит к алканам димерного строения.
Литература
1. Избранные труды. Гетерогенный катализ. Нефтехимия. Каталитический органический синтез: Х.М. Миначев - Москва, Либроком, 2011 г. - 880 с. 2. История химии белка: А.Н. Шамин - Москва, КомКнига, 2006 г. - 352 с. . Курс современной органической химии: Б.Д. Березин, Д.Б. Березин - Москва, Высшая школа, 2003 г. - 768 с. . Препаративная органическая химия. Реакции и синтезы в практикуме органической химии и научно-исследовательской лаборатории: Л. Титце, Т. Айхер - Санкт-Петербург, Мир, 2009 г. - 704 с. . Руководство к лабораторным занятиям по органической химии: Учебное пособие для вузов (под ред. Тюкавкиной Н.А.) Изд.2-е, перераб., доп. Серия: Высшее образование: Современный учебник: - Москва, 2003 г. - 384 с. . Сборник задач по органической химии: - Москва, Издательство МГУ, 2000 г. - 160 с. . Сборник задач по химии для поступающих в вузы: Г.П. Хомченко, И.Г. Хомченко - Санкт-Петербург, Новая Волна, Умеренков, 2009 г. - 288 с. Содержание Введение 1. Гомологический ряд, номенклатура 2. Получение карбоновых кислот 3. Строение карбоксила и карбоксилат-иона 4. Свойства карбоновых кислот
5. Основность 6. Восстановление 7. Окисление 8. Декарбоксилирование 9. Реакции углеводородного радикала Литература Введение
Класс карбоновых кислот объединяет соединения с функциональной группой - COOH, называемой карбоксилом. Карбоксильную группу можно рассматривать как симбиоз двух функциональных групп, изучавшихся нами ранее, а именно, карбонила и гидроксила.
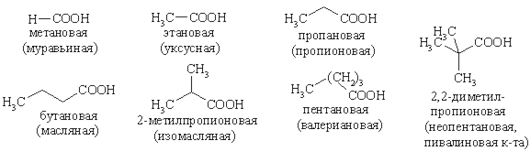
В результате взаимного влияния эти группы придают карбоновым кислотам совокупность химических свойств, однако лишь часть из них имеет аналогию со свойствами спиртов и оксосоединений. Гомологический ряд, номенклатура Гомологический ряд предельных карбоновых кислот начинается муравьиной кислотой. Систематические названия кислот образуются, путем прибавления к названию углеводорода с соответствующим числом углеродных атомов окончания - овая и слова кислота. В ряду карбоновых кислот весьма широкое применение находят тривиальные названия: муравьиная, уксусная, масляная, валериановая, капроновая кислоты.
Карбоксильная группа является одной из наиболее старших среди функциональных групп в органических молекулах. Поэтому в названиях замещенных кислот следует указывать положение заместителя цифрой, причем первый номер имеет атом углерода в составе карбоксила (официальная номенклатура). Альтернативный вариант нумерации подразумевает использование букв греческого алфавита, причем карбоксильный атом углерода не считается, а первый атом радикала обозначают буквой a (тривиальная номенклатура). Для алифатических кислот наблюдается изомерия скелета (нормальная цепь, разветвленная цепь) и оптическая изомерия.
карбоновая кислота карбоксил спирт
Карбоксил может быть соединен также с непредельным радикалом. Для непредельных кислот, кроме вышеперечисленных видов, имеет место также E, Z-изомерия.
Ароматические карбоновые кислоты называют как производные бензойной кислоты, либо кислот других ароматических систем.
Если из карбоксильной группы удалить гидроксил в виде радикала, то останется радикал RCO·, который называют ацильным. Такое же название имеет и заместитель RCO-. Положительно заряженную частицу RCO+, образующуюся в результате отщепления гидроксид-иона, называют катионом ацилия. Ацилы (катионы ацилия) каждой кислоты имеют собственные название: муравьиная - формил (формилий), уксусная - ацетил (ацетилий), бензойная - бензоил (бензоилий) и т.д. О-Анионы карбоновых кислот называются карбоксилат-ионами. Они так же имеют собственные названия: уксусная - ацетат, муравьиная - формиат, бензойная - бензоат. Все эти термины широко используются для названия соединений, имеющих соответствующие заместители.
Получение карбоновых кислот
Реакции окисления Ввиду того, что атом углерода карбоксильной группы находится в максимально возможной для функциональных групп степени окисления, равной +3, кислоты могут быть получены окислением терминального звена углеродной цепи. Действительно, спирты и альдегиды (но не алканы) легко окисляются до карбоновых кислот. Для этого используют широкий спектр окислителей - от таких мягких, как соли Cu (II) до сильнейших (CrO3 в серной кислоте, KMnO4). Как правило, альдегиды окисляются легче спиртов, поэтому окисление первичного спирта сильными окислителями идет до карбоновой кислоты, не останавливаясь на стадии промежуточного образования альдегида.
Кислоты ароматического ряда могут быть получены окислением углеводородных боковых цепей. Это связано с тем, что на первой стадии окисления происходит одного электрона или отрыв гидрид-иона от a-углеродного атома и образование катион-радикала или катиона, соответственно, которые резонансно-стабилизированны ароматическим кольцом. При окислении боковой цепи, содержащей 2, 3 и более атомов углерода, в карбоксил превращается лишь связанный с кольцом С-атом, все другие окислятся до СО2 и Н2О ("отгорание боковой цепи"). Среди ароматических соединений легче всего окисляются альдегиды, особенно, орто-замещенные. Бензальдегид быстро превращается в бензойную кислоту на воздухе.
|
|||||||||
|
Последнее изменение этой страницы: 2020-03-13; просмотров: 113; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.117.107.90 (0.065 с.) |