
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Тема: Молекулярная физика. Термодинамика.
Цель: усвоить основные законы молекулярно-кинетической теории газов научиться применять их при решении задач
Краткие теоретические сведения
Таблица 2.3 – Основные законы и формулы
Примеры решения задач
1.Найти массу атомов: 1) водорода; 2) гелия. 3) молекулы СО2 Дано: 1) водород (Н2) 2) гелия (Не) 3) молекулы СО2 Найти: 1) m0 (Н2) –?, 2) m0 (Не) –?, 3) m0 (СО2) –? Решение Молярная масса газа
где m0 – масса атома, NA – число Авогадро, отсюда
Пользуясь таблицей Менделеева, определим молярные массы вещества
Вычислим
Ответ: 2. Какова средняя кинетическая энергия молекулы газа, если его давление равно 5.104 Па, а в объеме 12 л содержится 6.1024 молекул? Дано: р=5.104 Па V=12 л=12·10-3м3 N=6·1024 Найти: Ek=? Решение: Из основного уравнения молекулярно-кинетической теории
где
Ответ: 3 Определите массу газа, объем которого 5 м3, давление 3 атм, а средняя квадратичная скорость молекул 1500 м/с. Дано: V=5 м3, Р=3 атм = 3·105Па,
Найти: m –? Решение Средняя квадратичная скорость молекул
где R – универсальная газовая постоянная, T – термодинамическая температура, μ – молярная масса газа. Возведем к квадрат уравнение (1) получим:
Из уравнение Менделеева – Клапейрона
или
Подставим уравнение (3) в (2)
отсюда
Ответ: 3. Газ при температуре t =150С и давлении р= 200 кПа имеет плотность ρ = 0,34 кг/м3. Найти молярную массу μ газа. Дано: t=150С, Т=273+15=288 К, р= 200 кПа=2·105Па, ρ = 0,34 кг/м3. Найти: μ –? Решение Из уравнения Менделеева – Клапейрона
где V – объем газа, R – универсальная газовая постоянная,
Плотность газа
Тогда
отсюда
Ответ: 4. Какой объем занимает смесь азота массой 2 кг и гелия массой 1 кг при нормальных условиях. Чему равна молярная масса смеси? Дано: m1 = 2 кг, m2 = 1 кг, Т = 273К, р = 105Па, μ1(N2)=28·10-3кг/моль, μ2(Не) = 4·10-3кг/моль. Найти: V –? μ –? Решение Объем смеси газов
где V1 – объем азота, V2 – объем гелия. Объемы газов найдем из уравнения Менделеева – Клапейрона:
отсюда
где R – универсальная газовая постоянная, р – давление газа, Т – термодинамическая температура, тогда
Молярная масса смеси μ есть отношение массы смеси m к количеству вещества смеси ν, т.е
Масса смеси равна сумме масс компонентов смеси m=m1+m2. Количество вещества смеси равно сумме количеств вещества компонентов. Подставив в формулу
Ответ: 5. Внутренняя энергия некоторого количества азота при температуре 20º равна 4·103 Дж. Определить массу газа. Дано: μ2(N2)=24·10-3кг/моль, t = 20ºC, Т = 273+20=293 К U = 4·103 Дж. Найти: m –? Решение Внутренняя энергия газа
где m – масса газа, μ – молярная масса газа, R – универсальная газовая постоянная, T – термодинамическая температура, i – число степеней свободы молекулы, так как азот двухатомный, то i =5, тогда
Ответ: 6. Одноатомный газ был нагрет при постоянном давлении р = 90 кПа. В результате его объем увеличился на D V = 2 см2. Найти: 1) совершенную газом работу, 2) приращение внутренней энергии D U газа, 3) количество теплоты Q, сообщенное газу. Дано: р = 90 кПа = 90·103Па, DV = 2 см3 = 2·10-6м3, p=const, i = 3. Найти: А –? DU –? Q –? Решение При изобарном процессе Р = const первый закон термодинамики можно записать в виде:
где А – работа,
р – давление газа, DV – изменение объема газа.
ΔU – изменение внутренней энергии газа, вычисляется по формуле:
где i – показатель степени свободы молекулы, i = 3, так как гелий одноатомный газ, R –универсальная газовая постоянная, μ – молярная масса гелия. Из уравнения Менделеева – Клапейрона
тогда
Количество теплоты
Ответ: 7. Газ расширяясь изобарно при давлении 2.105 Па, совершает работу 200 Дж. Определить первоначальный объем газа, если конечный объем равен 2,5 л. Дано: р=2.105 Па, А = 200 Дж, p=const, V2 = 2,5 л = 2,5·10-3м3. Найти: V1 –? Решение Работа при изобарном процессе вычисляется по формуле:
где р – давление газа, V1 – начальный объем, V2 – конечный объем газа, отсюда
Ответ: 8. Какой должна быть температура нагревателя, для того чтобы в принципе стало возможным достижение значения КПД тепловой машины 80%, если температура холодильника 270С? Дано: η=80%, Т2 = 270С. Найти: Т1 –? Решение КПД идеальной тепловой машины:
где Т1 – температура нагревателя, Т2 – температура холодильника. Преобразуем выражение (1)
Т2 = 27+273=300К,
Ответ: 9. Идеальная тепловая машина работает по циклу Карно. Определить к.п.д. цикла, если известно, что за один цикл была произведена работа, равная 3000 Дж, и холодильнику было передано 1,35·104 Дж теплоты. Дано: А = 3000 Дж, Q2 = 1,35·104 Дж. Найти: η –? Решение КПД тепловой машины
где А – совершаемая работа, Q1 – количество теплоты полученное от нагревателя. Работа равна:
где Q2 – количество теплоты, преданное холодильнику, отсюда
тогда
Ответ: 10. В процессе работы тепловой машины за некоторое время рабочим телом было получено от нагревателя количество теплоты Q 1 =1,5·106Дж, передано холодильнику Q 2 =-1,2·106Дж. Вычислите КПД машины и сравните его с максимально возможным КПД машины, если температура нагревателя и холодильника соответственно равны 2500С и 300С. Дано: Q1=1,5·106Дж, Q2=-1,2·106Дж, Т1 = 2500С, Т2 = 300С. Найти: η1 –? η2 –? Решение КПД тепловой машины
где Q1 – количество теплоты, полученное от нагревателя, Q2 – количество теплоты, преданное холодильнику,
КПД идеальной тепловой машины:
где Т1 – температура нагревателя, Т2 – температура холодильника. Т1 = 250+273=523К, Т2 = 30+273=303К, тогда
Ответ:
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2020-03-02; просмотров: 182; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.71.142 (0.095 с.) |




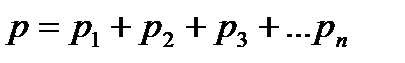
 - концентрация молекул, число молекул в единице объема,
- концентрация молекул, число молекул в единице объема,  - средняя квадратичная скорость молекул
- средняя квадратичная скорость молекул




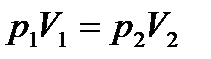 ;
2)
;
2)  ;
3)
;
3) 

 ;
2)
;
2)  ;
3)
;
3) 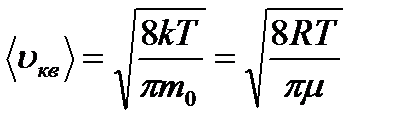
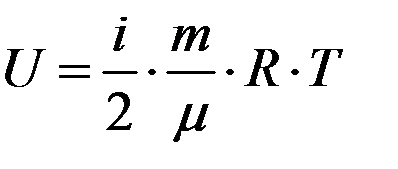





 Формулы
Формулы
 ;
1)
;
1) 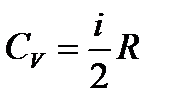 ;
2)
;
2)  ;
;



 ,
, .
. ,
, ,
, .
. ,
, ,
, .
. ,
,  ,
, 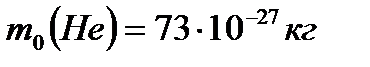

 - концентрация. Тогда
- концентрация. Тогда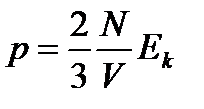 ,
, ,
, ,
,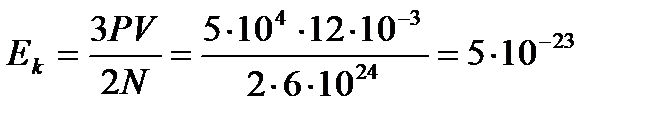 Дж
Дж Дж
Дж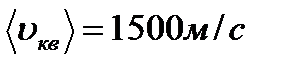 .
. , (1)
, (1) . (2)
. (2)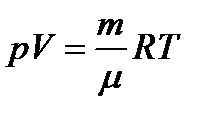 ,
, (3)
(3) ,
,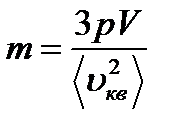 ,
, ,
,
 .
. ,
,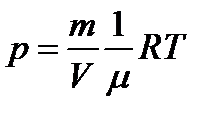 .
. ,
,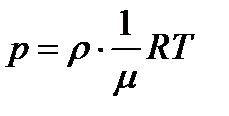 ,
, ,
, ,
, .
.
 ,
, ,
, ,
,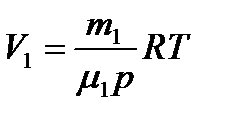 ,
, ,
, ,
, ,
, .
. .
. , выражения m=m1+m2 и
, выражения m=m1+m2 и  , получим
, получим ,
, ,
,
 ,
,  .
. ,
, ,
, ,
,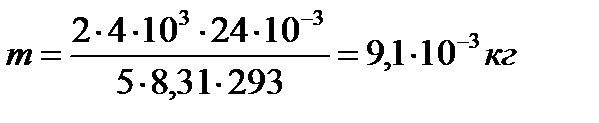
 .
. ,
, ,
, ,
,
 ,
, ,
, ,
,

 .
. ,
,  ,
,  .
. ,
, ,
, ,
,
 .
. , (1)
, (1)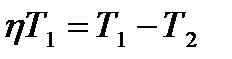 .,
., ,
, ,
,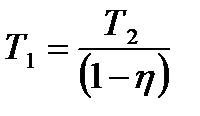 ,
, .
. .
. , (1)
, (1) ,
, ,
, ,
, .
.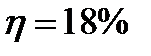 .
.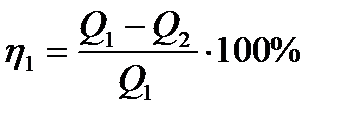 ,
,
 ,
,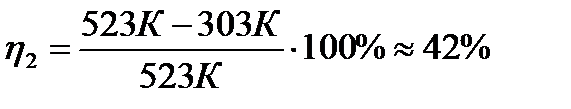 .
. ,
, 



