
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Термохимические уравнения реакций
С помощью указанной методики можно определить тепловой эффект реакций HNO3(р-р) + NaOH(р-р) = NaNO3(р-р) + H2O(ж) + Q1 HNO3(р-р) + NH3(р-р) = NH4NO3(р-р) + Q2 2. Метод расчета теплового эффекта реакции взаимодействия NH4NO3(р-р) и NaOH(р-р) Тепловой эффект реакции: NH4NO3(р-р) + NaOH(р-р) = NaNO3(р-р) + NH3(р-р) + H2O + Q3 по закону Гесса равен Q3 = Q1 – Q2 Критерии оценивания: 1) Методика определения теплового эффекта реакции – 6 баллов 2) Термохимические уравнения реакций: 2 реакции по 3 балла – 6 баллов 3) Метод расчета теплового эффекта реакции взаимодействия нитрата аммония (раствор) и гидроксида натрия (раствор) по закону Гесса – 6 баллов 4) Экспериментальное определение изменения температуры в процессе реакции в диапазоне 16–22 °С для реакции HNO3 + NaOH и 14–18 °С для реакции HNO3 + NH3 – 2 балла за каждый эксперимент – 4 балла 5) Расчет теплового эффекта реакции HNO3 + NaOH (принимаются значения 45–65 кДж/моль) – 2 балла 6) Расчет теплового эффекта реакции HNO3 + NH3 (принимаются значения 40–60 кДж/моль) – 2 балла 7) Расчет теплового эффекта реакции NH4NO3 + NaOH (принимаются значения (-1) – (-10) кДж/моль) – 4 балла 8) За несоблюдение техники безопасности полагаются штрафные баллы, (-1) балл за каждое нарушение Альтернативное решение: 1. Методика определения теплового эффекта реакции: 1) Смешайте в термокружке 50 мл раствора NH4OH и HNO3 для получения раствора NH4NO3 2) Дождитесь охлаждения полученного раствора до комнатной температуры. Измерьте температуру раствора с помощью термометра. Запишите полученное значение начальной температуры раствора (T0) 3) Отмерьте 50 мл раствора NaOH и быстро залейте его в мерную кружку. Перемешайте раствор стеклянной палочкой. 4) Опустите термометр в термокружку. С помощью термометра следите за температурой полученного раствора. Когда температура прекратит изменяться, запишите полученное значение конечной температуры раствора (T1) 5) Рассчитайте количество выделившегося тепла (Q) в ходе реакции по формуле: Q = c∙m∙(T1 – T0), где с – удельная теплоемкость раствора, m – масса раствора (0,15 кг). 6) Тепловой эффект реакции равен количеству выделившегося тепла, деленному на количество вещества вступивших в реакцию веществ (3 моль/л∙0,05 л = 0,15 моль). Термохимические уравнения реакций С помощью указанной методики можно определить тепловой эффект реакций
NH4NO3(р-р) + NaOH(р-р) = NaNO3 (р-р) + NH3(р-р) + H2O(ж) + Q Тепловой эффект реакции, рассчитанный в пунктах 5-6 методики, соответствует тепловому эффекту реакции нитрата аммония (раствор) и гидроксида натрия (раствор). Критерии оценивания (альтернативное решение): 1) Методика определения теплового эффекта реакции – 6 баллов (0 баллов, если не указано, что раствор нитрата аммония должен остыть до комнатной температуры) 2) Термохимическое уравнение реакции NH4NO3 + NaOH – 6 баллов Уравнение реакции HNO3 + NaOH – 6 баллов 3) Экспериментальное определение изменения температуры в процессе реакции в диапазоне (-0,5) – (-3) °С для реакции NH4NO3 + NaOH – 4 балла 4) Расчёт теплового эффекта NH4NO3 + NaOH (принимаются значения (-2) – (-13) кДж/моль) - 8 баллов 5) За несоблюдение техники безопасности полагаются штрафные баллы, (-1) балл за каждое нарушение
Класс
1. Методика определения мольных долей Cu и Ni в монетном сплаве 1) Для приготовления анализируемого раствора монету необходимо растворить в азотной кислоте, затем удалить избыток азотной кислоты с помощью карбамида: a) M + 4HNO3(конц.) = M(NO3)2 + 2NO2 + 2H2O или 3M + 8HNO3(разб.) = 3M(NO3)2 + 2NO + 4H2O; b) HNO3 + (NH2)2C=O = (NH2)2C=OH+ NO3-. Полученный раствор количественно переносят в мерную колбу, разбавляют до метки. 2) Для определения суммарной концентрации ионов меди и никеля отберите с помощью пипетки аликвоту раствора в колбу для титрования, разбавьте ее водой. Добавьте аммиачный буфер (примерно 5 мл) до появления синей окраски, затем – индикатор мурексид на кончике шпателя. Бюретку промойте раствором трилона Б, затем заполните её этим раствором. При постоянном перемешивании добавляйте по каплям раствор трилона Б к пробе до перехода окраски из желтой или желто-зеленой в лиловую. Для проверки повторите эксперимент еще 2 раза – результаты должны сойтись в пределах 0,1 мл. 3) Для определения концентрации ионов меди отберите с помощью пипетки аликвоту раствора в колбу для титрования, разбавьте ее водой и добавьте 10-15 мл раствора иодида калия. Поставьте колбу в темное место (или оберните ее фольгой) на 5 минут. Бюретку промойте раствором тиосульфата натрия, затем заполните её этим раствором. При постоянном перемешивании добавляйте по каплям раствор тиосульфата натрия к пробе до постепенного исчезновения выделившегося иода. Вблизи точки эквивалентности добавьте 5 капель раствора крахмала и продолжите добавление раствора тиосульфата натрия до исчезновения синей окраски. Для проверки повторите эксперимент еще 2 раза – результаты должны сойтись в пределах 0,1 мл.
4) На основании полученных данных определите концентрации ионов меди и никеля в приготовленном растворе и мольные доли этих металлов в монетном сплаве.
2. Уравнения реакций, о которых идёт речь в задаче: 1) M + 4HNO3(конц.) = M(NO3)2 + 2NO2 + 2H2O или 3M + 8HNO3(разб.) = 3M(NO3)2 + 2NO + 4H2O 2) HNO3 + (NH2)2C=O = (NH2)2C=OH+ NO3- 3) M2+ + H2(C10H12O8N2)2– = M(C10H12O8N2)2– + 2H+ 4) 2Cu(NO3)2 + 4KI = I2 + 2CuI + 4KNO3 5) I2 + 2Na2S2O3 = 2NaI + Na2S4O6
3. Далее приведены расчётные формулы. 1) Общее количество ионов меди и никеля в аликвоте:
2) Количество ионов меди в аликвоте:
3) Соотношение количеств ионов металлов в аликвоте пропорционально соотношению их количеств в объеме мерной колбы, а также соотношению в исходной монете. Тогда мольные доли металлов можно выразить следующим образом:
4. Восстановление иода, связанного в иод-крахмальный комплекс, протекает слишком медленно, что может привести к перетитрованности раствора. Поэтому крахмал следует добавлять только в конце титрования.
Рекомендации к оцениванию:
Класс 1. Методика определения концентрации I2 в ходе реакции. Внесите в колбу на 100 мл 60 мл раствора хлорида железа и 40 мл раствора иодида калия и закройте колбу пробкой. Подготовьте колбы для титрования, налейте в них по 100 мл воды (примерно) и поместите в охлаждающую смесь. Бюретку промойте раствором тиосульфата натрия, затем заполните её эти раствором. Через 20 минут с помощью пипетки отберите аликвоту исследуемого раствора в колбу для титрования и определите концентрацию иода. В ходе титрования при постоянном перемешивании добавляйте по каплям раствор тиосульфата натрия к реакционной смеси, по достижении светло-желтой окраски добавьте 5 капель крахмала и быстро оттитруйте до исчезновения синей окраски. Повторяйте отбор пробы и титрование каждые 20 минут до достижения равновесия.
2. Уравнения реакций восстановления Fe(III) иодидом без избытка KI (уравнение (1)) и с избытком KI (уравнение (2)):
3. Выражения констант равновесия для этих двух процессов:
4. Далее приведены расчётные формулы.[3] 1) 2) 3) 4) 5) 6) 5. Причины расхождения константы, найденной в ходе эксперимента Кравн и рассчитанной теоретически Ктеор: гидролиз ионов железа (стандартные потенциалы относятся к рН = 1); образование комплексов ионов железа с хлорид-ионами. 6. Уравнение реакции иода с тиосульфатом натрия: I2 + 2Na2S2O3 = 2NaI + Na2S4O6 7. Доказательством достижения равновесия служит неизменность концентрации иода во времени. Рекомендации к оцениванию:
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2019-11-02; просмотров: 254; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.138.138.144 (0.021 с.) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||


 %
%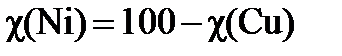


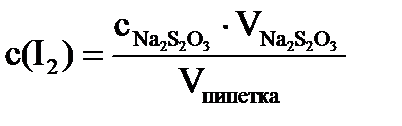 ;
; ;
; ;
; ;
; ;
; , Kтеор = 4200
, Kтеор = 4200


